木瓜蛋白酶酶解核桃饼粕制备抗氧化多肽的研究
2019-07-22王攀范娜
王攀 范娜
摘要:以核桃饼粕为原料,研究优化木瓜蛋白酶酶解核桃饼粕制备抗氧化活性多肽的工艺条件。通过研究酶解温度、酶解时间、底物浓度、酶添加量以及酶解pH值对酶解产物抗氧化活性的影响,正交优化酶解工艺参数,并将酶解物利用葡聚糖凝胶层析柱进行分离,测定其抗氧化活性。结果表明,当木瓜蛋白酶在酶解温度为60 ℃、酶解时间为 3.5 h、底物浓度为2.5 g/100 mL、加酶量为6 500 U/g、pH值为6.5的酶解条件下,酶解物的抗氧化活性较好,酶解液对二苯代苦味酰基自由基(DPPH·)和羟基自由基的清除率分别为52.24%和53.20%;酶解液经葡聚糖凝胶层析柱分离,酶解物分离多肽的分子量越大,抗氧化活性越低。
关键词:核桃饼粕;木瓜蛋白酶;抗氧化活性;生物活性肽
中图分类号: TS209 文献标志码: A 文章编号:1002-1302(2019)11-0238-04
收稿日期:2018-03-09
基金项目:陕西省农业科技创新与攻关项目(编号:2016NY-147);商洛学院服务地方经济社会发展专项(编号:2015SKY-FWDF004)。
作者简介:王 攀(1983—),男,陕西宝鸡人,硕士,讲师,主要从事农产品综合利用及新产品开发。Tel:(0914)2398182;E-mail:w1p2004@163.com。 核桃营养价值较高,含有丰富的油脂和蛋白质,在工业生产中常被作为榨油用料[1],核桃饼粕是核桃油深加工的副产物[2],大多作为动物饲料,目前对其利用具有一定的局限性,主要集中于蛋白质与多肽的开发方面[3]。虽然核桃饼粕中蛋白质含量高达30%~50%[4],但核桃蛋白溶解性较低[5],限制了食品加工中核桃蛋白的利用[6]。近年来,对核桃饼粕的深加工已逐步开展起来,主要是利用核桃饼粕制备核桃多肽[7],核桃多肽不仅具有良好的溶解性,而且还具有易消化吸收、促进微生物发酵以及抗氧化等生理活性[6]。抗氧化肽是一种具有抗氧化活性的生物活性肽,具有清除体内自由基的功能,是一种潜在的、可以利用的外源性抗氧化物质[8],且采用酶水解核桃蛋白可以制得具有抗氧化活性的生物活性肽[9]。本研究主要以核桃饼粕为原料,通过研究酶解温度、酶解时间、底物浓度、酶添加量以及酶解pH值等因素对木瓜蛋白酶酶解核桃饼粕产物抗氧化活性的影响,正交优化酶解工艺参数,并对酶解物利用葡聚糖凝胶层析柱进行分离,考察分离物的抗氧化活性,以期为核桃饼粕抗氧化活性多肽的制备提供参考。
1 材料与方法
1.1 试验材料
1.1.1 试验材料与试剂 核桃饼粕,购自洛南食品加工厂;木瓜蛋白酶(酶活性100 000 U/g),购自南宁宏博生物工程有限公司;DPPH,购自Sigma公司;无水乙醇、乙醚、氢氧化钠、盐酸、磷酸氢二钾、磷酸二氢钾、H2O2溶液、邻二氮菲均为分析纯。
1.1.2 试验设备 FA1004型电子分析天平,购自北京赛多利斯仪器系统有限公司;755B型紫外可见分光光度计,购自上海精密科学仪器有限公司;TDL-40B型低速台式离心机,购自上海安亭科学仪器厂;HH-4型电热恒温水浴锅,购自北京科伟永兴仪器有限公司;UV-1100型紫外可见分光光度计,购自上海美析仪器有限公司。
1.2 试验方法
1.2.1 核桃蛋白的制备 将10 g核桃饼粕溶解在100 mL磷酸缓冲液(pH值为7.5~10.0)中,调节温度至60 ℃,并用NaOH溶液(3.5 mol/L)调节pH值至8.5~9.0,在溶解过程中不断搅拌1 h,冷却后,4 000 r/min离心20 min,取上清液,用HCl(1 mol/L)将pH值调至4.0~5.0,静置30 min,4 000 r/min 离心20 min,取沉淀低温干燥或风干,得核桃蛋白,备用[10]。
1.2.2 核桃多肽液的制备 取3 g核桃蛋白溶于100 mL水中,在60 ℃水浴锅中保温30 min,用1 mol/L NaOH溶液调pH值至6.5,并维持pH值和温度恒定,加入7 000 U/g木瓜蛋白酶,酶解4 h后,沸水浴灭酶10 min,迅速冷却后,4 000 r/min 离心15 min,取上清液备用[11]。
1.2.3 单因素试验 利用木瓜蛋白酶按照“1.2.2”节的方法酶解核桃饼粕,并固定其他条件,分别单一改变其中酶解温度(50、55、60、65、70 ℃)、底物浓度(2.0、2.5、3.0、3.5、4.0 g/100 mL)、酶添加量(6 000、6 500、7 000、7 500、8 000 U/g)、酶解时间(3.0、3.5、4.0、4.5、5.0 h)、酶解pH值(5.5、6.0、6.5、7.0、7.5),获得酶解液,考察核桃饼粕酶解物的抗氧化活性。
1.2.4 正交试验 在单因素的基础之上,选择4个影响较大的因素进行正交试验,对木瓜蛋白酶酶解核桃蛋白制备抗氧化多肽的工艺参数进行优化。
1.3 测定方法
1.3.1 清除二苯代苦味酰基自由基(DPPH·)能力的测定配制0.02 mol/L DPPH溶液,取2 mL置于试管中,加入 2 mL 无水乙醇摇匀,避光静置30 min,用无水乙醇作参比,在517 nm下测定吸光度,记为D1;另将2 mL酶解液与2 mL 0.02 mol/L DPPH溶液充分混合,避光静置30 min,并以2 mL酶解液与 2 mL 无水乙醇混合作为参比测定其吸光度,记为D2[12-14]。DPPH自由基清除率计算公式如下:
清除率=D1-D2D1×100%。
1.3.2 清除羟基自由基(·OH)能力的测定 采用鄰二氮 菲-Fe2+ 氧化法[12-15]测定核桃饼粕酶解物清除羟基自由基的能力。(1)吸取15 mmol邻二氮菲应用液 1 mL 放于试管中,先加入pH值为7.5的磷酸缓冲液2 mL以及1 mL的蒸馏水,充分振荡后加入0.75 mmol/L硫酸亚铁溶液1 mL,立刻混匀,最后加入1% H2O2溶液1 mL,室温下静置 1 h。在波长为536 nm处测定吸光度,记为Db;(2)同上,用1 mL蒸馏水代替(1)中的H2O2溶液,在波长为536 nm处测定吸光度,记为Dc;(3)用1 mL酶解液代替(1)中的蒸馏水,在波长为536 nm处测定吸光度,记为Da;羟基自由基清除率计算公式如下:
清除率=Da-DbDc-Db×100%。
1.3.3 Sephadex G-50层析分离核桃蛋白 层析条件如下:层析柱中凝胶为葡聚糖凝胶G-50;柱床体积为1.6 cm×60.0 cm;上样量为2 mL;流速为0.16 mL/min;缓冲液为去离子水;柱温为室温(25 ℃左右)。
用去离子水调节流速,冲洗凝胶柱,待柱平衡后,取正交试验最优酶解条件下所得的核桃饼粕蛋白多肽液2 mL进行上样,每小时收集1管,测定其抗氧化活性。
2 结果与分析
2.1 单因素试验结果与分析
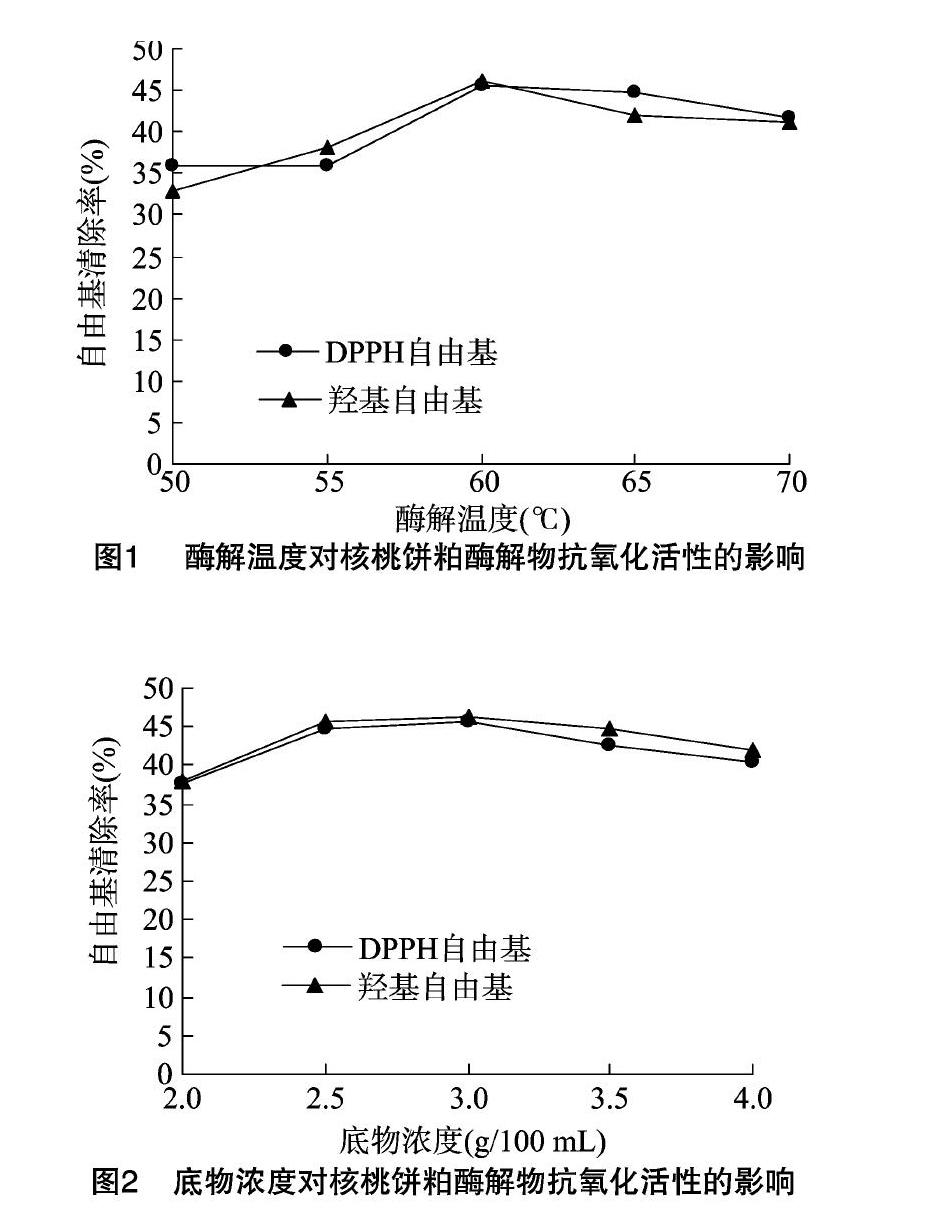
2.1.1 酶解温度对核桃饼粕酶解物抗氧化活性的影响 由图1可知,木瓜蛋白酶酶解温度对核桃饼粕酶解物的抗氧化活性有一定的影响。随酶解温度的升高,核桃饼粕酶解物的抗氧化活性整体呈现先增后减的趋势,当酶解温度为60 ℃时,DPPH自由基和羟基自由基清除率都达到最高,但随着酶解温度的继续升高,抗氧化活性逐渐降低,这主要是由随温度的继续升高,木瓜蛋白酶的活性在高温下逐渐降低所致。
2.1.2 底物浓度对核桃饼粕酶解物抗氧化活性的影响 由图2可知,木瓜蛋白酶酶解底物浓度对核桃饼粕酶解物的抗氧化活性有一定的影响。当底物浓度为2.0~2.5 g/100 mL时,随底物浓度的增加,核桃饼粕酶解物的抗氧化活性逐渐增强,当底物浓度为2.5 g/100 mL时,DPPH自由基和羟基自由基清除率都达到最高,但随底物浓度的进一步增大,核桃饼粕酶解物的抗氧化活性基本稳定。
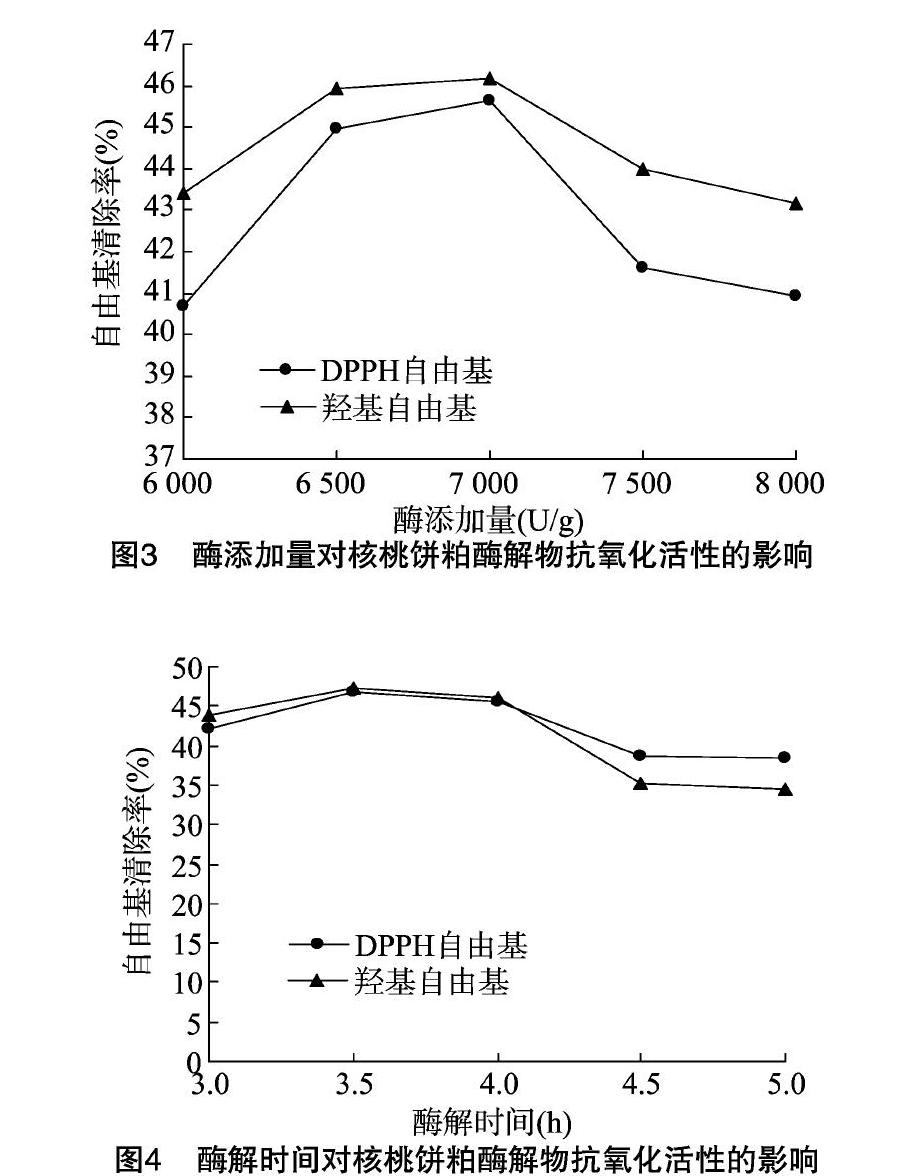
2.1.3 酶添加量对核桃饼粕酶解物抗氧化活性的影响 由图3可知,木瓜蛋白酶添加量对核桃饼粕酶解物抗氧化活性有明显的影响,随酶添加量的增大,核桃饼粕酶解物对DPPH自由基和羟基自由基的清除率均呈现先增后减的趋势,且核桃饼粕酶解物对DPPH自由基清除率明显低于羟基自由基。当酶添加量为7 000 U/g时,DPPH自由基和羟基自由基清除率都达到最高,但当酶添加量在6 500~7 000 U/g范围内时,核桃饼粕酶解物的抗氧化活性变化不大。
2.1.4 酶解时间对核桃饼粕酶解物抗氧化活性的影响 由图4可知,木瓜蛋白酶酶解时间对核桃饼粕酶解物抗氧化活性有一定的影响。当酶解时间为3.0~4.0 h时,随酶解时间的延长,核桃饼粕酶解物的抗氧化活性变化较小;当酶解时间大于4.0 h时,核桃饼粕酶解物的抗氧化活性随酶解时间的延长呈现下降趋势;酶解3.5 h时,核桃饼粕酶解物对DPPH自由基和羟基自由基清除率都达到最高,分别为46.73%、47.28%。
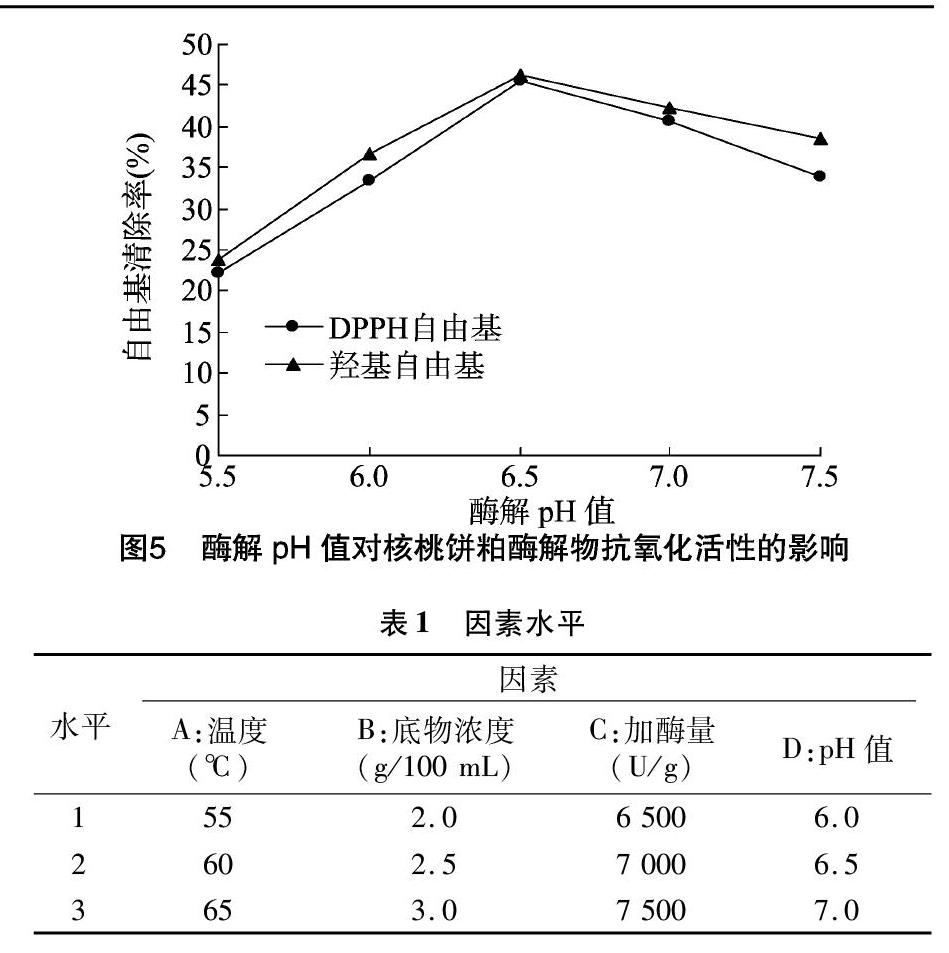
2.1.5 酶解pH值对核桃饼粕酶解物抗氧化活性的影响 由图5可知,木瓜蛋白酶酶解pH值对核桃饼粕酶解物抗氧化活性有明显的影响。随着酶解pH值的升高,核桃饼粕酶解物的抗氧化活性先升高后降低;当酶解pH值为6.5时,核桃饼粕酶解物对DPPH自由基和羟基自由基清除率都达到最高,分别为45.64%、46.16%。
2.2 正交试验结果与分析
根据单因素试验结果,以酶解温度、底物浓度、酶添加量(加酶量)、酶解pH值4个因素进行正交试验,优化木瓜蛋白酶酶解制备核桃抗氧化多肽工艺条件。
由表2可知,4种因素对DPPH自由基清除率的影响大小依次为温度>加酶量>pH值>底物浓度,对羟基自由基清除率的影响大小依次为温度>底物浓度>pH值>加酶量。且最佳水平组合均为A2B2C1D2,即酶解温度60 ℃、底物浓度2.5 g/100 mL、酶添加量6 500 U/g、酶解pH值6.5,在上述条件下,经验证试验DPPH自由基清除率达到52.24%,羟基自由基清除率达到53.20%。
2.3 葡聚糖凝胶层析
按照“1.3.3”节的方法将酶解液过葡聚糖凝胶层析柱,按时间顺序,每小时收集1管,共收集7管,并按收集时间进行编号,测每管洗脱液的抗氧化活性,结果见表3。
由表3可知,不同分离物之间抗氧化性存在明显差异,且当洗脱时间小于1 h或大于6 h时,其分离物无抗氧化活性;当洗脱时间为2~6 h时,随洗脱时间的延长,分离物的抗氧化活性逐渐增强,洗脱时间为6 h时,分离物的抗氧化活性最强,对DPPH自由基和羟基自由基清除率分别为42.38%和44.49%。根据凝胶层析分离原理,分子量大的物质先流出凝胶柱,分子量小的物质后流出凝胶柱[16-17],由此可知,2~6管分离物的分子量依次降低,说明分离物的抗氧化活性随分子量的减小逐渐增强。
4 结论
木瓜蛋白酶酶解核桃饼粕时,酶解温度、酶解时间、底物浓度、酶添加量以及酶解pH值对酶解产物抗氧化活性均有一定的影响,且当木瓜蛋白酶在酶解温度为60 ℃、酶解时间为3.5 h、底物浓度为2.5 g/100 mL、加酶量为6 500 U/g、pH值为6.5的酶解条件下,酶解物的抗氧化活性较好,酶解液对DPPH自由基和羟基自由基的清除率分别为52.24%和53.20%。
木瓜蛋白酶酶解核桃饼粕,其酶解所得多肽液的抗氧化活性随分子量的增大逐渐降低。
参考文献:
[1]田娅玲. 核桃抗氧化肽的制備及其分离纯化[D]. 贵阳:贵州大学,2016.
[2]王 端. 葛根核桃肽复合饮料的研制[D]. 贵阳:贵州大学,2016.
[3]梁 杏. 核桃饼粕多酚提取纯化及其抗氧化和降脂活性初步研究[D]. 昆明:云南中医学院,2016.
[4]张庆祝,丁晓雯,陈宗道,等. 核桃蛋白质研究进展[J]. 粮食与油脂,2003(5):21-23.
[5]章亭洲. 山核桃的营养、生物学特性及开发利用现状[J]. 食品与发酵工业,2006,32(4):90-93.
[6]马 岩,孟宪军. 核桃抗氧化多肽喷雾干燥的工艺优化[J]. 食品工业科技,2016,37(12):243-249.
[7]颜小捷,蒋周田,杨子明,等. 核桃多肽的制备及其体外抗氧化性研究[J]. 食品研究与开发,2016,37(2):40-43.
[8]Rajapakse N,Mendis E,Byun H G,et al.Purification and in vitro antioxidative effects of giant squid muscle peptides on free radical-mediated oxidative systems[J]. Journal of Nutrition Biochemistry,2005,16(9):562-569.
[9]劉昭明,黄翠姬,巫俊良,等. 木瓜蛋白酶水解核桃蛋白的工艺条件优化及水解物抗氧化活性研究[J]. 安徽农业科学,2009,37(13):6136-6138.
[10]郭兴峰,陈计峦,林 燕,等. 热榨和冷榨核桃饼粕中蛋白质提取及其性质研究[J]. 农业工程学报,2012,28(18):287-292.
[11]李艳伏,徐怀德,陈金海,等. 木瓜蛋白酶酶解核桃粕蛋白产物抗氧化活性研究[J]. 中国食品学报,2008,8(5):8-14.
[12]刘昭明,黄翠姬,孟陆丽,等. 核桃蛋白肽的抗氧化活性研究[J]. 食品与发酵工业,2009,35(1):58-61.
[13]Chen H M,Muramoto K,Yamauchi F,et al. Antioxidant activity of design peptides based on the antioxidant peptide isolated from digests of a soybean protein[J]. Journal of Agricultural and Food Chemistry,1996,44(9):2619-2623.
[14]朱艳华,谭 军. 玉米多肽抗氧化作用的研究[J]. 中国粮油学报,2008,23(1):36-38,43.
[15]Chen H M,Muramoto K,Yamauchi F,et al. Antioxidative properties of histidine-containing peptides designed from peptide fragments found in the digests of a soybean protein[J]. Journal of Agricultural and Food Chemistry,1998,46(1):49-53.
[16]周丽卿. 鹰嘴豆多肽的制备及其改性研究[D]. 杨凌:西北农林科技大学,2012.
[17]赵 伟. 牡丹花化学成分分离与鉴定[D]. 济南:山东师范大学,2016.
