猪繁殖与呼吸综合征及其疫苗的研究现状和防控措施
2019-07-22汤建立赵善廷
汤建立,赵善廷
(1.武汉科前生物股份有限公司,湖北 武汉 430000;2.西北农林科技大学动物医学院,陕西 杨凌 712100)
1 猪繁殖与呼吸综合征危害及流行史
猪繁殖与呼吸综合征(PRRS)又称为猪蓝耳病,由猪繁殖与呼吸综合征病毒(PRRSV)感染引起,主要以母猪严重的繁殖障碍、新生及断奶仔猪严重的呼吸障碍、生长迟缓、高死亡率等为特征的一类严重危害养猪业发展的传染性疾病,被世界动物卫生组织列为法定报告B类动物疫病,在我国属于二类动物疫病[1]。1987年,PRRS最早在美国暴发并迅速流行,据统计在1987年至1991年间,美国19个州的1 611个猪场以及加拿大3个省的187个猪场遭受PRRS侵袭,对美国养猪业造成巨大的经济损失,并且由于PRRSV的不断变异,至今美国养猪业仍然遭受着严重危害。1990年,PRRS在欧洲流行,德国最早暴发疫情,临床症状与美国疫情症状高度相似,随后PRRS迅速在欧洲大陆传播流行,其中荷兰、西班牙、英国、比利时等国家疫情较为严重,据统计仅在1990-1993年间,仅北欧就有5 000个猪场暴发PRRS,对欧洲养猪也造成了严重的损失[2]。而在我国,郭宝清等人在1996年首次分离到了PRRSV,并命名为CH-1a株[3],随后,杨汉春等人分离到了BJ-4毒株并首次完成全基因组测序[4],从而明确了PRRS在我国的流行。据统计,在1996-1998年间,由于我国兽医工作人员对PRRS的认识不足、养殖水平低下、防控不利等原因,致使PRRS大规模暴发流行,给我国养殖农户和企业造成严重的损失;此后,随着疫苗使用、提高防控力度等多项措施的实行,我国PRRS逐渐进入平稳期,感染猪主要呈现抗体阳性但不排毒的稳定状态。2006年,我国江西省首次暴发与PRRS相似临床症状的疾病,且发病急、发病率高、死亡率高,田克恭[5]等人通过病毒分离、病毒基因组测序等技术手段确定了病原为PRRV的高度变异株,并命名为JXA1株,将该病命名为高致病性猪繁殖与呼吸综合征(HP-PRRS),由于病毒株的高度变异、原有疫苗保护性差等原因,HP-PRRSV暴发后,造成我国南方数省猪场的大面积感染,给我国养猪业造成了不可挽回的严重损失。
2 PRRSV病原学特点
2.1 PRRSV理化及结构特点
PRRSV属于动脉炎病毒科、动脉炎病毒属,直径为:50~70 nm,衣壳蛋白外包有囊膜,呈现正二十面体结构;由于囊膜的存在,故对氯仿等有机溶剂敏感,因此应选择适当的消毒剂。此外,PRRSV对高温和pH敏感,37°C 48 h和 56°C 45 min可完全灭活,在过酸过碱环境时,其半衰期均呈现显著下降。
PSSRV在结构上主要由核衣壳蛋白(N)、病毒基因组、膜基质蛋白(M)、囊膜蛋白(E、GP2-5)等结构蛋白组成;此外还含有Nsp1-12等非结构蛋白。GP5、M、N为主要的结构蛋白,分别由病毒基 因 序 列 ORF5、ORF6、ORF7,在PRRSV增殖、感染、免疫抑制等过程中发挥重要的作用(见表1)。其中GP5蛋白是诱导产生中和抗体的主要结构蛋白,其糖基化与体内病毒的增殖相关。此外,GP5蛋白在体内外均能诱导细胞产生凋亡,且GP5蛋白与M蛋白形成异源二聚体并参与PRRSV对靶细胞的感染过程;在病毒分子流行学调查时,由于GP5的高度变异性,因此根据编码GP5蛋白的ORF5的序列特点,对PRRSV进行谱系划分[6]。在非结构蛋白中,Nsp2具有最大的基因序列,并且呈现高度可变性,目前国内呈现广泛流行趋势的NADC30-like毒株的Nsp2基因编码区就存在131氨基酸缺失,与美国分离毒株NADC30和MN184氨基酸缺失一致。Nsp2的高度变异性,使得其成为PRRSV变异、复杂化的主要原因,也成为分子流行学研究的热点[7]。
2.2 PRRSV生物学特性
2.2.1 高度变异、易重组
PRRSV是单股正链RNA病毒,具有RNA病毒复制时缺乏校对机制的特点,在病毒复制时容易发生碱基缺失、插入、替换等突变现象,而且PRRSV具有多个高变区,使得病毒的突变率大大增加,从而使得PRRSV呈现多样性、高变异的特点。此外,由于疫苗的不合理使用、滥用以及野毒感染等因素的作用下,PRRSV毒株间重组现象越来越严重。袁世山[8]等通过在MA-104细胞上共感染两种PRRSV毒株,分离纯化子代病毒并作基因组测序,发现ORF3和ORF4发生嵌合的毒株,首次证实了PRRSV毒株重组现象的存在。PRRSV毒株间重组产生使PRRS的防控变得更加严峻,且目前在我国呈现广泛流行趋势的NADC30-like毒株虽然自身致病性弱,但其具有与多种毒株发生重组的特点,杨汉春等[9]通过流行病学调查发现一种新型PRRSV毒株TJnh1501,就是由NADC30-like和HP-PRRSV重组产生,并且TJnh1501的致病性相比NADC30-like显著增强。PRRSV具备的高度变异、易重组的特点使得PRRS防控难度不断加大,给养猪业带来了持续的、严重的经济损失。
2.2.2 免疫抑制
临床上,PRRS常伴随II型圆环病毒(PCV2)和传染性胸膜肺炎等混合感染,这是因为PRRSV具有导致机体免疫抑制的特点。PRRSV在体内主要感染巨噬细胞,且随巨噬细胞的分化发育的不同,易感性也不相同;其中,猪肺泡巨噬细胞(PAMs)是PRRSV主要的靶细胞;此外,PRRSV还可感染胸腺、扁桃体、淋巴结等部位中的巨噬细胞。PRRSV感染PAMs后,可引起PAMs的凋亡、吞噬活性下降等,从而使机体天然免疫功能降低。此外,研究表明[10],PRRSV还可通过抑制IFN-1水平、调节TNF-a活性、降低IL水平从而抑制机体的免疫机能,造成免疫抑制,使得多种病原菌的继发感染,严重损害动物机体健康。
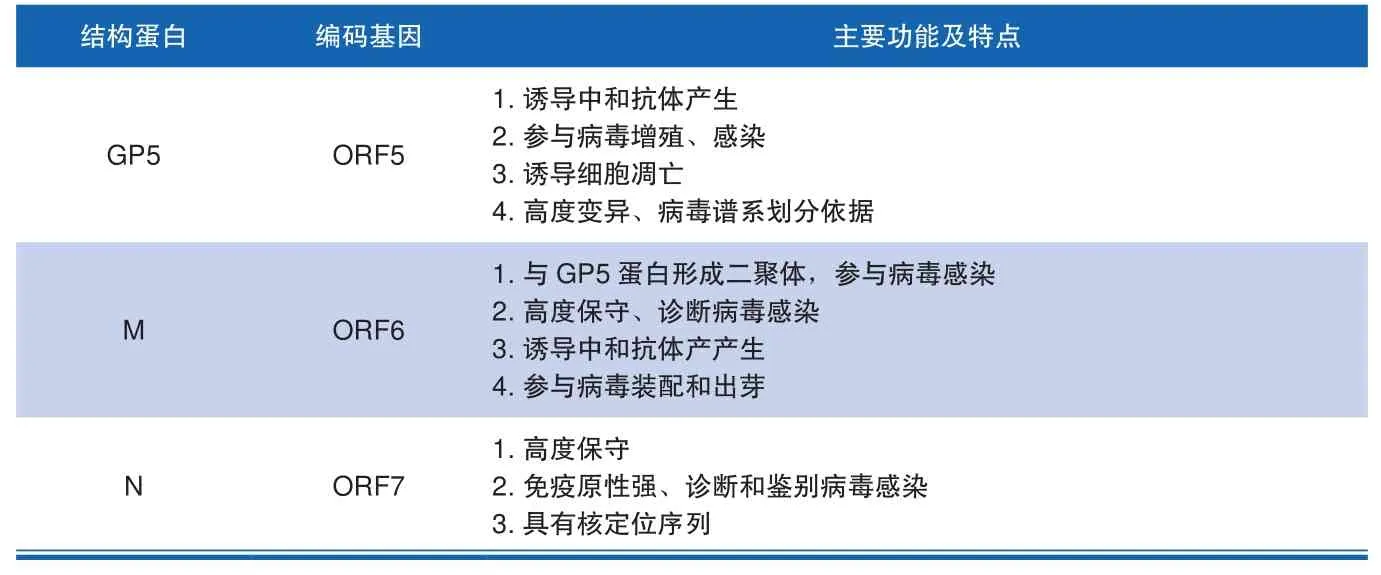
表1 PRRSV主要结构蛋白功能特点
2.2.3 抗体依赖性增强作用
抗体依赖的增强作用(Antibody dependent enhancement,ADE)指的是:某些病毒特异性抗体(一般多为非中和抗体)与病毒结合后,结合了病毒的抗体可通过其Fc段与某些表面表达FcR的细胞结合从而介导病毒进入这些细胞,从而增强了病毒的感染性的过程。PRRSV结构蛋白GP5具有丰富的抗原表位,可以诱导亚中和抗体的产生,这些亚中和抗体和一些非中和抗体通过借助其Fc片段与PAMs上的Fc受体结合,从而使得ADE现象的产生,增强PRRSV的感染。
2.2.4 持续性感染
PRRSV属于动脉炎病毒,具有持续性感染的特点,可以在猪体内存在相当长的时间,同时可引起病毒在猪群中的广泛传播和感染。研究表明,感染后9周的猪PAMs中仍然存在PRRSV;4周龄免疫接种的猪,在接种157 d后,仍然能从其唾液分泌物中分离到PRRSV[11]。虽然PRRSV持续性感染的具体机制尚不明确,但大量研究表明[12],其持续性感染性与PRRSV感染导致的免疫抑制及ADE等均相关。此外,有的研究表明[13],PRRSV感染可引起细胞免疫抑制,通过抑制细胞毒性T细胞的产生,从而抑制机体免疫力,逃避机体的清除作用,形成持续性感染状态。
3 PRRSV分子流行病学
3.1 国外PRRSV毒株流行情况
PRRS最早于1987年在美国暴发流行,随后席卷整个北美地区;1990年开始,德国暴发PRRSV感染,随后整个欧洲暴发大规模流行;但是,研究人员通过分离不同地区PRRSV毒株,经全基因组测序发现,不同地区的PRRSV在基因序列上存在不同程度的差异。其中,北美地区之间PRRSV序列差异较小,但相较欧洲地区流行的PRRSV则呈现较大的序列差异,二者核苷酸序列同源性仅为50%~80%,因此研究人员根据毒株间序列差异将PRRSV分为欧洲毒株为代表的基因I型和以北美分离毒株为代表的基因Ⅱ型。虽然将PRRSV分为2个基因型,但是由于PRRSV的高变异性、易重组的特性,因此根据编码GP5蛋白的ORF5基因序列的差异又可将基因I型PRRSV分为3个亚型,其中荷兰分离毒株Lelystad virus(LV)作为第一株基因I型分离株被广为研究,并制备成疫苗用于控制欧洲PRRS疫情[14]。与之相似,根据ORF5基因序列的差异,基因Ⅱ型PRRSV可以划分成9个谱系,经典北美毒株VR-2332属于第5谱系。同时,由于VR-2332相关疫苗的使用,北美地区分离到了许多同属第五谱系的VR-2332近源毒株;此外,与我国逐渐流行的毒株NADC30-like高度同源的NADC30和MN184毒株则属于第1谱系。近年来,由于疫苗使用不合理、PRRSV重组加剧等原因,出现了越来越多的毒株,形成了更多的谱系,并呈现不同程度的暴发流行。
3.2 国内PRRSV毒株流行情况
1995年,PRRSV在我国暴发流行,1996年郭宝清等人首次分离到我国流行的PRRSV毒株,并命名为CH-1a,经基因组测序发现,CH-1a与经典LV毒株和VR-2332均存在较大的序列差异,后来经毒株谱系分析发现,CH-1a属于基因II型PRRSV,并在我国流行数年,对我国养猪业造成了巨大损失。1997年,杨汉春等人分离得到一株PRRSV毒株,命名为BJ-4,经基因序列测定比对发现,BJ-4与VR-2332存在较高的同源性,同属基因Ⅱ型第5谱系。2006年,我国暴发严重的PRRS流行,而且之前的疫苗接种控制效果差,田克恭等人在江西省通过毒株分离、全基因组测序,在我国首次发现了高度变异导致高致病性的PRRSV,并命名为JXA1。此外,通过序列比对,研究人员发现JXA1与CH-1a存在较高的同源性,因此我国HP-PRRSV的产生可能是由于较原始的CH-1a毒株变异、重组得来。2014年,杨汉春[15]等人通过流行病学调查获得1株PRRSV,通过基因组测序发现其Nsp2区域存在133个氨基酸缺失,这一结构与基因Ⅱ型第5谱系NADC30及MN184相似,并命名为NADC30-like;而进一步的在体攻毒实验结果表明,NADC30-like致病性较强,并且当前的经典疫苗不能对其产生有效的免疫保护作用。此外,NADC30-like具备易与其他毒株重组的特点,从而增强毒株的复杂性,为PRRS防控带来了更大的挑战,有研究表明NADC30-like与其他PRRSV毒株的重组,还可使毒株致病性呈现不同程度的增强。
4 PRRS疫苗研究现状及应用
4.1 灭活苗
自PRRS在北美暴发后,科研人员便投入到PRRS疫苗的制备生产中,并实现了商品化,通过合理利用疫苗有效控制了PRRS疫情。灭活苗具有制备简单、安全性高等特点,因此最初的PRRS疫苗主要是灭活苗,其中西班牙学者研制的油佐剂灭活苗具有良好的免疫效果,对仔猪同源病毒的免疫保护率能达到70%以上[16]。虽然灭活疫苗具有制备工艺简单、安全性高的优点,但是在实际应用中其免疫保护作用仍然不够理想,而且免疫接种量大、次数多又会进一步引起动物应激从而加剧疫情,因此在实际畜牧生产中灭活苗的使用并不广泛。
4.2 弱毒苗
由于PRRS灭活苗免疫保护作用差的特点,研究人员开始转向弱毒苗的研究,大量研究表明PRRS弱毒苗能够快速诱导机体产生免疫保护作用[17]。此外,弱毒苗不但能诱导机体产生持续高水平的抗同源毒株免疫作用外,还具备较好的异源免疫保护作用,而且免疫注射剂量小、成本低等优点使得PRRS弱毒苗在养猪生产中广泛应用,有效控制了PRRS的暴发和流行。但是,PRRS弱毒苗的使用也存在着一定的风险,尤其是PRRSV毒力返强和毒株间重组现象,此外,弱毒苗在使用时也要根据群体种类和健康状况的不同而进行选择;例如,种猪要严格禁止PRRS弱毒苗的使用,因为PRRSV可经精液传播;而健康状况差的和阴性妊娠母猪也要禁止PRRSV弱毒苗的使用,从而避免PRRSV对机体的伤害。
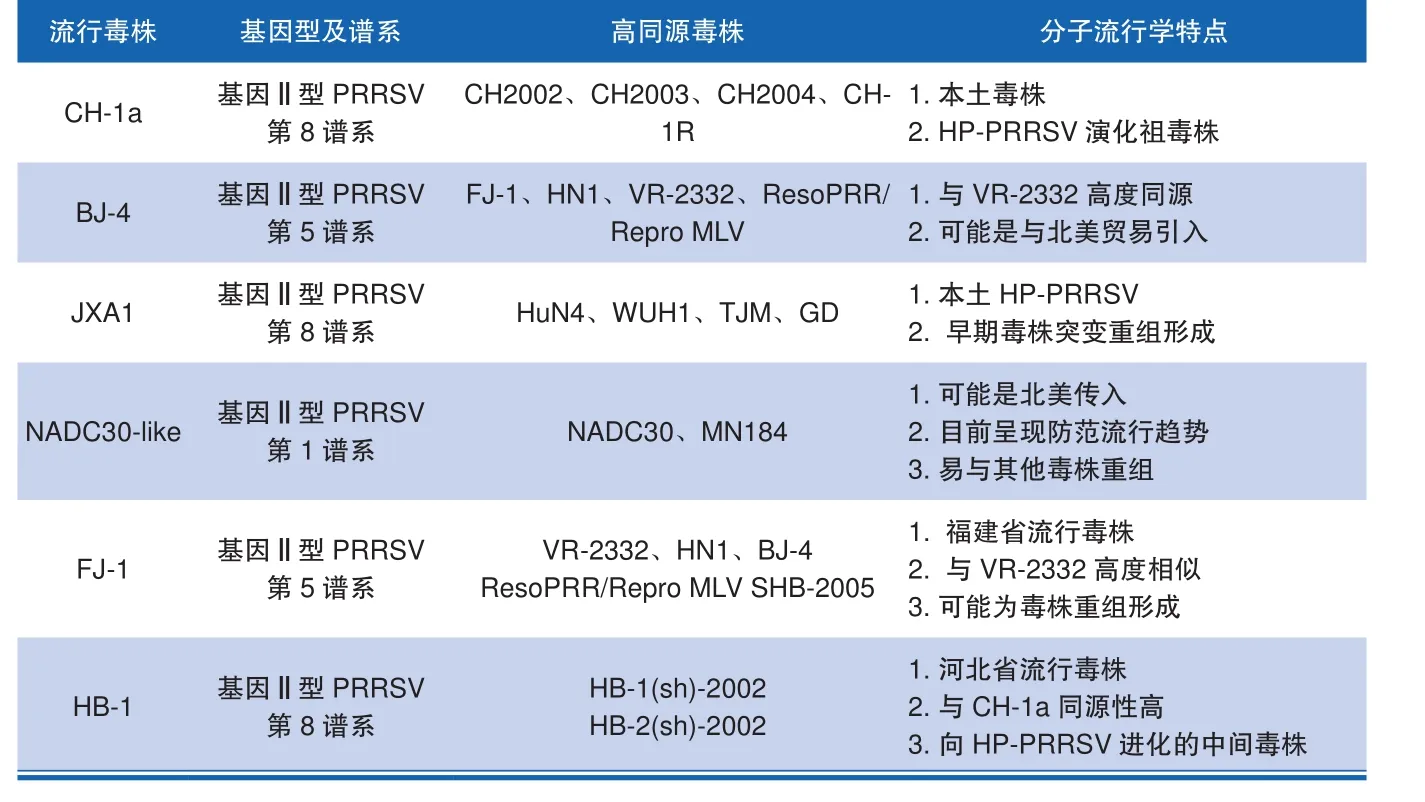
表2 国内主要流行的PRRSV毒株及其特点
4.3 基因工程苗
PRRS灭活苗和弱毒苗都各有优缺点,保证疫苗良好的免疫保护作用和安全性是疫苗研制的两大核心原则。随着分子生物学研究技术和手段的不断进步,基因工程苗因其具备可控性,已经成为研究人员的靶标。通过对基因水平改造,不但能保证其免疫原性又能提高其安全性,实现真正的安全高效。研究人员通过利用真核表达系统,表达PRRSV主要的结构蛋白GP5、M、N,通过纯化后免疫动物,对抗体滴度以及免疫效果进行测定和评估,结果表明GP5蛋白疫苗可使机体产生50%的免疫保护率,而其抗体水平及出现时间均与弱毒苗存在显著差异。因此,虽然基因工程疫苗具备良好的应用前景,但目前阶段,其科学研究仍然存在较大的技术短板,仍需科研工作者做进一步的研究和推动。
5 PRRS防控措施
5.1 提高生物安全防控
多年来,PRRS防控的失败经验让人们逐渐认识到提高生物安全的重要性。由于感染PRRSV猪可经多种途径排毒,包括:粪便、尿液、唾液、鼻腔分泌物、血液、乳汁等,此外还可通过污染器械、饲料、饮水等使得PRRSV的进一步扩散。因此,养殖场内日常消毒环节必不可少,而消毒剂也要合理选择脂溶性的;尤其是PRRSV阳性猪场,更要注意阳性群体与阴性群体间的有效隔离和场区内消毒,研究表明PRRSV可通过气溶胶的方式扩散,扩散距离可达3 km以上,因此与PRRSV阳性猪场距离近的猪场也要注意消毒和预防[18]。此外,猪只的引入、运输、流出要严格做好检测流程,避免PRRSV的引入和扩散。除此之外,人员、车辆等流动性因素也是影响PRRSV防控的重要因素,尤其是人员操作、流动对PRRS防控影响最为重要,人员进出场区要严格遵守消毒原则,在不同生产区流动时也要根据不同群体的感染情况执行不同的消毒程序,工作服、手套等工作用具也要经常进行消毒处理,坚持更换注射针头的原则,对猪只运输用具要执行严格的消毒标准。此外,保证猪只的健康状况对于PRRS防控也具有重要意义。因此,做好猪只的保健,保证猪舍通风、干燥、适宜的温度和湿度、经常消毒是预防PRRS的重要措施。此外,有条件的猪场还可安装正压空气过滤系统,不但能够保证猪舍通风,还能够有效过滤掉PRRSV、PCV、SIV(猪流感病毒)等病原菌,实现可控、安全、、高效的养殖模式。

表3 国内常见的PRRS疫苗及其特性
5.2 合理使用疫苗
疫苗免疫经历史验证是有效防控传染性疾病的重要手段,但PRRSV防控中常用的弱毒疫苗种类较多,加之商品化PRRS疫苗夸大宣传等因素,因此合理、规范使用PRRS疫苗使其发挥最大的免疫保护作用显得尤为重。要根据全体感染状态和健康状况,进行选择性免疫(见表4);其中,阴性猪场以及种猪要坚决禁止PRRS免疫,对于处于稳定感染状态的猪场,也不建议进行PRRS疫苗免疫,以免PRRS弱毒苗注射后引起毒株的返强、重组等导致PRRS的暴发和致病性增强。对于处于不稳定感染状态的猪场,可以使用PRRS弱毒苗,但是要根据猪群的实际感染情况的健康状况制定合理的免疫程序。对于妊娠母猪,可在产前1~3个月进行PRRS弱毒苗免疫,研究表明母猪产前免疫PRRS弱毒苗相比仔猪超免具有更好的免疫保护作用[19]。但是,要特别注意疫苗免疫需考虑猪只的个体健康状况,以免因免疫力低下导致严重的不良后果。
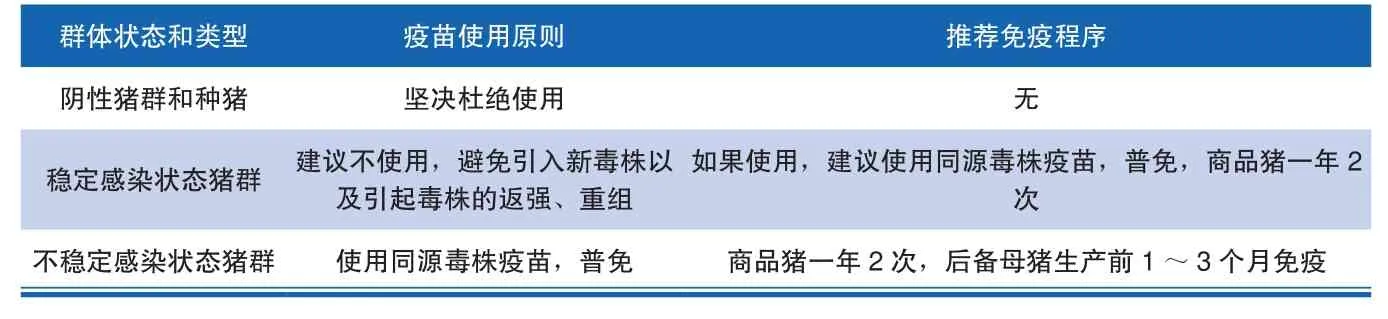
表 4 不同环境条件下的 PRRS的防治措施及免疫程序
5.3 闭群及净化
由于PRRSV具有高变异、易重组等特点,因此目前PRRS防控的主要措施即疫苗免疫并非解决问题的根本之道,根据美国在PRRS防控方面的多年探索和经验表明,闭群和PRRS净化是从根本解决PRRS问题的唯一途径。闭群即PRRSV阳性猪场停止引入外来种猪,同时淘汰PRRSV血清阳性的种猪,此外闭群期间对于阴性种猪要免疫同源毒株的PRRS疫苗,从而杜绝外来毒株以及不同毒株间的重组等,闭群措施不但可以提高猪群的生产性能,还可以避免猪群内PRRSV毒株的变异、重组等,从而稳定猪群,进行正常的生产。猪群净化相比闭群在PRRS防控上则显得更为彻底,主要措施为:首先进行群体封闭,然后通过血清学检测对于PRRSV阳性的猪只进行扑杀,此外,对于疫苗则禁止使用,有的国家则允许灭活苗的使用,但是PRRS弱毒活疫苗坚决杜绝使用。同时,对于阳性猪场的猪舍和周边区域以及各种生产用具、器械要严格执行消毒程序以及空栏期,保证PRRSV的彻底灭活和清除。目前,以美国为代表的PRRS重灾国家已经通过群体净化的措施,在国内实现了部分地区净化,并且通过成功的经验正在为其全国范围内的PRRS净化做进一步努力。
