联合应用对比脉冲序列成像和对比高分辨率成像技术诊断转移性肝癌的价值
2019-07-22杨道辉于凌云邱艺杰曹佳颖王文平
张 琪,董 怡,杨道辉,于凌云,邱艺杰,曹佳颖,2,王文平,2
1. 复旦大学附属中山医院超声科,上海 200032;2. 上海市影像医学研究所,上海 200032
肝脏是恶性肿瘤常见的转移部位之一,其中结直肠癌最常转移至肝脏,这也是结直肠癌患者死亡的主要原因[1]。因此,早期检出肝脏转移肿瘤并明确病灶数目,有助于临床规划合理有效的后续诊疗策略。转移性肝癌通常为多发,大小不等,但目前常用的低机械指数(mechanical index,MI)下实时超声造影(contrast-enhanced ultrasound,CEUS)在延迟期微泡消退较快,6~10 min内消退完全[2],不足以扫查全肝以检出全部病灶,容易漏诊。对比脉冲序列成像(contrast pulse sequencing,CPS)具有较高的对比度及分辨率,对比高分辨率成像(contrast high resolution imaging,CHI)具有超长延迟期且能显示病灶更多细节,本研究主要探讨联合应用CPS和CHI在诊断和检出转移性肝癌中的临床价值。
1 资料和方法
1.1 研究对象
对2017年7月—2018年10月于复旦大学附属中山医院拟诊为转移性肝癌的患者行术前CEUS检查。纳入标准:① 既往有结直肠癌或其他恶性肿瘤病史;② 拟行手术、穿刺或介入治疗;③同时具备CT/MRI检查图像及结果。排除标准:CEUS检查禁忌证,包括对造影剂严重过敏,严重心力衰竭、肾衰竭和肝衰竭者。
最终纳入45例患者,其中男性26例,女性19例,年龄33~78岁,平均年龄(55.4±10.8)岁。其中单发病灶12例,2个病灶14例,多发病灶(≥3个)19例。多发病灶者选择超声图像较清晰的病灶作为观察对象。所有患者均经病理学或其他影像学检查证实。
1.2 仪器与方法
使用SIEMENS Acuson Oxana 2超声仪,6C1-HD凸阵探头(1~6 MHz),配有CPS和CHI两种造影技术。造影剂使用意大利Bracco公司生产的声诺维(SonoVue),经肘静脉团注2.4 mL,然后以5 mL的0.9% NaCl溶液冲管。采用常规超声扫查全肝,记录肿瘤回声、数目、大小及位置等信息。定位至其中最大的病灶,切换至造影模式。首先采用CPS造影条件,参数设置如下:MI=0.05,帧频10帧/秒,频率1.5 MHz,动态范围80 dB。根据欧洲生物医学超声学会联盟(European Federation of Societies for Ultrasound in Medicine and Biology,EFSUMB)肝脏CEUS指南判断标准[3],观察造影剂增强-消退方式、快慢及程度。在延迟期后期切换至CHI造影条件,扫查全肝,寻找其他低回声病灶,参数设置如下:MI=0.10,帧频为14帧/秒,频率3.0 MHz,动态范围45 dB。对于可疑病灶无法明确诊断时,再次注射造影剂1.0~2.4 mL重新观察。两次造影间隔至少15 min,所有图像均以JPEG和AVI格式存储并回放分析。
1.3 统计学处理
所有数据采用SPSS 23.0软件进行统计学分析,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 原发病灶及肝转移病灶的病理学检查结果
45例患者中,20例经病理学检查证实,25例以磁共振成像(magnetic resonance imaging,MRI)/CT检查结果作为对照。原发肿瘤来源于结直肠癌24例,胰腺导管腺癌6例,胰腺神经内分泌肿瘤5例,乳腺癌1例,胃肠道间质瘤2例,肺癌2例,卵巢癌1例,胆囊癌2例,胃贲门癌1例,食管癌1例。
1.2 常规超声表现
45例患者中,12例为单发病灶,14例为2个病灶,19例为多发病灶(≥3个)。常规超声共检出94个病灶,大小为11~84 mm,平均(32.3±7.8)mm(表1)。
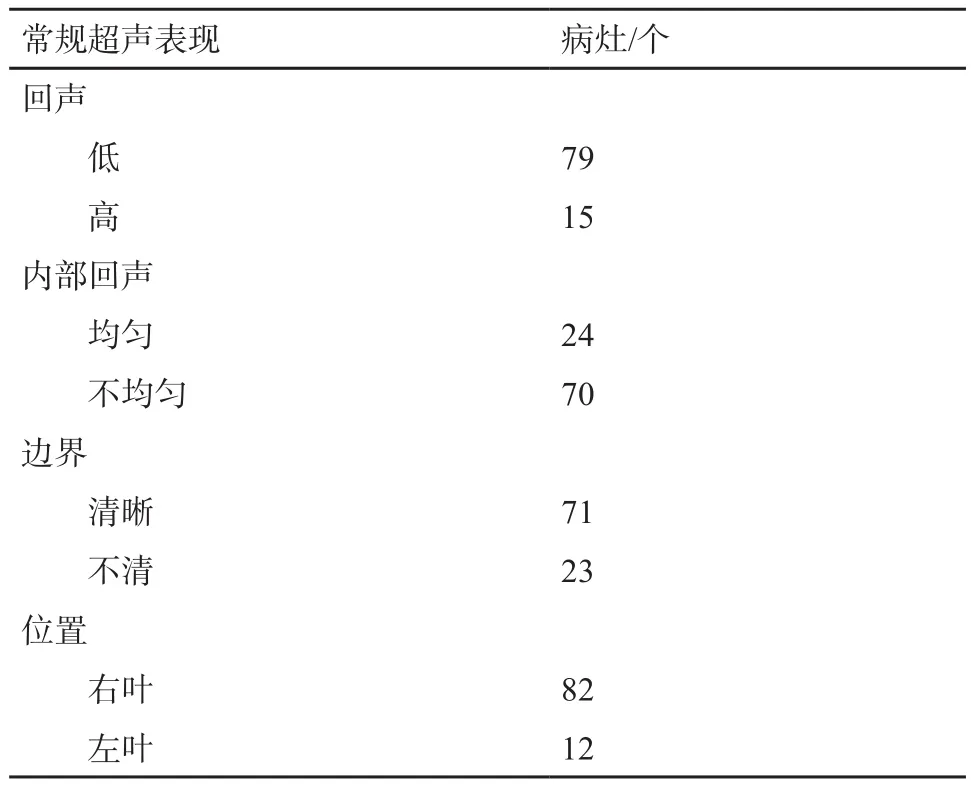
表1 常规超声表现
2.3 CEUS及增强CT/MRI表现
动脉期CPS造影模式检出病灶109个,82个呈环状高增强,27个呈整体高增强。门静脉期11个病灶呈环状稍高增强,13个呈整体均匀稍高增强,85个快速消退呈低回声改变。延迟期切换至CHI模式后检出病灶161个,均呈低回声改变(表2)。病灶最长径8~87 mm,平均为(31.5±11.2)mm。所有病灶中,144个位于肝右叶,17个位于肝左叶(P<0.05)。
45例患者均经增强CT或增强MRI检查,共检出112个病灶,动脉期97个病灶(86.6%)呈环状高增强,15个病灶(13.4%)呈整体均匀高增强,门静脉期及延迟期均呈整体低增强(表2)。 CPS和CHI造影图像见图1。

表2 超声造影及增强CT/MRI表现

图1 患者CPS和CHI造影图像患者,男性,63岁,小肠间质瘤术后1年,发现肝脏多发占位。A:CPS造影条件下55 s时,肝右叶低回声团块,边界尚清,内部回声尚均匀;B:CHI造影条件下3 min 46 s时,肝右叶较大病灶旁出现数枚类似低回声团块
3 讨 论
肝脏是常见的恶性肿瘤转移部位之一,20%~50%的原发肿瘤可转移至肝,消化系统高达60%~80%的恶性肿瘤可发生肝转移[4-5]。随着化疗药物、靶向药物及介入治疗的使用,转移性肝癌的临床诊疗决策有了新的治疗方案,包括经肝动脉化疗栓塞、射频消融及微波消融等[6-7]。有研究表明,肝转移病灶的数目、大小及位置是影响肝段切除的重要因素[8],因此术前正确诊断转移性肝癌且明确转移灶数目十分重要[9]。
目前,CT、MRI及超声等影像学方法是诊断转移性肝癌的常用手段[10-12]。由于CT具有放射性,MRI操作复杂,临床应用受到一定的限制,不适合多个病灶化疗及微创治疗的疗效随访。CEUS可实时动态观察肝脏内血流灌注的异常增强及减退区,获得肝内病灶不同时相的造影表现,从而为转移性肝癌的诊断及疗效评估提供有效的临床信息[13],且有研究表明CEUS对微小转移灶的灵敏度及检出率优于增强CT[14-16]。但目前常用的CEUS造影剂消退较快,一般观察至6 min时肝实质已明显消退[2],不利于多发转移性肝癌的检出,容易漏诊。
本研究使用的SIEMENS超声仪同时具有两种造影模式,即CPS和CHI。CPS采用连续发射一系列相位和振幅均不同的脉冲波,提取来自微泡的非线性二次谐波用于成像,是目前唯一可利用造影剂产生的非线性基波和谐波信号的技术。其穿透力较强,提高了信噪比及对比分辨率,尤其是在动脉相造影成像,对比度强,能在正常肝实质背景下识别出高增强的转移灶。本研究45例患者中,常规超声检出病灶94个,CPS检出病灶109个(P<0.05),但与增强CT/MRI检出的病灶数目差异无统计学意义(P<0.05)。CPS能灵敏地发现病灶血流灌注情况并分辨病灶增强方式,大多数转移性肝癌由肝动脉供血,为乏血供肿瘤,易发生坏死,因而在动脉期呈环状高增强,内部缺血坏死始终不增强[3]。
CHI模式中,较低的声压下微泡存在时间长,能显示10 min以上的超长延迟相造影图像,且具有较好的细节分辨力。在延迟期扫查肝内病灶,尤其是肝脏多发性转移癌,其在门静脉期快速消退,在延迟期呈低回声改变,CHI能灵敏地发现。肝内转移灶数目过多时,动脉期无法检出并观察全部病灶,但CHI的超长延迟期及其高分辨率允许医师在延迟期缓慢仔细扫查全肝,从而发现更多的病灶,避免漏诊。本研究中,CPS检出109个病灶,而CHI检出161个病灶(P<0.05)。CHI检出而CPS未检出的病灶均呈整体不均匀低增强。这些病灶一部分是由于消退缓慢,至延迟期缓慢消退呈低回声,动脉期及门静脉期不易发现;一部分是由于较小, CHI能显示更多的细节而发现微小病灶。因此,CHI能在CPS基础上发现更多病灶,为临床选取合适治疗方式提供了更多有效信息。
总之,CPS造影模式的信噪比和对比分辨率较高,有助于在动脉期发现快速增强的转移性肝癌;CHI造影模式拥有超长延迟期,且有较好的细节分辨力,有足够的时间发现更多的转移病灶。CPS和CHI两种造影模式的联合应用有助于肝内转移癌的检出和诊断,在病灶的诊断、治疗和疗效评估方面有重要临床价值。
