乳腺单纯型浸润性微乳头状癌的超声与病理学特征的相关性研究
2019-07-22古作娴翁贞华
古作娴,翁贞华
深圳市龙华区人民医院超声科,广东 深圳518109
乳腺单纯型浸润性微乳头状癌(pure invasive micropapillary carcinoma,PIMPC)首先被Siriaunkgul和Tavassoli发现并定义,是浸润性乳腺癌的一种罕见特殊类型,占所有乳腺癌的2%~8%[1-2]。PIMPC在生物学行为上具有侵袭性高、预后差等特点[3]。既往有研究指出PIMPC是乳腺单纯型浸润性导管癌(invasive ductal carcinoma,IDC)的一种特殊亚型,但由于PIMPC具有特殊的病理学特征,且腋窝淋巴结转移率和侵袭性高于IDC,2003年世界卫生组织(World Health Organization,WHO)乳腺肿瘤组织学分类指南中将PIMPC单独定义为少见的浸润性乳腺癌的一种类型[4-5]。早期发现及诊断PIMPC对患者的治疗和预后有重要意义,因此本研究分析了PIMPC的超声及病理学特征,并探讨了两者之间的相关性。
1 资料和方法
1.1 一般资料
选取2010年1月—2016年5月于深圳市龙华区人民医院行手术治疗且术后病理学检查证实为PIMPC的乳腺癌患者为研究对象,共计纳入47例,均为女性,年龄38~75岁,平均年龄(60.94±10.93)岁。同期选取IDC患者40例为对照组,年龄34~69岁,平均年龄(58.46±9.76)岁。
1.2 病理学诊断标准
PIMPC诊断标准:① 瘤细胞排列呈微乳头状或桑葚状,弥漫或结节状浸润性生长,细胞簇呈实性或管状结构漂浮于海绵状腔隙内;② 细胞簇缺乏纤维血管轴心,簇周有透明带包绕,并由纤细的纤维组织分隔而缺乏促纤维增生现象;③ 瘤细胞呈柱状或立方形,胞质多少不等,淡染至强嗜伊红,染色较深,细胞核有不同程度的异型性;④高度的淋巴侵袭性表现为淋巴管和区域淋巴结转移。IDC诊断标准:① 细胞异型,细胞核增大,浓染,染色质分布不均,核浆比增大;② 细胞排列极象紊乱,瘤细胞在导管内形成多种排列方式;③癌细胞浸润周围间质,癌细胞周围纤维间质增生,癌细胞接触处出现增生的纤维间质断裂。
1.3 超声检查
使用ALOKA α10型、GE Logiq E9型彩色超声诊断仪,探头频率分别为1~15 MHz和6~15 MHz。患者取平卧位,上臂外展,按常规检查方法对患者双侧乳腺和腋窝进行横切、纵切和旋切全面检查,观察乳腺病灶直径、形态、边界、边缘形状、内部回声、周围回声及Adler血流分级;切换至超声弹性成像模式,嘱患者保持呼吸平稳,调整取样框大于病灶范围,显示病灶最大切面,实时观察二维超声图及弹性成像图;观察双侧腋窝淋巴结大小、数目、形态结构及血流情况等。
1.4 评价指标
Adler血流分级:0级,肿块内未发现血流信号;Ⅰ级,少量血流,可见1~2个点状或细棒状肿瘤血管;Ⅱ级,较丰富血流,可见3~4个点状血管或1个较长的血管穿入病灶,其长度可接近或超过肿块半径;Ⅲ级,丰富血流,可见≥5个点状血管或2个较长血管[6]。
Itoh评分:弹性图以彩色编码不同组织的硬度。其中,绿色为取样框内组织平均硬度,红色为更软,蓝色为更硬。采用5级评分,病灶区呈粉色为1分,呈紫色或混杂少量绿色为2分,呈绿色或混杂少量黄色为3分,呈黄色或混杂少量红色为4分,呈红色或混杂少量黄色为5分。3分以下判定为良性病变,4~5分为恶性病变[7]。
腋窝淋巴结转移:正常腋窝淋巴结在超声图像上定义为椭圆形,内部可见高回声淋巴结构。利用超声观察双侧腋窝淋巴结大小、数目、形态结构及血流情况等,发现淋巴结结构异常、形态异常及血流信号改变等提示肿瘤淋巴结转移可能。
1.5 统计学处理
采用SPSS 20.0软件对数据进行统计学分析。计量数据资料以x±s表示,组间比较采用独立样本t检验,组内比较采用配对样本t检验,计数资料采用χ2检验,P<0.05为差异有统计学意义。以术后病理学检查结果为金标准,统计超声诊断PIMPC淋巴结转移的真阳性、假阳性、真阴性及假阴性例数,计算超声诊断PIMPC淋巴结转移的灵敏度、特异度、阳性预测值及阴性预测值。
2 结 果
2.1 患者一般资料及病灶分布特征
患者一般资料及病灶分布特征具体见表1,两组之间患者年龄、病灶大小、病灶位置及病灶分布等差异无统计学意义(P>0.05)。
2.2 病灶超声特征
两组患者一般资料及病灶超声特征比较,差异有统计学意义(P<0.05,表2)

表1 两组一般资料和病灶分布特征比较

表2 两组病灶超声特征比较
2.3 PIMPC病理学检查结果
术后肿瘤组织病理学检查结果显示,PIMPC肿瘤细胞呈微乳头状排列,集块型分布。超声提示PIMPC血流信号以0~Ⅰ级为主,病理学检查结果提示肿瘤组织中存在少量新生血管(图1)。

图1 PIMPC组织病理学特征A:病理学检查显示PIMPC肿瘤组织呈乳头状排列,集块型分布;B:癌组织边缘无纤维组织簇包绕
2.4 超声诊断腋窝淋巴结转移的准确性
超声诊断结果提示47例PIMPC中有21例存在腋下淋巴结转移,腋下淋巴结转移发生率为44.68%;术后病理学检查结果证实47例PIMPC中有34例存在腋下淋巴结转移,腋下淋巴结转移发生率为72.34%。超声诊断腋下淋巴结转移的灵敏度、特异度、阳性预测值和阴性预测值分别为52.94%、76.92%、85.71%和38.46%(表3)。
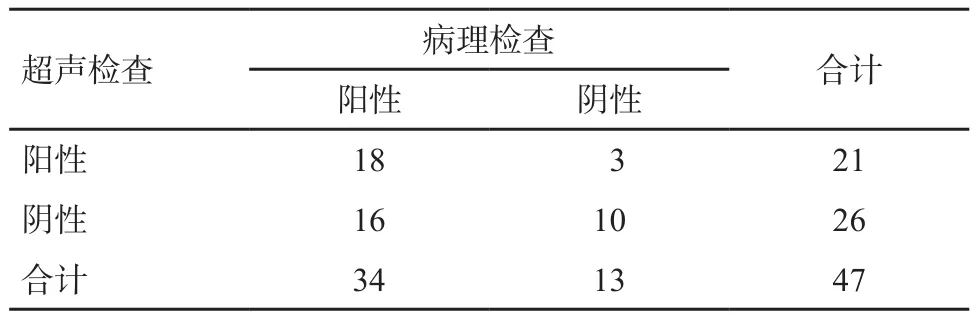
表3 PIMPC腋窝淋巴结转移超声与病理检查结果比较(n)
3 讨 论
目前,乳腺癌是中国女性癌症死亡的主要原因之一[8]。乳腺浸润性微乳头状癌(invasive micropapillary carcinoma,IMPC)是乳腺癌的一种罕见的独特病理学亚型,癌细胞多表现为中低度分化,肿瘤细胞呈乳头状生长,缺乏纤维血管轴心,且癌细胞极性颠倒,细胞排列方式呈顶端向外。IMPC可能是单独发生的,也可能与其他组织学类型的乳腺癌合并发生。任一组织学类型的乳腺癌只要病灶中含有微乳头状结构即诊断为IMPC,IMPC中仅含有乳头状结构者即为PIMPC。
研究表明,在诊断为PIMPC的乳腺癌患者中,10%~90%除微乳头成分外合并其他组织类型成分[9]。与IDC相比,PIMPC具有明显的组织学特征和分子遗传学特征,且具有淋巴侵袭率高、淋巴结转移率高的特点,是一种预后较差的乳腺癌病理学类型,其恶性程度显著高于不伴有微乳头成分的乳腺癌患者[10]。此外,PIMPC复发率高,5年复发率高达62.6%,显著高于其他类型乳腺癌[11]。鉴于PIMPC特殊的临床病理学意义,其影像学特征受到越来越多的关注。超声检查由于安全、无创、可重复及操作简便等优势,成为目前诊断肿瘤的重要检查手段,在PIMPC临床诊断中发挥了重要作用[12]。
本研究表明,PIMPC在超声图像上大多表现为形态不规则、病灶边缘不清及边缘毛刺征等恶性征象,与张美恋等[13]的研究结果相近。与IDC比较,PIMPC病灶直径多在2 cm以上,病灶边缘较少出现蟹足状改变,这主要与PIMPC 病灶以集块型细胞簇为主和向病灶周围浸润速度相对匀速有关,而IDC中由于癌细胞向周围组织扩散,易形成炎性反应细胞浸润带和结缔组织增生带,常见蟹足状改变。本研究中,37个PIMPC病灶表现为混杂回声,仅12个(25.53%)病灶出现回声衰减,与苏晓慧等[14]的研究结果一致。PIMPC病灶内多缺乏胶原纤维组织,且细胞以集块型为主,而IDC病理学检查时可见大量胶原纤维组织,因此IDC后方衰减比例较高。但Günhan-Bilgen等[15]研究16例乳腺IMPC,发现60%的病灶后方回声存在衰减,40%后方回声正常,与本研究存在差异,可能与样本量不同有关。PIMPC病灶纵横比≥0.7的比例显著降低,其主要通过脉管浸润、转移,侵袭方向沿着脉管走行,多呈横向生长。PIMPC血流信号以0~Ⅰ级为主,而IDC以Ⅱ~Ⅲ为主,与IDC病灶可分泌肿瘤血管生成因子及PIMPC病灶缺乏纤维血管轴心相关。尽管大部分PIMPC和IDC病灶的超声弹性成像评分≥4分,但两者间存在差异,因此临床上二维超声特征相似、弹性成像评分≤3分时,可考虑为PIMPC。
PIMPC中,即使肿瘤体积较小或肿瘤中微乳头状癌成分很少,相比其他乳腺癌类型仍具有较高的淋巴结转移概率,这与其病理学特征密切相关,且淋巴结转移率是判断其预后的主要指标[16]。PIMPC在光镜下表现为肿瘤细胞呈微乳头状排列,弥漫浸润性生长,肿瘤组织与周围间质之间有明显的空隙,且缺乏纤维血管轴心。PIMPC的病理学特征导致其有较高的淋巴结转移率和较差的临床预后[2]。本研究中,超声结果提示PIMPC腋窝淋巴结转移的发生率为44.68%,术后病理学检查结果提示腋窝淋巴结转移发生率为72.34%,与Walsh等[17]报道的72.30%接近。PIMPC易出现淋巴结转移与以下因素有关:①PIMPC癌细胞表面存在微绒毛结构,微绒毛朝向病灶间质侧,且癌细胞内部存在丰富的细丝结构,提示PIMPC癌细胞具有较强的浸润能力;② PIMPC癌细胞表面微绒毛与病灶间质结合能力弱,癌细胞易脱落;③ PIMPC病灶中存在大量脉管结构,使癌细胞易通过脉管转移。本研究表明,超声诊断PIMPC淋巴结转移具有较高的特异度与阳性预测值,但灵敏度较低,与PIMPC主要通过脉管浸润、转移相关。PIMPC早期通过淋巴管转移,而淋巴结未受侵犯,因此超声诊断其淋巴结转移的灵敏度较低。
综上所述,PIMPC的超声表现以形态不规则、边界不清、边缘毛刺及低血流信号为主,与乳腺肿瘤组织病理学特征密切相关。超声对提示PIMPC腋窝淋巴结转移具有一定的临床价值。
