利用V2O5制备氮化钒铁的反应过程及动力学研究
2019-07-20王斌李冬杜金晶朱军刘漫博王欢
王斌,李冬,杜金晶,朱军,刘漫博,王欢
(1.西安建筑科技大学冶金工程学院,陕西西安,710055;2.陕西省先进储能与钒新材料工程技术研究中心,陕西安康,725000)
添加钒可显著提高钢材的强度和韧性[1-2],主要应用于炼钢领域,其添加形式主要包括钒铁、氮化钒和氮化钒铁等。其中,氮化钒和氮化钒铁是较新型的含钒添加剂,由于氮元素的引入提高了合金强化作用,因此可节约钒元素的使用,从而有助于降低炼钢成本[3-4]。氮化钒铁与氮化钒在炼钢时的作用机理相近,但与氮化钒相比,氮化钒铁具有密度大的优势,炼钢过程中,可更有效地穿越渣层,进入到钢水内,因此钒的稳定性更强,更容易精确控制。目前,氮化钒铁的制备方法普遍采用钒铁渗氮法,即以熔融或粉末的钒铁为原料,进行高温液体渗氮[5-6]或固态渗氮[7-12]。由于钒铁原料本身的制备过程能耗较高,并且会产生大量的含钒废渣[13-14],因此会造成钒资源的浪费,同时也会造成环境压力。为避免使用钒铁原料,有研究直接以钒氧化物、铁粉和碳粉为原料,进行了氮化钒铁的制备,混合均匀的物料压制成型后,在氮气气氛下加热,经还原、碳化和氮化反应,最终可制得氮化钒铁[15-17]。该方法工艺简单、无污染,应用前景广阔,但目前关于该方法的研究主要集中在工艺条件方面,对化学反应过程的研究较少。鉴于此,本文作者针对钒氧化物直接制备氮化钒铁工艺的反应过程开展研究,采用TG-DSC技术分析各温度阶段发生的反应,并利用失重曲线对反应的动力学过程进行研究。
1 实验
1.1 实验过程
将分析纯V2O5(纯度99.99%)粉末、分析纯石墨粉(C 质量分数不少于98.0%)与分析纯还原铁粉(铁质量分数不少于98%)混合,其中V2O5粉与石墨粉的质量比为1:0.3。混合粉料在70℃下烘干4 h,然后置于STA449F3 型同步热分析仪进行DSC-TG 测试,升温速率5℃/min,分别通入高纯氩气和高纯氮气获得数据曲线。采用DMAX-2400型X线衍射仪对样品物相进行分析。采用Quanta 600FEG扫描电子显微镜观察合金形貌。
1.2 热重计算及动力学分析原理
采用非等温法分析制备过程中的动力学,即在线性升温条件下测出制备过程的热重曲线,再根据热重曲线得到有关的动力学参数[18-19]。动力学研究的基本关系如下:
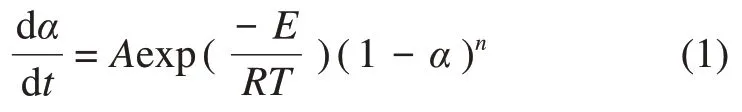
式中:α为反应转化率;n为反应级数,n=1;K为反应速率常数;E为反应活化能,kJ/mol;R为摩尔气体常数;A为频率因子。
由恒定升温速率可得:
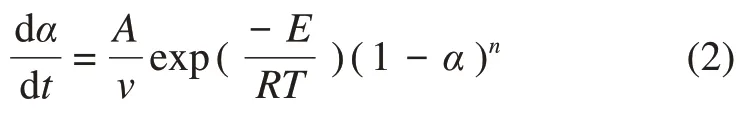
采用Coats-Redfern积分法,其积分方程为
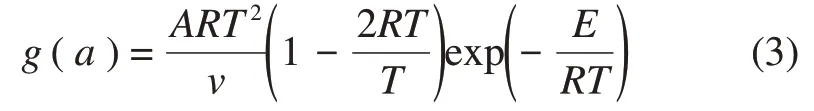
当1>>2RT/E时,式(3)可简化为g(a)=,其中,,为反应机理函数的积分形式。
不同反应机理有不同的动力学反应机理函数。本研究的反应体系是较典型的气-固反应体系,通过前期计算试选,采用一级反应机理函数g(α)=-ln(1-α)。
对式(3)两边取对数,可得:
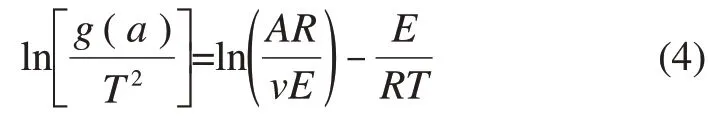
以1/T为横坐标,为纵坐标作图,可得斜率为-E/R,截距为ln(AR/(υE))的直线,由此可计算得到活化能E、指前因子A以及反应速率方程。
2 结果与讨论
2.1 反应过程分析
试样在氩气和氮气气氛下反应的TG-DSC 曲线如图1所示。
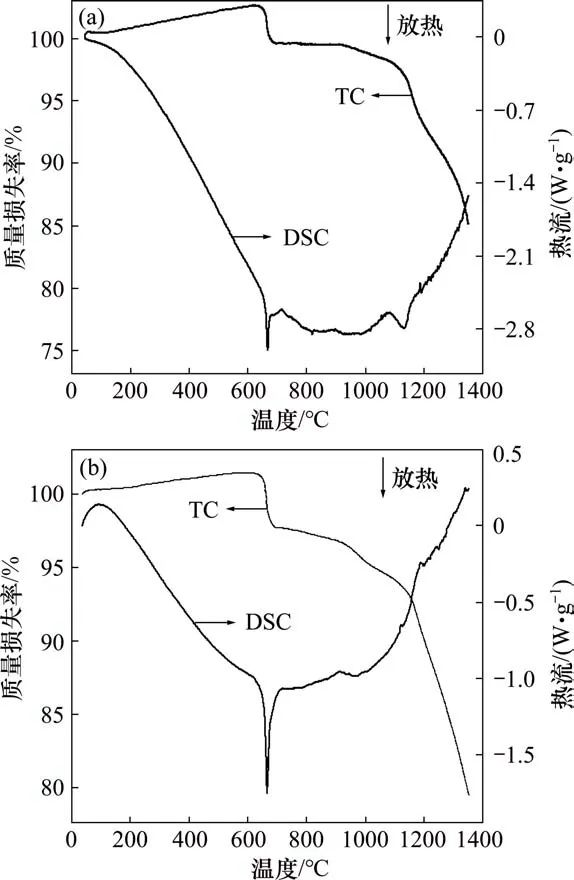
图1 不同气氛下反应的TG-DSC曲线Fig.1 TG-DSC curves under nitrogen and argon
由图1可知:在氩气和氮气气氛下,试样的TG曲线走向基本一致。在670℃左右,出现1个明显的质量损失平台,由于此时处在V2O5熔点附近,因此物料质量损失与V2O5的熔化挥发有很大关系。但由于DSC 曲线中出现了明显的放热峰,说明质量损失不仅与挥发损失有关,而且有一定的碳还原反应发生。这很可能是V2O5的熔化使原料相互接触面积增大,从而促进了反应快速进行。不断消耗碳而释放CO和CO2气体的过程也导致了体系的质量损失。图2所示为在氮气气氛下,试样在650℃保温4 h 后产物XRD图。由图2可知:反应出现了低价的钒氧化物,这说明碳还原反应已可以进行。因为V2O5熔化会造成物料黏连,不利于氮化钒铁的制备,因此,在实际制备过程中,应控制温度在670℃以下,保证足够的保温时间,从而使五价钒更彻底地转化为高熔点的低价钒。温度继续升高到670℃以上时,质量损失不断增加,质量损失速度也明显加快,这说明碳还原反应持续进行且反应速度随温度升高而加快。
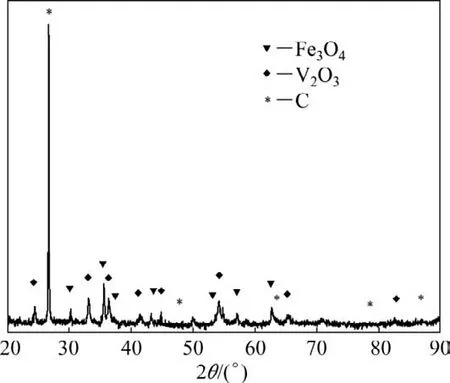
图2 氮气气氛下650℃保温4 h的产物XRD图Fig.2 XRD analysis of products at 650℃for 4 h under nitrogen atmosphere
图3所示为试样在氮气和氩气气氛下的质量损失速率曲线。可见:在670℃左右出现了第1 个速率峰,说明V2O5熔化引起了碳还原反应明显发生。在1 000℃左右,出现了第2 个速率峰,说明此时除了钒氧化物的还原反应外,还出现了一定的碳化反应:
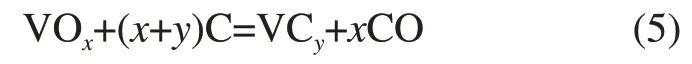
式中,x和y为反应系数。
图4所示为氮气气氛下,试样在1 000℃保温4 h后产物的XRD图。由图4可知:除了钒、铁的氧化物外,还有出现了部分的碳化物。在1 200℃左右,出现了更明显的第3个速率峰,说明此时碳化反应开始显著进行。继续升温到1 200℃以上时,氮气气氛下试样的质量损失速率明显比氩气气氛下的大,这很可能是因为在此温度范围内,在氮气气氛下,除了还原反应和碳化反应外,氮化反应(如式(6)所示)也开始发生,氮化过程消耗了一定的钒碳化物,从而促进了碳还原反应更彻底的进行。
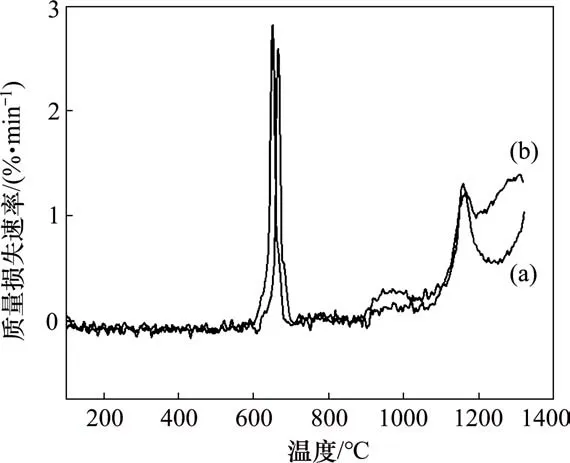
图3 氮气和氩气气氛下试样的质量损失速率曲线Fig.3 Mass loss rate curves under nitrogen and argon atmosphere
图5所示为氮气气氛下,试样在1 200℃保温4 h后产物的XRD图。从图5可以看出:试样中出现了一定量的氮化钒。
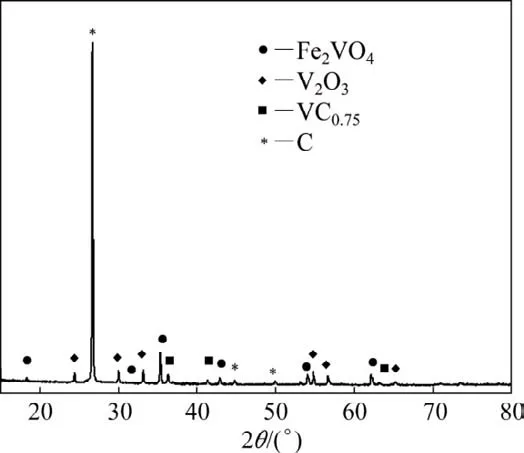
图4 氮气气氛下1 000℃保温4 h的产物XRD图Fig.4 XRD analysis of products at 1 000℃for 4 h under nitrogen atmosphere
2.2 反应动力学分析
氮化钒铁制备的还原碳化主反应主要发生在高温阶段,因此,选取质量损失速率较大的2个高温温度区间进行动力学分析,分别为970~1 100℃和1 150~1 350℃。将动力学机理函数g(α)=-ln(1-α)及对应温度区间的质量损失比例代入式(4),计算得到与的点状图及回归方程,如图6所示。
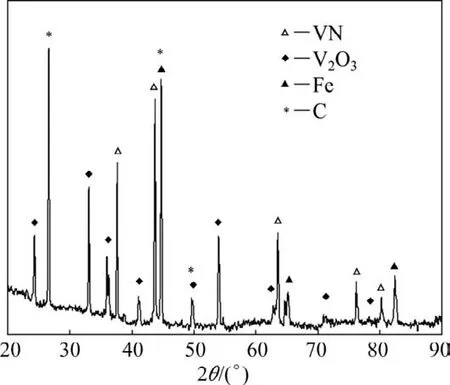
图5 氮气气氛下1 200℃保温4 h的产物XRD图Fig.5 XRD analysis of products at 1 200℃for 4 h under nitrogen atmosphere
将拟合直线的斜率和截距代入式(4)可以得到970~1 100℃和1 150~1 350℃的反应速率方程分别为:
dα/dT=5.042×103exp(66 928/(RT))(1-α)
dα/dT=2.555×106exp(128 175/(RT))(1-α)
在氮气气氛下,同样选取970~1 100℃和1150~1 350℃温度区间进行动力学分析。计算得到与的点状图及回归方程,如图7所示。由图7可知:在氮气气氛下,反应过程与基本呈线性关系,且拟合程度较高,拟合相关系数在0.98以上,还原反应符合一级反应的动力学机制函数,计算得到的相关动力学参数见表2。
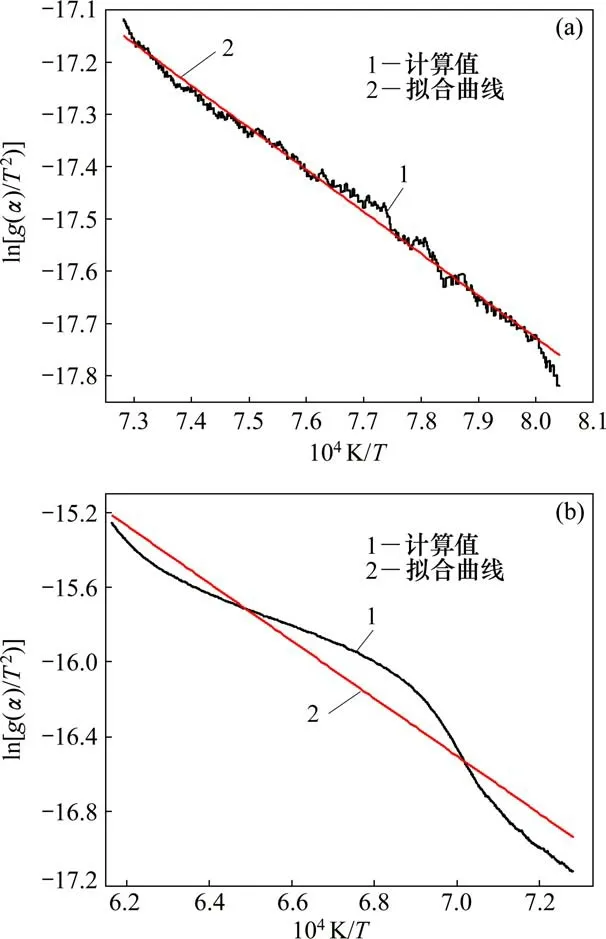
图6 氩气条件下ln[(g(α))/T2]-1/T点状图及回归方程Fig.6 Regression equation and dot figure of ln[(g(α))/T2]-1/T under Ar atmosphere
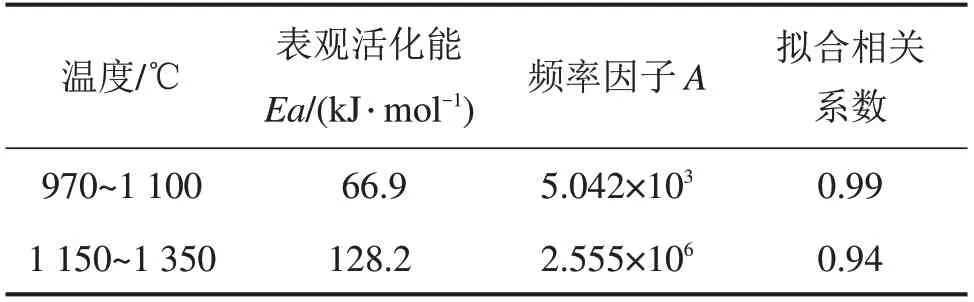
表1 氩气条件下温度区间内的活化能及频率因子Table 1 Activation energy and frequency factors of vanadium oxide reduction for each reactive temperature range under Ar atmosphere
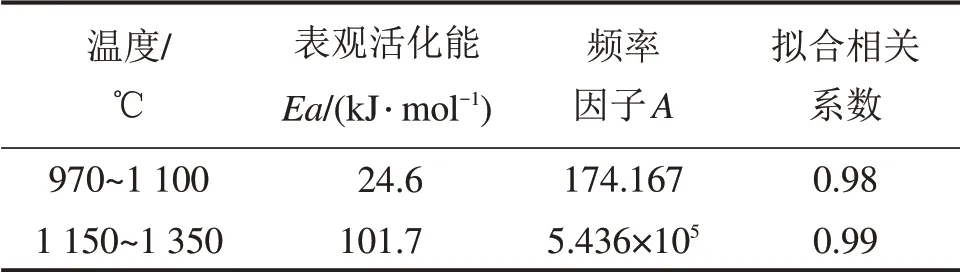
表2 氮气条件下温度区间内的活化能及频率因子Table 2 Activation energy and frequency factors of vanadium oxide reduction for each reactive temperature range under N2 atmosphere
由表2可以看出:在氮气气氛下,反应的活化能均比氩气条件下的低。说明在1 000℃以上的高温阶段,渗氮过程已逐渐开始,氮化反应消耗了部分碳化钒,从而促进了碳化反应的进行,降低了反应活化能。在氮气气氛下,1 150~1 350℃的反应活化能比970~1 100℃的高,说明此时随着碳化钒铁、氮化钒铁的逐渐增多,产物的包覆作用逐渐变大,扩散过程阻碍了反应的进行。
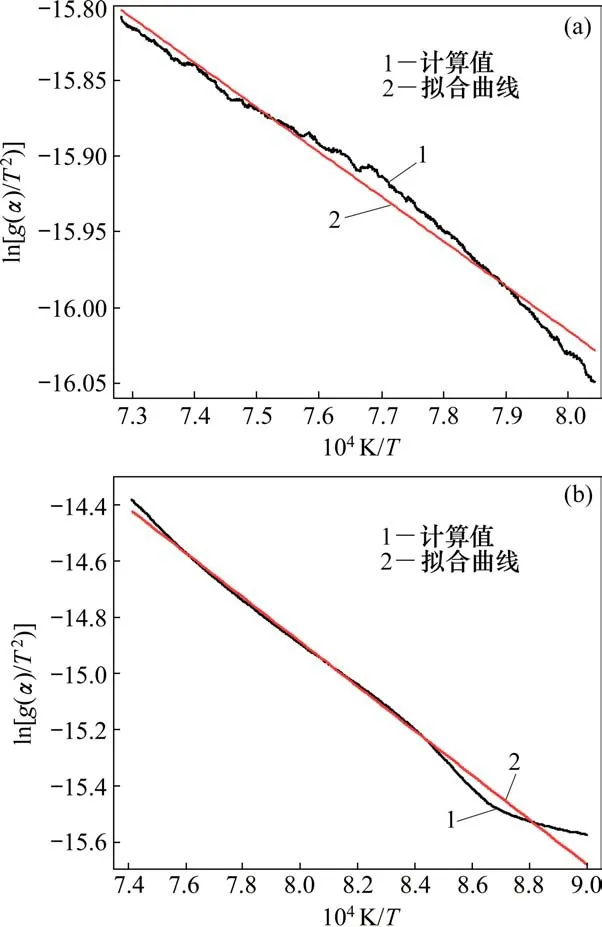
图7 氮气条件下ln[(g(α))/T2]-1/T点状图及回归方程Fig.7 Regression equation and dot figure of ln[(g(α))/T2]-1/T under N2 atmosphere
将拟合直线的斜率和截距代入式(4)可以得到970~1 100℃和1 150~1 350℃反应速率方程分别为:
dα/dT=174.167exp(24 569/(RT))(1-α)
dα/dT=5.436×105exp(101 720/(RT))(1-α)
图8所示为氮气气氛下,在1 400℃保温2 h试样的碳、氮元素面扫描结果。由图8可以看出:碳、氮元素四周分布密集,而中间区域较少,这也表明了碳化和氮化产物存在着明显的包覆作用,阻碍渗氮过程进行。因此,氮化钒铁实际制备过程中,在保证球团强度的前提下,应尽量提高其孔隙率并适当提升氮气流量。

图8 氮化钒铁产物C和N元素分布Fig.8 C and N distributions of nitrided ferrovanadium
3 结论
1)利用V2O5为原料直接制备氮化钒铁,在670℃左右,碳还原反应即可发生,当温度分别达到1 000℃和1 200℃以上时,碳化反应和氮化反应可以显著进行。
2)在氮气气氛下,1 150~1 350℃反应的活化能比970~1 100℃时的高,生成较多的碳化和氮化产物会产生包覆作用,阻碍反应进一步进行。
3)氮气气氛下V2O5直接制备氮化钒铁的高温碳还原和渗氮反应符合一级反应的动力学机制。970~1 100℃和1 150~1 350℃条件下反应速率方程分别为:dα/dT=174.167 exp(24 569/(RT))(1-α)和dα/dT=5.436×105exp(101 720/(RT))(1-α)。
