肝细胞癌组织O-GlcNAc糖基化水平变化及其与血管生成素2表达的关系
2019-07-19王爱红赵菊梅魏晓丽庞秋霞王明全
王爱红,赵菊梅,魏晓丽,庞秋霞,王明全
(1 延安大学医学院,陕西延安716000;2 延安市肿瘤防治研究重点实验室;3 延安大学附属医院)
肝癌是世界上癌症相关死亡的主要原因之一,其中90%以上为肝细胞癌[1]。目前,肝细胞癌的病因和发病机制尚不完全清楚。O-N-乙酰葡萄糖胺(O-GlcNAc)糖基化修饰是一种存在于细胞核及细胞质的翻译后修饰方式,可参与细胞的多种应激响应及细胞进程[2]。O-GlcNAc糖基转移酶(OGT)和O-GlcNAc糖苷水解酶(OGA)是O-GlcNAc糖基化修饰过程中最重要的两种酶。近年研究发现,蛋白质O-GlcNAc糖基化可参与恶性肿瘤的发生、发展[3]。血管生成素2(Ang2)是调节肿瘤血管生成的关键因子[4]。研究发现,在肝细胞癌组织中Ang2表达明显升高,且其表达与肿瘤恶性程度和患者预后密切相关[5]。本研究探讨了肝细胞癌组织O-GlcNAc糖基化水平变化及其与Ang2表达的关系。现报告如下。
1 资料与方法
1.1 临床资料 选择2013年3月~2018年5月延安大学附属医院收治的初诊肝细胞癌患者57例(观察组)。所有患者入院前未行任何抗肿瘤治疗,入院后接受手术治疗并经术后组织病理检查明确诊断。排除合并其他重要脏器严重疾病者、不配合治疗者以及存在手术禁忌证者。其中,男37例、女20例,年龄(51.6±6.7)岁,BMI(23.86±2.60)kg/m2;肿瘤直径:≤3 cm 27例,>3 cm 30例;组织学分级:Ⅰ级14例,Ⅱ级13例,Ⅲ级30例;BCLC分期:0、A期37例,B、C期20例;有淋巴结转移43例,无淋巴结转移14例。同期选择接受手术治疗的肝脏良性占位性病变患者40例(对照组),男23例、女17例,年龄(52.4±8.1)岁,BMI(24.11±2.74)kg/m2;疾病类型:肝血管瘤28例、肝炎性假瘤2例、肝局灶性结节性增生4例、肝腺瘤性结节性增生3例、肝局灶性脂肪变3例。两组性别、年龄、BMI具有可比性。本研究经延安大学附属医院医学伦理委员会批准,患者或其家属知情同意。
1.2 OGA、OGT、Ang2表达检测 ①OGA、OGT、Ang2 mRNA表达检测:采用RT-PCR法。取手术切除的肝细胞癌组织及肝脏良性占位性病变组织,采用TRIzol法提取组织总RNA。取总RNA 1 μg,按High-Capacity RNA-to-cDNATMKit说明逆转录为cDNA。以cDNA为模板,按2×SYBR Green qPCR Mix说明进行PCR扩增。所有引物由上海彩佑实业有限公司设计合成。引物序列:OGA上游引物5′-TTCACTGAAGGCTAATGGCTCCCG-3′,下游引物5′-ATGTCACAGGCTCCGACCAAGT-3′;OGT上游引物5′-CATCGAGAATATCAGGCAGGAG-3′,下游引物5′-CCTTCGACACTGGAAGTGTATAG-3′;Ang2上游引物5′-TCCAAGAGCTCGGTTGCTAT-3′,下游引物5′-AGTTGGGGAAGGTCAGTGTG-3′;β-actin上游引物5′-GTGGGGCGCCCCAGGCACCA-3′,下游引物5′-CTCCTTAATGTCACGCACGATTT-3′。PCR反应体系共50 μL:2×SYBR Mixture(with ROX)25 μL,上下游引物各1 μL,模板DNA 2 μL,RNase-free水补足至50 μL;反应条件:95 ℃ 10 min,95℃ 15 s、60 ℃ 1 min共40个循环。以β-actin为内参,采用2-ΔΔCt法计算目的基因相对表达量。实验重复3次,取平均值。②OGA、OGT、Ang2蛋白表达检测:采用Westen blotting法。取手术切除的肝细胞癌组织及肝脏良性占位性病变组织,RIPA裂解液冰上充分裂解,提取组织总蛋白,经BCA法蛋白定量合格。加入5×蛋白上样缓冲液,100 ℃水浴5 min,使蛋白充分变性。取变性蛋白20 μL,SDS-PAGE(8%浓缩胶、5%分离胶)分离蛋白,并将蛋白电泳产物转印至PVDF膜上。5%脱脂牛奶室温封闭1 h,分别加入OGA、OGT、Ang2、β-actin一抗,4 ℃孵育过夜。次日,加入辣根过氧化物酶标记的羊抗鼠IgG二抗,室温孵育1 h。ECL发光,暗室中曝光、显影。采用Odyssey红外荧光扫描成像系统扫描各蛋白电泳条带,Image J软件分析各蛋白电泳条带灰度值。以β-actin为内参,以目的蛋白电泳条带灰度值与内参蛋白电泳条带灰度值的比值作为目的蛋白相对表达量。实验重复3次,取平均值。

2 结果
2.1 两组OGA、OGT、Ang2 mRNA和蛋白表达比较 见表1。

表1 两组OGA、OGT、Ang2 mRNA和蛋白相对表达量比较
注:与对照组比较,*P<0.05。
2.2 OGA、OGT表达与Ang2表达的关系 相关分析显示,OGA、OGT mRNA表达与Ang2 mRNA表达均呈正相关关系(r分别为0.59、0.65,P均<0.05),OGA、OGT蛋白表达与Ang2蛋白表达亦呈正相关关系(r分别为0.44、0.57,P均<0.05)。
2.3 肝细胞癌组织OGA、OGT、Ang2蛋白表达与患者临床病理特征的关系 见表2。
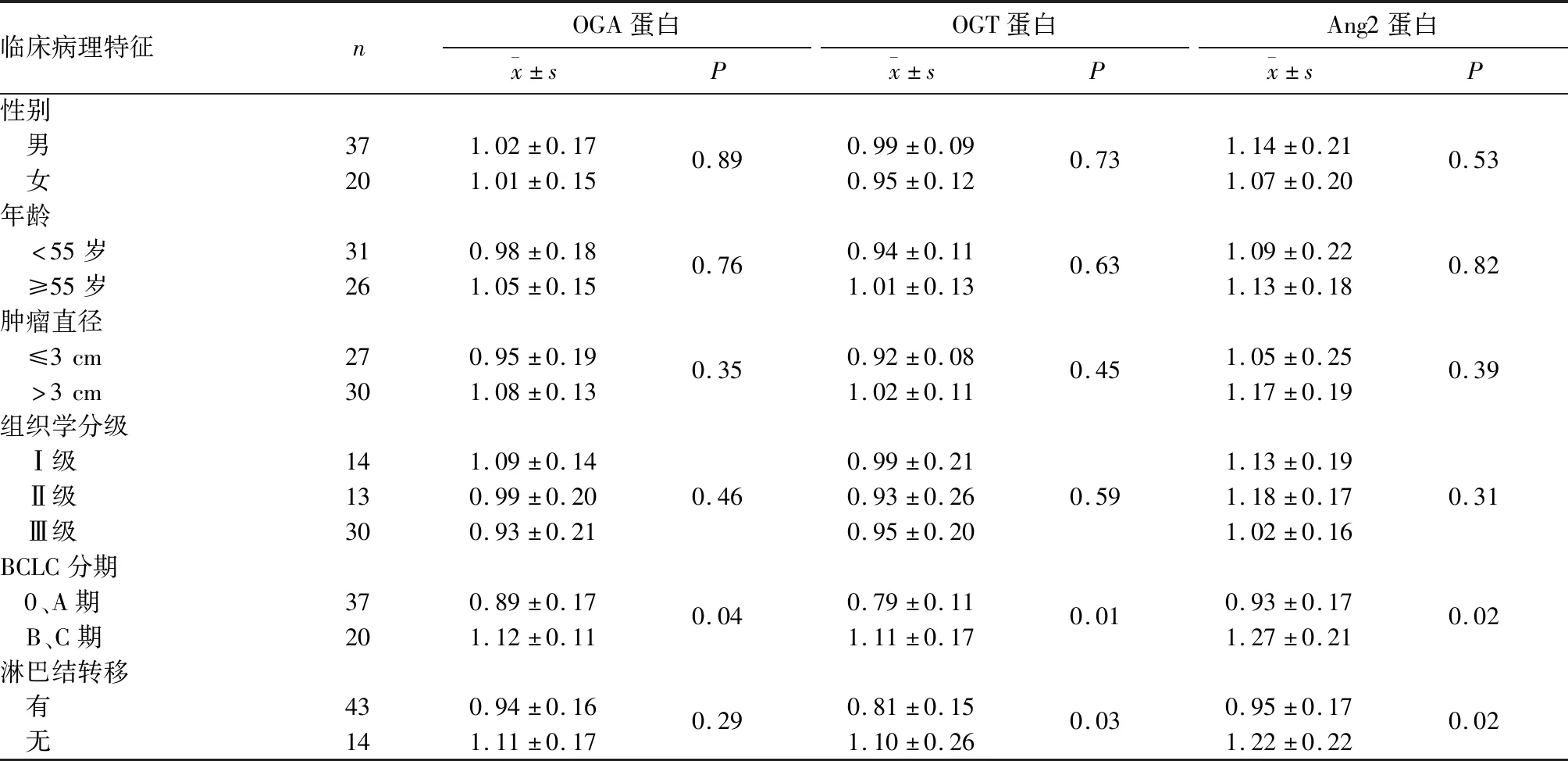
表2 肝细胞癌组织OGA、OGT、Ang2蛋白表达与患者临床病理特征的关系
3 讨论
O-GlcNAc糖基化修饰是一种重要的翻译后修饰方式。近年研究发现,蛋白质O-GlcNAc糖基化可参与恶性肿瘤的发生、发展[3]。OGT可增加p-JNK、p-c-Jun蛋白表达和AP-1激活,从而激活JNK/c-Jun/AP-1级联反应,并提高p-IKKα/β、p-p65、p-p50、NF-κB的DNA结合活性,激活NF-κB信号通路,促进肿瘤生长和转移[6]。糖基化终末产物特异性受体能够通过该蛋白在Ser73上的O-GlcNAc糖基化提高原癌蛋白c-Jun的活性和稳定性[7]。OGT蛋白还可调节E-选择素基因的启动子活性、抑制cAMP反应元件、增强AP-1和E-选择素表达,促进恶性肿瘤浸润和侵袭[8]。OGA能去除O-GlcNAc糖基化修饰。有研究发现,乳腺癌组织OGA活性明显升高,其活性越高,肿瘤侵袭性越强[9]。以上结果表明,O-GlcNAc糖基化可能在恶性肿瘤的发生、发展中具有重要作用。
血管生成是肿瘤形成中的标志性事件。Tie2是内皮细胞上特异的酪氨酸激酶型受体,为Ang1和Ang2的共同受体。Ang1作为促血管生成因子,能够通过激活并磷酸化Tie2,促进血管成熟并维持血管结构。Ang2作为Ang1的拮抗剂,能够竞争性抑制Ang1的作用,从而降低血管稳定性。肿瘤组织Ang2表达升高,可促进肿瘤生成、侵袭和转移[10]。Chen等[5]研究发现,肝癌组织Ang2 mRNA表达明显升高,且其高表达与患者预后不良明显相关;而使用特异性shRNA抑制Ang2表达,肝癌细胞增殖速率明显受到抑制。结果表明,Ang2可能在肝细胞癌的发生、发展中具有重要作用。
O-GlcNAc糖基化与肿瘤血管生成的关系是目前临床研究的热点。果糖-6-磷酸酰胺转移酶1(GFAT1)是己糖胺生物合成途径(HBP)中的限速酶,控制着O-GlcNAc糖基化修饰过程。GFAT1/HBP是血管内皮生长因子(VEGF)调控血管生成的重要通路[11]。前列腺癌PC3-ML细胞中O-GlcNAc糖基化水平下降可导致MMP-2、MMP-9、VEGF表达下调,从而抑制肿瘤侵袭和血管生成[12]。此外,O-GlcNAc糖基化可增强绒毛膜癌JARR细胞黏附能力,促进肿瘤细胞迁移。有研究还发现,SP3蛋白的O-GlcNAc糖基化修饰水平增加可导致Ang2启动子中葡萄糖反应性GC盒结合降低,导致Ang2表达增加[13]。由此推测,O-GlcNAc糖基化与肿瘤血管生成密切相关。
本研究结果显示,观察组OGA、OGT、Ang2 mRNA和蛋白表达均明显高于对照组;相关分析显示,OGA、OGT表达与Ang2表达均呈正相关关系;肝细胞癌组织OGA、OGT、Ang2蛋白表达均与BCLC分期有关,OGT、Ang2蛋白表达还与淋巴结转移有关。提示三者均参与肝细胞癌的发生、发展,并且O-GlcNAc糖基化与Ang2具有协同促进作用。但O-GlcNAc糖基化与Ang2的协同作用机制还需进一步研究。
综上所述,肝细胞癌组织O-GlcNAc糖基化水平明显升高;O-GlcNAc糖基化有可能通过调节Ang2表达促进肝细胞癌的发生、发展。
