重组人源化抗TNF-α单抗纯度稳定性的研究
2019-07-18曾晶陈小敏
曾晶,陈小敏
(1.湘南学院基础医学院,湖南郴州 423000;2.深圳波顿香料有限公司,广东深圳 518051)
单克隆抗体具有高特异性、高活性和低毒性等特点,从而使其在医药领域备受关注,并逐渐成为国内外药物研发企业的研究热点[1-2]。但单抗类药物结构复杂且不稳定,尤其是在药物收获期间容易降解和失活[3],这些降解不仅会降低抗体纯度,还可能引发患者的免疫反应产生诸多安全问题。因此,如何减少单抗在生产过程中的降解以保证其纯度的稳定是生物药最终成功应用于临床的关键[4-6]。
生物仿制药的研发过程具有所有生物药物的技术复杂性,因此工艺对产品质量的影响极大。若生物仿制药产品质量与原研药不一致[7],或者在整个产品生产周期内出现质量问题,对生物仿制药的研发将是毁灭性的打击[8]。
在抗体收获期间,最容易遇到的是纯度降解问题,主要原因是收获过程中离心等操作的机械剪切力会对抗体造成一定的损伤[9],另一方面,细胞在大剪切力下会发生裂解从而释放出大量的还原性酶使抗体的二硫键断裂[10],这不仅会影响抗体纯度,而且对抗体临床用药的安全性和有效性也会产生极大的影响。
有研究显示,在抗体收获期间,向培养液中不间断通气能保护抗体的二硫键[11],本实验也证实通气对抗体纯度具有一定的保护作用,但持续通入空气会导致抗体主峰减少和酸性峰增加。CuSO4作为一种氧化剂,它能使抗体中自由巯基量减少,也可以促使未成对的二硫键进一步结合[12]。EDTA-2Na作为一种金属螯合剂,能够有效地与金属离子结合,由于多数核酸酶和部分蛋白酶的催化作用需要Mg2+存在,故常用作核酸酶、蛋白酶的抑制剂,从而抑制还原酶的还原作用。
单抗纯度稳定性是单抗生产中的一个重要指标,也是各制药商重点研究的内容。本实验通过添加酶抑制剂或者抗还原剂的方式,使抗体在下罐过程中的纯度更加稳定,对单抗药物的生产具有重大意义。
1 材料与方法
1.1 材料
标准品为重组人源化抗TNF-α单抗,由本实验室保存;细胞发酵液由本实验室发酵制得;乙二胺四乙酸二钠(EDTA-2Na)、CuSO4均购于Sigma公司;高效毛细管电泳系统为Beckman公司的PA800 Plus。
1.2 方法
1.2.1 发酵液裂解
取400 mL发酵液置于-80 ℃冰箱中,待全部冻结以后,拿出至室温缓慢解冻,如此反复3~5次,采用反复冻融的方式进行细胞裂解。
1.2.2 实验样品放置条件
待细胞裂解后,8 000 r/min 条件下离心 10 min,收集上清,并用0.2 μm的滤膜过滤除菌。另配制CuSO4、EDTA-2Na母液并过滤除菌。在超净台中将细胞裂解液的上清分装至5个无菌瓶中,每瓶100 mL。一瓶作为对照,不添加任何物质;一瓶持续从底部通入流量为5 mL/min的无菌空气;另两瓶分别加入适量的EDTA-2Na、CuSO4母液,使其终浓度分别为 10 mmol/L EDTA-2Na 和 70 μmol/L CuSO4;另 取100 mL未裂解细胞的发酵液作为阴性对照。所有样品均置于25 ℃条件下,分别于放置24 h和48 h时取样进行Protein-A纯化,并进行后续实验。
1.2.3 Protein-A精细纯化
Protein-A柱用pH为7.3的20 mmol/L PB + 150 mmol/L NaCl平衡柱子,平衡体积为 15~ 20 mL;将上一步放置的实验样品上柱,体积为15~20 mL;用冲洗缓冲液 20 mmol/L PB + 150 mmol/L NaCl上柱,直至基线平稳即可;再用pH 3.7的柠檬酸缓冲液进行洗脱,观察A280值并进行纯化后样品的收集,待A280小于70时停止收集;最后用0.1 mol/L NaOH进行清洗。
1.2.4 非还原十二烷基硫酸钠毛细管电泳(CE-SDS)
用超纯水将上述样品稀释至2 mg/mL,将25 μL样品、50μL 2×SDS 样品缓冲液、5μL 250 mmol/L碘乙酰胺加入离心管,最后加入超纯水补至终体积为100 μL,涡旋混匀 20 s,70 ℃条件下水浴 4 min,取75 μL至上样瓶进行上机分析。分离电压为15 kV,毛细管温度为(20±2)℃,样品传送带温度为(17±2)℃,检测波长为214 nm。
2 结果与分析
2.1 裂解细胞
反复冻融多次后对细胞密度进行前后对比,结果如表2。
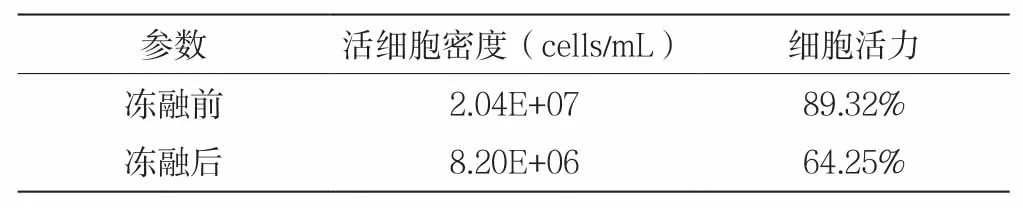
表2 冻融前后细胞密度活力
从表2可以看出,反复冻融后60%的细胞发生了裂解,该条件可模拟大部分细胞发生裂解使得内含物被释放,进而提供单抗被还原的环境。
2.2 非还原CE-SDS
对非还原CE-SDS方法进行验证,同一标准品重复检测三次的结果见表3。
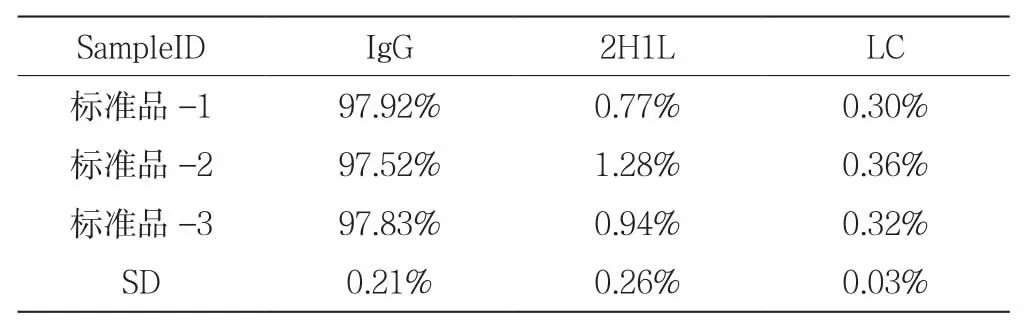
表3 标准品非还原CE-SDS检测纯度
IgG标准偏差为0.21%,且检测结果均>95%,表明该方法稳定,能作为该单抗纯度的检测方法。
对实验组进行检测,具体实验数据见表4。
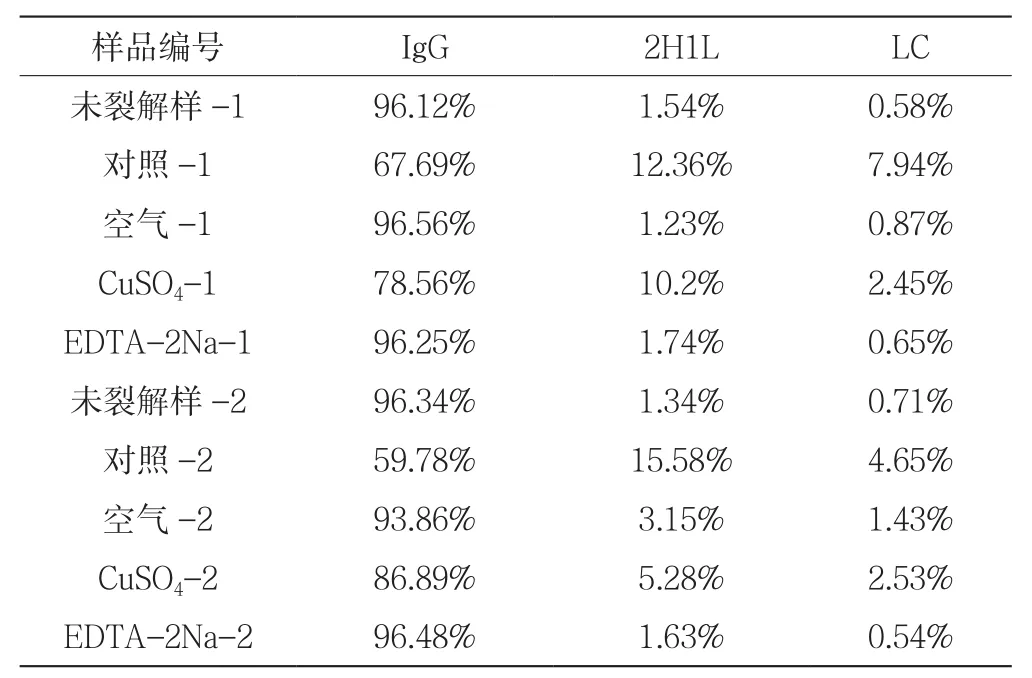
表4 实验组非还原CE-SDS检测纯度
由未裂解组与对照组比较可知,细胞裂解后的内涵物被释放出来会导致单抗的纯度由96.34%以上降低至59.78%,说明纯度降解模型构建是成功的。另外三组实验结果均显示该条件能够在一定程度上抑制单抗纯度的降低,但只有EDTA-2Na能够完全抑制还原酶,使单抗纯度能够持续维持在正常水平,发挥了提高抗体稳定性的作用。
3 结论
本研究对单抗纯度问题进行了探讨,细胞裂解后释放的还原酶能破坏抗体结构,从而导致抗体纯度降低,而通过添加CuSO4和EDTA-2NA能有效降低还原酶对抗体纯度的影响。
在发酵下罐的过程中,还有一系列的操作能防止抗体被破坏。例如,采用台式离心的方式进行料液澄清以减少剪切力;添加还原酶抑制剂以抑制还原酶的作用;降低下罐料液的pH以降低相关酶的活性。在采用这些方式的同时,还需考虑此操作对电荷异质性、多聚体以及多糖的影响,以保证抗体的安全性和有效性。
