盐胁迫对不同粒型花生品种种子吸水特性的影响
2019-07-18温赛群张冠初田家明穆国俊张智猛
温赛群,徐 扬,张冠初,3,田家明,,袁 光,穆国俊,张智猛*
(1.河北农业大学农学院,河北 保定 071001; 2.山东省花生研究所,山东 青岛 266100;3.沈阳农业大学农学院,辽宁 沈阳 110866; 4.新疆农业大学农学院,新疆 乌鲁木齐 830052)
中国是世界上土地盐碱化面积最大的国家之一,耕地盐碱化面积占全国耕地面积的6.62%,农业生产中的盐胁迫已成为限制土地生产力的主要因子之一[1-2]。巨大潜在盐碱地资源的开发利用是进一步发展农业生产的重要举措之一[3]。花生是我国主要的油料作物和经济作物,与其他作物相比,投资小、用工少,效益高且较耐盐碱,是盐碱地区发展农业生产、优化种植结构适宜的替代作物[4-5]。因此,探讨盐胁迫环境下花生种子吸水特性对提高盐碱地花生出苗率有重要意义,并为进一步完善盐碱地花生高产栽培技术奠定理论基础。
花生种子在盐碱地中受环境胁迫影响易遭遇萌发迟、苗小而弱和出苗不全不齐等问题,严重影响盐碱地花生苗期的生长。种子萌发从吸水开始,花生种子的吸水量要达到本身质量的35%~40%才能萌动[6-9]。以往研究表明,不同品种间不同形状、大小和质量的花生种子吸水过程存在差异,如花育22号和花育33号在相同质量下其种子越细长,吸水速率越大,大粒类型种子吸水率高于小粒类型等[10-12]。
因此,确保盐碱地中花生种子萌发前充分吸水,对种子正常萌发和出苗等至关重要。为此,本试验选用不同粒型花生品种并设置不同盐胁迫浓度处理,探究盐胁迫对花生种子吸水特性的影响,旨在为花生选种和解决盐碱地花生种子萌发迟缓等问题提供理论依据,并为盐碱地花生高产栽培技术提供参考。
1 材料与方法
1.1 试验材料
供试品种为花育25号(HY25)、花育36号(HY36)、冀花13号(JH13)和花育20号(HY20),均为2017年9月山东省花生研究所莱西试验站正常收获并自然晾晒后的饱满花生种子。HY25、HY36、JH13和HY20各花生品种百仁质量依次为98.0g、98.0g、77.5g和68.6g,HY25和HY36属于大粒型花生品种,JH13属于中粒型花生品种,HY20属于小粒型花生品种[13]。
1.2 试验方法
供试土壤采自山东省花生研究所莱西试验地0~30 cm表层土壤,风干、过筛(3 mm)后装入塑料盆中,每盆装入750 g。以分析纯NaCl配置0%、0.15%、0.30%、0.45%(m/V)不同浓度的NaCl溶液,6次重复,于播种前施入各组盆栽土壤中,使土壤含盐量分别达到预定浓度。依据田间持水量计算每盆的浇水量,使其刚好达到田间持水量的90%,人工气候室内自然蒸发至土壤含水量为60%~70%时进行播种。随机选取各品种种子并调查其粒型特征,用游标卡尺分别于子叶纵向最大长度、子叶横向最大长度和子叶最大厚度处测量每粒种子的长度、宽度和厚度,电子天平称量每粒种子的质量,种子编号后播入各盆中相应位置,每盆播种12粒,播种深度约3 cm,间距控制在5 cm。按不同胁迫浓度下的土壤水分含量适时补水,质量法控制补水量以确保土壤含水量一致。每隔4 h检测一次各粒种子质量吸水增加情况,种子吸水12 h后其吸水率变小、质量趋于稳定之后,每隔8h检测一次,直至吸胀饱满至恒量。
吸水率=(种子吸水至恒量时的质量-种子初始质量)/种子初始质量×100%
吸水速率=(种子吸水后质量-前一个阶段种子质量)/间隔时间
1.3 数据处理
采用SPSS 17.0对数据进行统计分析等,其中相关性分析采用Pearson相关系数法。
2 结果与分析
2.1 不同花生品种种子粒型特征
表1可知,四个品种中HY20种子长、宽、厚和质量最小,HY25和HY36种子各粒型指标相对较大,JH13居中;HY25种子较HY36长,但其宽、厚和质量较HY36小。各品种中HY36种子的长、宽、厚和质量各特征的变异系数最小,说明该品种的种子粒型相对整齐一致。 HY25种子宽度和厚度的变异程度相对较小,JH13的种子长度较为整齐一致。对各品种的种子粒型指标进行主成分分析,得到各提取成分的初始化特征值和方差贡献率,根据方差累计贡献率>85%的原则提取主成分[14-15]。如表2,仅PC1的方差贡献率就达到85%以上,因此只提取PC1为主成分。此外,种子的长、宽、厚和质量各特征与主成分PC1的相关系数分别为0.980、0.992、0.950和0.970,其中宽对主成分PC1的影响程度最大。用每个主成分的特征值作权数,对每个主成分进行加权加总,以此计算各品种的综合得分并排序,综合得分越高,表示种子粒型越大,各品种种子粒型由大到小依次为HY36、HY25、JH13和HY20,与根据百仁质量大小划分各品种粒型的结果一致(表3)[16]。
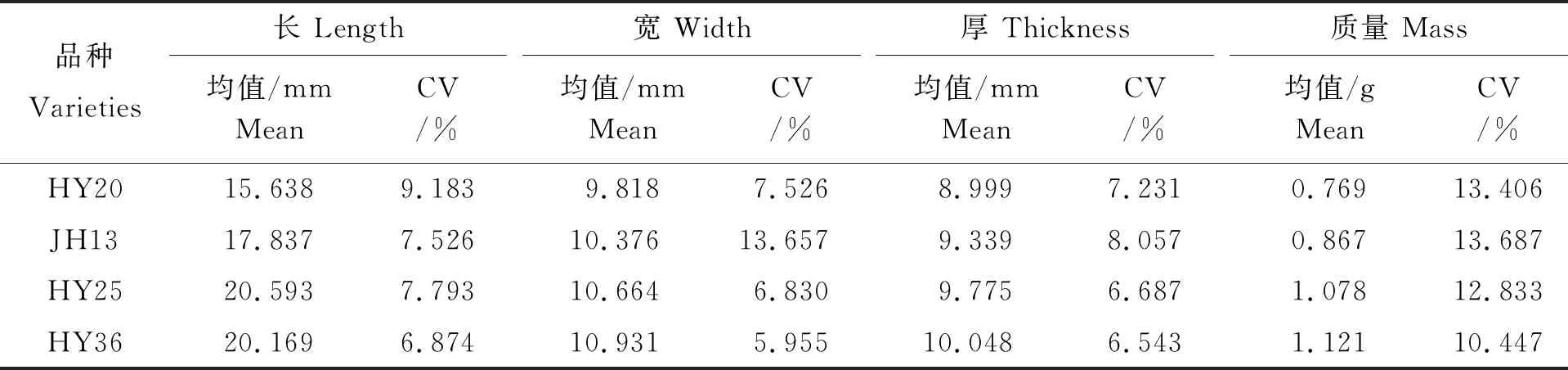
表1 不同花生品种种子的粒型特征

表2 不同花生品种种子粒型主成分分析

表3 不同花生品种粒型综合评价
2.2 盐胁迫下各品种种子吸水速率、吸水率变化
图1所示,在吸胀的0~44 h内,各处理下,各品种种子吸水速率均呈急速降低-缓慢降低-平稳的变化规律,在0~4 h时吸水最快,吸水速率急剧下降,4~36 h缓慢降低,其下降速率较最初4h低了81.63%~95.25%,之后均趋于平稳,其下降速率几近为零。在初始吸水的4~8 h内,0.15% NaCl处理下HY36和HY25的种子吸水速率变化甚微,其下降速度很小,而HY20相对于其他品种下降较快,但JH13略有上升,可能因为低盐环境下此时花生种子内部与周围土壤中还存在一定的水势差,较大粒型品种与土壤接触面积较大,吸水相对较多,吸水速率下降较慢。吸胀吸水前期,各花生品种种子吸水速率均随盐胁迫浓度增加而不同程度地降低,各品种对照处理下的吸水速率均最高,0.45%浓度胁迫下的吸水速率均表现最低。吸水12 h时,各品种种子吸水速率在0.15%、0.30%和0.45%各盐浓度胁迫处理下分别较对照降低17.38%~38.86%、32.53%~40.73%和49.91%~60.79%。吸水的12~20h内,0.15% NaCl处理下,HY36、HY25和JH13的种子吸水速率略有上升,之后各品种种子吸水逐渐变慢,36 h后在各盐胁迫处理下均趋于0。其中HY20的吸水过程停止较早,其次是JH13,HY36和HY25最晚。吸胀过程结束后,细胞内酶类逐渐被激活,种子开始萌动发芽,进入后萌发阶段,说明小粒型花生品种种子萌发及出苗所需时间可能相对较短。
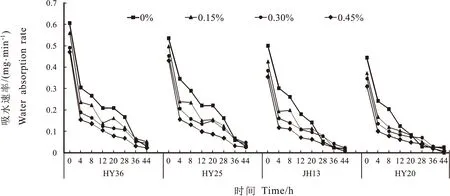
图1 不同盐处理下各花生品种的吸水速率 Fig.1 Water absorption rate of peanut varieties under different salt treatments

图2 不同盐处理下各花生品种的吸水率 Fig.2 Water absorption ratio of different peanut varieties under different salt treatments 注:图中不同小写字母表示处理间差异显著(p <0.05)。 Note: Different small letters in the figure indicated significant difference among different treatments at 0.05 level.
图2表明,同一花生品种的种子吸水率随盐胁迫浓度的升高而显著降低,各品种种子吸水率在0.15%、0.30%和0.45% NaCl胁迫处理下均显著低于对照,分别较对照低16.1%~22.4%、24.0%~34.4%和44.0%~49.9%,其中HY36和JH13种子吸水率在不同处理间均存在显著差异。0%和0.15% NaCl胁迫处理下,HY20种子吸水率最小,JH13次之,说明从吸水开始到吸胀吸水结束,小粒型花生品种吸水量相对较少,但足以达到萌动所需水量,从节水的角度考虑,非盐或低盐环境中选用粒型较小的花生种子较适宜;0.30% NaCl胁迫处理下HY25、HY36和JH13的种子吸水率达36%以上,而HY20则小于35%,低于萌动所需吸水量,为保证萌发,该盐环境中选用大、中粒型花生品种较为合适;0.45% NaCl 处理下,各品种种子吸水率均低于30%,说明高盐环境中,各粒型种子吸水和萌发出苗均较为困难。
2.3 花生种子粒型与吸水率和吸水速率间的相关性分析
相关性分析是衡量两变量间的线性相关程度[17-18]。如表4所示,不同品种种子粒型特征与其吸水率、吸水速率间相关性关系不同。0% NaCl处理下,各品种种子宽度和质量与吸水速率间均呈极显著正相关;除HY25外,其他品种种子厚度与吸水速率间均呈极显著正相关;HY20种子各粒型指标与吸水速率间均表现极显著正相关。0.15% NaCl处理下,除JH13外,其他品种种子宽度与吸水率间均呈极显著负相关,其长度与吸水速率间均呈显著正相关。0.30% NaCl处理下,JH13和HY20种子长度与吸水速率间均呈极显著正相关。0.45% NaCl处理下,各品种种子宽度与吸水率间均呈显著或极显著负相关;JH13和HY20种子宽度与吸水速率间均呈极显著正相关。表明不同盐胁迫环境下,各品种种子吸水率及吸水速率受不同粒型特征的影响。
综合来看,0%、0.15%和0.30% NaCl处理下,HY25种子质量与吸水率间均呈显著或极显著负相关;各盐浓度处理下,HY36种子质量与吸水率间均呈极显著负相关,JH13和HY20两品种种子质量与吸水速率间均呈显著或极显著正相关。不同盐胁迫环境下,大粒型品种种子质量与吸水率间存在不同程度的负相关性,中粒型和小粒型品种种子质量与吸水速率间表现出不同程度的正相关性。0%和0.15% NaCl处理下,HY20种子吸水率与宽度和厚度均呈显著或极显著负相关,而与长度呈不同程度的正相关,说明非盐或低盐环境下该品种中较为浑圆饱满的种子吸水率相对较小。
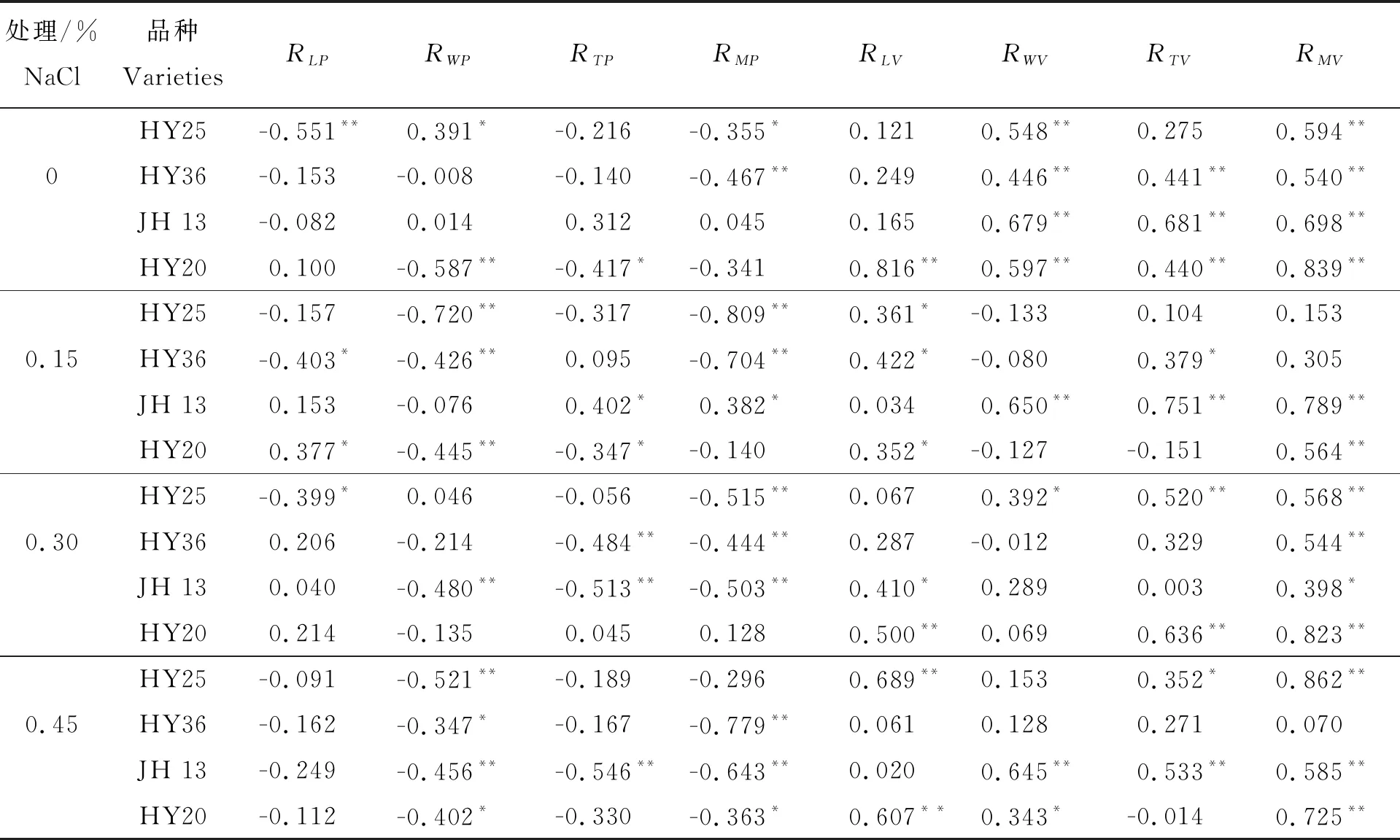
表4 不同盐处理下各花生品种种子粒型与吸水率和吸水速率间的相关性分析
注:RLP、RWP、RTP、RMP分别表示种子长、宽、厚、重与吸水率间的相关系数,RLV、RWV、RTV、RMV分别表示吸水12h时种子长、宽、厚、重与吸水速率间的相关系数。*表示在 0.05水平上显著相关,** 表示在 0.01水平上显著相关。
Note:RLP,RWP,RTP,RMPindicated the correlation coefficient between length and water absorption ratio, between width and water absorption ratio, between thickness and water absorption ratio, between mass and water absorption ratio of seeds, respectively.RLV,RWV,RTV,RMVindicated the correlation coefficient between length and water absorption rate, between width and water absorption rate, between thickness and water absorption rate, between mass and water absorption rate of seeds at 12 h, respectively. * stands for significant correlation at level 0.05, ** stands for significant correlation at level 0.01.
3 结果与讨论
本试验中最初时各品种种子吸水速率是最高的,随后处于吸水变慢的过程,该结果与以往研究基本一致,如姚君平等[19]研究了种子萌发需水量和吸水速度,结果发现不同类型花生最初4 h吸水均较快,可达全部吸水量的一半或更多,这一过程基本上是水分子间胶体运动的物理吸胀过程,种子物理吸水过程结束后,往往出现吸水速度的明显下降,吸胀过程结束后,细胞原生质发生水合作用,处于酶原状态的酶类逐渐被激活,而这一过程需要一定的时间。张俊等[20]采用水培方式进行了种子萌发试验,结果显示,吸胀吸水阶段大果品种吸水率略高于小果品种,本试验中非盐条件下该阶段大粒型品种的种子吸水率高于小粒型品种。
此外,本研究发现同一花生品种的种子吸水率随盐胁迫浓度的增加而显著降低,无论盐胁迫与否,大粒型品种的种子质量与吸水率之间均呈负线性相关关系;非盐和低盐环境下,HY20种子吸水率与宽度和厚度均呈显著或极显著负相关,高盐胁迫条件下,不同粒型品种种子宽度与吸水率之间呈负相关,说明该环境中越细长的种子其吸水率越大,0.45% NaCl处理下各品种吸水率均较低,因此,从种子萌发角度考虑,高盐环境中更适宜选用形状较细、吸水率较大的花生种子,以往研究也表明选择细长饱满的种子有利于快速萌发[11]。吸水12 h时,不施盐条件下,越宽越重的种子其吸水速率越大,小粒型品种HY20中相对较大的种子吸水速率越大;0.15% NaCl处理下,中粒型品种JH13和小粒型品种HY20中越重的种子吸水速率越大;0.30% NaCl处理下,JH13和HY20中较长的种子吸水速率较大,各品种中质量越大的种子吸水速率越大。0.45% NaCl处理下,JH13和HY20中越宽的种子吸水速率越大。不同品种在不同盐环境下种子各粒型指标与吸水率和吸水速率间的相关程度存在差异,花生选种时应综合考虑土壤环境和品种等因素。
