基于膳食结构的非酒精性脂肪性肝病动物模型
2019-07-17曾庆敏
曾庆敏,李 嘉
曾庆敏,天津医科大学研究生院 天津市 300070
曾庆敏,李嘉,天津市第二人民医院肝病科 天津市 300192
0 引言
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是全球最常见的慢性肝病[1].目前NAFLD的确切发病机制尚未阐明,除Day等[2]的“二次打击”理论外,认为其可能还与肠道菌群失调[3]、固有免疫调节紊乱[4]、自噬[5]及表观遗传学[6]等有关.改善饮食结构、减轻体重是预防和治疗NAFLD及其并发症最为重要的治疗措施[7],临床上尚缺乏针对NAFLD的特异性治疗方案,当前主要集中在二甲双胍、维生素E、他汀类药物等胰岛素抵抗(insulin resistance,IR)、抗氧化应激及降脂治疗[8].因此针对发病机制和相关治疗药物的研究是目前NAFLD急需攻破的难题.
针对NAFLD疾病谱的不同阶段,可建立相应的动物模型以模拟其病理生理变化及发病机制.迄今为止,已成功构建的NAFLD动物模型包括鼠、兔、鹌鹑、斑马鱼等[9],综合经济效益、可操作性等因素,鼠模型使用最多,C57BL/6小鼠、Wistar大鼠、Sprague Dawley大鼠这三种株系运用最为广泛.由于膳食结构及生活方式的改变对NAFLD的发生发展有深远影响,本文拟对不同饮食结构建立的NAFLD动物模型作一综述.
1 高脂饮食诱导的NAFLD模型
膳食脂肪摄入过多,致循环游离脂肪酸(free fatty acids,FFA)含量增加,当肝脏摄取脂肪酸比例超过其分解及输出时,肝内甘油三酯(triglycerides,TG)堆积,从而导致肝脏脂肪变性.NAFLD患者较健康人群显示明显升高的循环FFA及肝内脂质沉积[10].微粒体甘油三酯转运蛋白(microsomal triglyceride transfer protein,MTP),存在于肝细胞、肠上皮细胞内质网及微粒体内的脂质转运蛋白[11],参与甘油三酯的转运及极低密度脂蛋白(very low density lipoprotein,VLDL)的装配与分泌[12].研究发现高脂饮食(high fat diet,HFD)喂养的NAFLD大鼠肝脏中MTP表达减少,导致肝内TG转运通路障碍,VLDL分泌减少,促进肝脏内TG沉积,从而导致肝细胞脂肪变性[13].HFD可通过ATP合成减少与线粒体DNA氧化损伤介导的氧化磷酸化缺陷[14]和肠道菌群改变与肠黏膜屏障功能障碍介导的全身慢性低度炎症反应[15]诱导NAFLD.同时,对NAFLD小鼠肝脏蛋白组学分析发现与脂肪酸β-氧化、脂肪酸转运及碳水化合物合成相关的蛋白表达增加,而与胆固醇合成及尿素循环相关的蛋白表达下调[16].基于以上原理构建HFD模型,即饮食配方中脂肪含量占比高(约占膳食总能量的30%-71%).经典HFD饮食由脂肪(71%),碳水化合物(11%)和蛋白质(18%)组成[17].Lau等[17]予C57BL/6小鼠HFD(45%)12 wk即出现肝脏脂质沉积和肝细胞脂肪变性等脂肪肝表现.而Eccleston等[18]予C57BL/6小鼠经典HFD(71%)16 wk,即出现IR、肥胖、脂变、气球样变、Mallory小体形成等非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)病理改变.Ichimura等[19]予SD大鼠9 wk HFD(30%)诱导轻度脂肪肝出现,18 wk时可见轻度炎症,无纤维化[20];而Lieber等[21]予SD大鼠经典HFD饮食3 wk即可表现脂变及小叶内炎症.因此,大鼠较小鼠能更快诱导NAFLD形成;同时,脂肪构成及比例不同,造模表现也有差异.反式脂肪酸较猪油诱导更严重的NAFLD病生及病理表现[22,23].饲喂HFD可观察到明显的肥胖和IR,模拟人类NAFLD的组织病理学和发病机制;但造模时间过长,肝组织炎症较轻,纤维化不易形成.Tian等[24]发现HFD饮食饲养的C57BL/6J小鼠在30 ℃热中性环境较22 ℃正常环境,能加速脂肪组织炎症的发展[25].Zarrinpar等[26]发现限制进食时间(夜间进食)可通过改善肠道菌群的周期性波动防止代谢性疾病的进展.因此,饲养环境、喂养方式等也会影响造模结果,实验期间应注意保证以上干扰因素的均衡一致性.
2 高胆固醇饮食诱导的NAFLD模型
大量研究表明,体内胆固醇代谢紊乱与NAFLD的发生发展有关.胆固醇在肝内转化为胆汁酸是胆固醇体内代谢的主要途径,当膳食胆固醇摄入增加或代谢减少时,肝内胆固醇堆积.过载的胆固醇可通过破坏线粒体谷胱甘肽的完整性和改变内质网质膜胆固醇-磷脂的比率来触发氧化应激与脂质过氧化[27].Qian等[28]予Wistar大鼠高胆固醇饮食(high cholesterol diet,HCD)(2%)6 wk即可诱导肝细胞脂肪变性.Matsuzawa等[29]予C57BL/6小鼠HCD(1.25%)12 wk可见肝细胞气球样变.Savard等[30]予C57BL/6小鼠HCD(1%)30 wk,表现出轻至中度大泡性脂变及轻度炎症,无纤维化形成,而体质量较对照组无明显变化.高胆盐(0.5%)的补充加重脂变及炎症的进展.综上,尽管高胆固醇模型能诱导肝脂变及炎症出现,但对体质量影响不显著,不能形成明显的肥胖及IR,用于模拟人类NAFLD病理生理变化存在一定局限性.
3 高脂高胆固醇饮食诱导的NAFLD模型
临床与动物实验关于高胆固醇饮食与动脉粥样硬化性心血管疾病关系的研究较为广泛,最近几项研究提出膳食胆固醇在人类与动物NAFLD中促进肝脏炎症和NASH进展[30-32].Serviddio等[33]予Wistar大鼠高脂(60%)高胆固醇(1.25%)饮食(high fat,high cholesterol diet,HFHC)6 wk即表现出肝内脂质沉积、肝指数及肝酶水平增加,同时伴大泡性脂变、重度肝细胞气球样变及弥漫性炎症浸润.Matsuzawa等[29]予C57BL/6小鼠高脂(60%)高胆固醇(1.25%)饮食24 wk可见肝细胞气球样变、炎症及纤维化.Savard等[30]发现HFHC饮食较HFD或HCD,表现出更高的体质量增加与肝脂质堆积、更明显的ALT升高和脂联素减少,脂肪组织与肝脏炎症更严重,同时出现一定程度窦周纤维化,与Matsuzawa等[29]观点一致.Savard等[30]认为膳食高胆固醇的补充通过减少胆汁酸的合成、VLDL的分泌及脂肪酸的β氧化从而促进肝内脂质超载.有学者提出胆固醇能通过Toll样受体(toll-like receptor,TLR)-4依赖性途径激活肝星状细胞引发纤维化[27].HFHC饮食模型,结合高脂与高胆固醇的优劣,既诱导肥胖与IR,又表现出脂变、炎症、纤维化等病理变化,同时与我们人类饮食习惯较为一致,较拟合人类NAFLD的疾病谱,在动物实验研究中应用最为广泛.
4 高果糖饮食诱导的NAFLD模型
既往流行病学及临床研究提示,NAFLD患者果糖摄入量高于健康对照组,且增加的果糖摄入量与肝细胞气球样变加重、肝脏炎症及纤维化形成相关[34].果糖的两个主要来源是蔗糖(由50%果糖和50%葡萄糖组成的二糖)和具有不同果糖含量的高果糖玉米糖浆[35].Bergheim等[36]予30%葡萄糖、果糖、蔗糖等不同糖水喂养C57BL/6小鼠,体质量仅在葡萄糖与蔗糖组明显增加,果糖组增加不明显,而表现出更多的肝内脂质沉积、更显著的脂质过氧化及更严重的炎症.同时只有果糖组显示门静脉内毒素水平高,他们认为果糖可通过增加细菌内毒素的肠易位促进4-羟基壬烯醛、ⅠκB及TNFα等细胞因子的表达.Schultz等[37]分析单纯高脂或高果糖以及两混合饮食对肝脏的影响,发现果糖在未导致肥胖的情况下仍能诱导血脂异常、IR、坏死性炎症等NASH表现.Nigro等[38]比较饱和脂肪和果糖对肝脏促炎及抗氧化反应的影响,发现果糖较饱和脂肪更快加速NAFL向NASH进展.以上研究提示高果糖摄入能促进NAFLD向NASH发展,同时诱导纤维化形成,需要注意该模型不能诱导明显肥胖出现,使其在肥胖型NAFLD动物模型中的运用受到限制.
5 高脂高果糖饮食诱导的NAFLD模型
膳食高脂与高果糖在NAFLD发生发展中的协同促进作用已得到广泛证实.果糖主要由果糖激酶代谢,果糖激酶存在两种亚型:果糖激酶C和果糖激酶A.果糖激酶C主要存在于肝脏中,是一种快速磷酸化剂,迅速消耗ATP[39],与果糖激酶A相比,与肝脂变关系更为密切[34].Ishimoto等[39]予野生及己酮糖激酶(KHK-A/C)敲除C57BL/6小鼠分别饲喂低脂(11%)、高脂(36%)、高脂高蔗糖(36%/30%)饮食15 wk,发现高糖的补充能加重高脂诱导的肝细胞脂肪变性,同时加速其向NASH及纤维化发展,并指出果糖主要依赖于果糖激酶而发挥以上作用.Kohli等[40]予C57BL/6小鼠HFD或高脂高果糖饮食(high fat,high fructose diet,HFHF)饮食,发现果糖消耗是肝脂质沉积向肝纤维化进展的必需环节,尽管体质量增加、IR与肝脂变程度在两组相似,但HFHF组小鼠表现出肝脏氧化应激增强、TGF-β与肝CD11b+F4/80+Gr1+巨噬细胞数增加以及胶原沉积增多.同时还指出不同剂型果糖与不同类别脂肪酸的组合将产生不同的肝损结果.Tsuchiya等[41]予C57BL/6小鼠HFHF饮食2 wk时即发现肝脏铁含量及氧化应激的增加,早于4 wk时出现的肝内脂质沉积与肝脂变,认为HFHF饮食导致的肝铁离子超载可能与肝脂肪变性和IR相关.以上研究提示HFHF协同促进NAFLD的发生发展,且较高脂模型能更快诱导肝纤维化出现且纤维化程度更重,表明果糖是促进纤维化形成的启动因子.Liu等[42]发现喂食野生型TLR4(C3H/HeN WT)小鼠HFHF饮食4 wk、8 wk和16 wk依次出现单纯脂肪变性,脂肪性肝炎和肝纤维化.因此运用该模型时需密切关注造模时间,准确掌握药物干预时机,避免造模时间过长导致肝损程度过重从而影响早期干预效果.
6 高脂高胆固醇高果糖饮食诱导的NAFLD模型
西方饮食或快餐饮食,由脂肪、胆固醇及果糖组成,被认为是导致肥胖的危险因素.Kanuri等[43]以高脂(25%)高胆固醇(0.2%)高果糖(50%)饮食喂养C57BL/6小鼠6 wk即出现肝细胞脂肪变性、内毒素水平增加及明显炎症反应.Charlton等[44]予C57BL/6小鼠快餐饮食(40%脂肪+2%胆固醇+果糖)6 mo,表现出肥胖、IR、内质网氧化应激、明显气球样变与炎症以及进展性纤维化.高脂高胆固醇高果糖饮食,现代都市人群喜食膨化食品和喜饮碳酸饮料的体现,模拟西方饮食结构,诱导肥胖与IR出现的同时,较前几种模型诱导炎症与纤维化出现的时间更短、更迅速,范围更广、更严重.运用该模型探索NAFLD的发病机制显示出较好的优势,但用于寻找药物治疗靶点时应严格把握饲喂时间,避免造模时间过长导致的不可逆性肝损害.
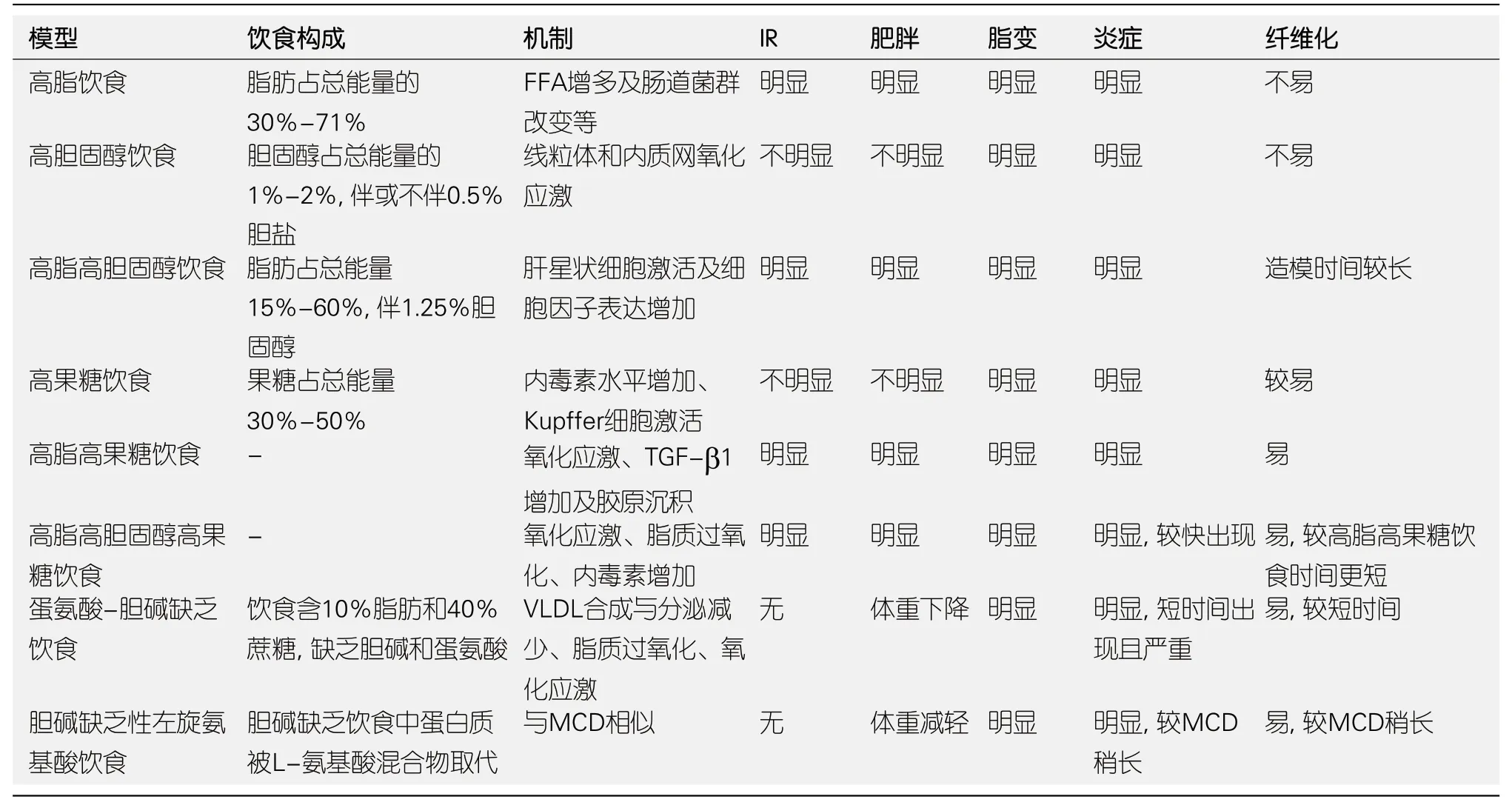
表1 非酒精性脂肪性肝病饮食动物模型
7 蛋氨酸-胆碱缺乏饮食诱导的NAFLD模型
基于“二次打击”学说,蛋氨酸-胆碱缺乏饮食(methionine and choline deficient diet,MCD)模型已被广泛用于NASH与纤维化等NAFLD严重表型的研究.MCD饮食包含蔗糖(40%)与脂肪(10%),但缺乏蛋氨酸与胆碱.蛋氨酸与胆碱是磷脂酰胆碱的前体[12],作为合成VLDL的原料,饮食蛋氨酸与胆碱的缺乏将影响VLDL的合成与分泌,从而导致肝内脂质堆积、脂质过氧化、肝脂肪变性、氧化应激损伤、坏死性炎症等.Sahai等[45]以MCD喂养A/J小鼠,1 wk即出现肝脂变,2 wk即可见炎症,8 wk时纤维化已形成.Weltman等[46]以MCD喂养Wistar大鼠,4 wk即出现大泡性脂变与炎症浸润.与其他饮食模型相比,在相同喂养时间内,MCD喂养SD大鼠[47]、Wistar大鼠[48]或C57BL/6小鼠[49]表现出更高水平的ALT与细胞因子数,更严重的脂变、气球样变、炎症坏死及纤维化,更活跃的内质网及线粒体氧化应激.且不同物种、种系[43]及性别[50]对MCD的反应也不同.MCD模型诱导NAFLD演变进展较高脂或其它模型更快更严重,且更能模仿人类严重的NASH的病理学改变[17].然而,MCD模型虽在短时间内即可诱导NASH等严重表型的出现,但尚未表现外周IR及肥胖[51],反而出现严重体质量下降、恶病质及低血清胰岛素、瘦素和甘油三酯水平,与人类NAFLD代谢谱明显不同,因此该模型的应用存在一定程度局限性,当前主要用于NASH炎症与纤维化形成机制的探讨与治疗药物的筛选研究.
8 胆碱缺乏性左旋氨基酸饮食诱导的NAFLD模型
胆碱缺乏性左旋氨基酸(choline-Deficient l-Amino-Defined Diet,CDAA)饮食与MCD饮食相似,均缺乏胆碱;与胆碱缺乏饮食除蛋白质被等量L-氨基酸混合物取代外,其余总体组成相同[52].CDAA饮食可诱导小鼠形成肝细胞脂变、炎症及纤维化,所需时间较MCD饮食稍长[53].与MCD饮食相似,CDAA饮食喂养的小鼠不能出现IR与肥胖[54],因此,用于研究代谢性特征尚存在缺陷.遂有学者提出CDAA饮食与HFD饮食结合的高脂型CDAA饮食,然而,HFD的添加仍未诱导C57BL/6J和A/J两种小鼠出现代谢相关特征,但发现6 wk即可诱导C57BL/6J纤维化形成[55].此外,长时间的CDAA饮食可用于构建肝脏恶性肿瘤模型[56](表1).
9 结论
基于膳食结构对NAFLD的影响,本文主要探讨饮食诱导的NAFLD模型,包括高脂、高胆固醇、高果糖以及MCD.构建单纯脂肪肝模型,高脂或高胆固醇饮食尚可,而NASH及肝纤维化等模型的建立,尚需考虑胆固醇、果糖和胆碱或MCD.上述饮食动物模型尚不能单独用于模拟完整的NAFLD疾病发展谱,因在不同生理或病理方面各模型间各有优势,优劣互补,对探索NAFLD的发病机制及寻找药物治疗靶点仍具有重要指导意义.同时,尚需关注造模时间、动物种系等因素的影响.不同实验设计方案下针对性地选择最合适的动物模型用于NAFLD发病机制与药物靶点的研究至关重要.
