小鼠脾淋巴细胞对人HepG2细胞杀伤活性检测方法的建立
2019-07-15陈丽玲钟友宝袁可望黄丽婷李姗姗
陈丽玲, 钟友宝, 刘 漩, 陈 来, 袁可望, 黄丽婷, 李姗姗
(江西中医药大学, 南昌 330004)
从动物模型与临床实际肿瘤的相近性而言, 现有肿瘤动物模型中, 人肿瘤的异种移植模型是最具有应用价值和前景的。而现有成熟的以免疫缺陷动物作为载体的人源肿瘤模型存在短板: 无胸腺裸小鼠的T细胞生成障碍导致其无法用于移植肿瘤与特异性免疫系统相互作用的研究[1,2]。因此, 建立既能保留人源肿瘤生物学特性, 又具有正常免疫功能的动物模型是肿瘤研究, 尤其是肿瘤免疫研究急需解决的问题。我们拟利用“获得性免疫耐受”的机制, 即“在胚胎时期, 体内已有的针对多种抗原具有免疫活性的淋巴细胞克隆, 若与某种抗原(包括自身的或人工导入的) 相遇, 与其对应的淋巴细胞克隆即被破坏或抑制,出生后只对胚胎期曾接触过的抗原形成耐受, 而对胚胎时期从未接触过的抗原仍有免疫应答[3]”, 在具有完善免疫系统的KM小鼠基础上, 建立适用于人来源的、且免疫功能相对正常的人肿瘤异种移植动物模型, 以达到为肿瘤研究, 尤其是肿瘤免疫研究提供新的临床前研究模型的目的。在模型建立初期, 我们拟向孕鼠子宫内的胎鼠注射人肝癌HepG2细胞, 之后在成功出生且存活的胎鼠肝脏原位移植人肝癌HepG2细胞, 评价成瘤效果, 并考察荷瘤小鼠的免疫功能和对HepG2细胞及其他人肿瘤瘤株的排斥情况。在考察小鼠脾淋巴细胞对人肝癌HepG2细胞杀伤作用的过程中, 计划检测样本量较大, 因此需要建立一种操作方便、快速的检测方法。目前经常使用的细胞杀伤活性检测方法中, 经典的51Cr释放法存在自然释放率较高、放射性会对细胞及操作人员造成伤害等不足; 乳酸脱氢酶(LDH)释放法因影响因素较多和背景信号的干扰等问题, 应用有限[4]; 酶联免疫斑点(Enzyme-linked immunospot, ELISPOT)检测技术、主要组织相容性复合体(Major histocompatibility complex, MHC)四聚体显示T细胞受体的染色技术和胞内细胞因子染色等技术, 只能通过间接检测T细胞表面受体或细胞因子的水平反应细胞毒性T 淋巴细胞(Cytotoxic T lymphocytes, CTL)活性[5]。
羧基荧光素二乙酸盐琥珀酰亚胺酯(Carboxyfluorescein diacetate succinimidyl ester,CFSE)是一种本身不发荧光的活体染料,它可穿透细胞膜,被胞内酯酶转化成具有绿色荧光的氨基反应性羧基荧光素琥珀酰亚胺酯,同时失去自由透过细胞的能力,可稳定标示活细胞[6-8]。碘化丙啶(Propidium iodide,PI)是一种可对DNA染色的细胞核染色试剂, 其不能通过活细胞膜,但却能穿过破损的细胞膜,嵌入双链DNA后释放红色荧光。在效应细胞与靶细胞混合前,先将靶细胞用CFSE染色, 染色后的靶细胞与效应细胞混合作用后,再用PI染色,采用流式细胞术即可区分被杀伤靶细胞及存活靶细胞,并体现效应细胞的死亡情况,测定效应细胞对靶细胞的杀伤活性, 且检测速度较快。
本实验拟建立基于流式细胞术的评价小鼠脾淋巴细胞对人HepG2细胞杀伤活性的方法,以准确检测模型小鼠脾细胞对人肿瘤细胞的杀伤作用。
1 材料与方法
1.1 实验动物
SPF级KM小鼠,4周龄,体质量18~22 g,购于湖南斯莱克景达实验动物有限公司[SCXK(湘)2013-0004]。饲养于江西中医药大学实验动物科技中心[SYXK(赣)2017-0004]。实验获得江西中医药大学实验动物伦理委员会的批准(伦理审查证号:JZLLSC207-0021),并按实验动物使用的3R原则给予人道主义关怀。
1.2 细胞株
人肝癌HepG2细胞由江西中医药大学中药资源与民族药研究中心惠赠(购自中国科学院上海细胞库)。
1.3 药品及主要试剂
CFSE(批号为S8269)购自美国Selleck生物科技有限公司; PI(批号为2018/12)购自合肥新恩源生物技术有限公司; 磷酸缓冲盐溶液(phosphate buffer saline,PBS)(批号为20171108)、DMEM高糖培养基(含双抗,青霉素100 U/mL,链霉素100 μg/mL)(批号为20170812)和胎牛血清(批号为RY3201)均购自天津市灏洋生物制品科技有限责任公司; 红细胞裂解液(批号为20170731)、胰蛋白酶(批号为T1300)和台盼蓝染液(批号为: 20161122)均购自北京索莱宝科技有限公司。
1.4 主要仪器
CO2培养箱(型号为C150)购自德国宾德有限责任公司,流式细胞仪(型号为FACSVerse)购自美国BD医疗器械有限公司。
1.5 实验方法
1.5.1 靶细胞人肝癌HepG2细胞的培养 人肝癌HepG2细胞置于含体积分数10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的DMEM高糖培养基中,移入CO2培养箱,于37 ℃、体积分数5% CO2及饱和湿度条件下培养。
1.5.2 效应细胞小鼠脾淋巴细胞的制备 摘眼球取血后,将小鼠浸泡在体积分数75%乙醇中3 min,移至超净台中无菌取脾脏,开左侧腹部皮肤,分离皮下组织和肌肉,暴露并小心分离脾脏, 放入预冷PBS中。将脾脏置于200目不锈钢网上,用注射器内芯头研磨成单细胞,收集后1 000 r/min离心5 min, 弃上清, 加入3倍量红细胞裂解液, 4 ℃静置15 min, 其间轻轻涡旋混匀2次, 1 000 r/min离心10min, 弃上清, 预冷PBS冲洗, 含10%胎牛血清的DMEM高糖培养基调整细胞悬液至不同浓度备用[18]。
1.5.3 靶细胞人肝癌HepG2细胞的标记
1.5.3 .1 CFSE及PI 对靶细胞的区分效果 6孔板接种HepG2细胞,贴壁,至汇合度约为80%,用5 μmol/mL的CFSE标记10 min, PBS洗1次, 加入含10%胎牛血清的DMEM高糖培养基及无水乙醇,使无水乙醇的终浓度分别为0.4 mol/L、0.8 mol/L、1.6 mol/L[9], 培养6 h后, 收集细胞, PBS冲洗,加入PI至终浓度为12.5 μg/mL,上流式细胞仪检测。
1.5.3 .2 CFSE标记对人肝癌HepG2细胞的毒性 24孔板接种HepG2细胞,贴壁,至汇合度约为80%,分别以2.5 μmol/mL、5.0 μmol/mL、10 μmol/mL的CFSE标记10 min,每隔1 h收集细胞,PBS冲洗,加入PI至终浓度为12.5 μg/mL,上流式细胞仪检测细胞存活率,至第18 h结束。未经CFSE标记的细胞作为对照。
1.5.3 .3 CFSE标记人肝癌HepG2细胞荧光强度的时间动力学分析 24孔板接种HepG2细胞, 贴壁, 至汇合度约为80%, 分别以2.5 μmol/mL、5.0 μmol/mL、10 μmol/mL的CFSE标记10 min,每隔1 h收集细胞,PBS冲洗,上流式细胞仪检测荧光值(Median fluorescent intensity,MFI),至18 h结束。
1.5.4 CFSE及PI对效靶细胞的区分效果 24孔板接种HepG2细胞,贴壁,至汇合度约为80%,此时HepG2细胞数约为4×105/孔。以2.5 μmol/mL的CFSE标记10 min,PBS洗1次,加入1 mL浓度为4×106/mL的小鼠脾淋巴细胞悬液,以效靶比10∶1作用6 h,收集细胞,PBS冲洗,加入PI至终浓度为12.5 μg/mL,上流式细胞仪检测。
1.5.5 效靶作用时间及效靶比对试验结果的影响24孔板接种HepG2细胞,贴壁,至汇合度约为80%,此时HepG2细胞数约为4×105/孔。以2.5 μmol/mL的CFSE标记10 min,PBS洗1次,分别加入1mL浓度为2×106/mL、4×106/mL、8×106/mL、1.6×107/mL、3.2×107/mL、4×107/mL的小鼠脾淋巴细胞悬液,以效靶比5∶1、10∶1、20∶1、40∶1、80∶1、100∶1分别作用6 h、12 h和18 h,收集细胞,PBS冲洗,加入PI至终浓度为12.5 μg/mL,上流式细胞仪检测细胞的存活率,并按下式计算杀伤率。
杀伤率(%)=(阴性对照靶细胞存活率-试验组靶细胞存活率)/阴性对照靶细胞存活率×100%
1.6 统计学处理
2 结果
2.1 CFSE标记对人肝癌HepG2细胞的作用
2.1.1 CFSE 及PI 对靶细胞的区分效果 流式细胞术检测结果表明, 采用CFSE/PI 双标记能有效分离各组群: CFSE+PI-、CFSE+PI+、CFSE-PI+、CFSE-PI-,其中CFSE+PI-为未被乙醇杀伤的靶细胞,CFSE+PI+为被乙醇杀伤的靶细胞,CFSE-PI+为CFSE标记前死亡的效应细胞。随着无水乙醇的浓度逐渐增加,CFSE+PI+细胞,即被乙醇杀伤的靶细胞的比例逐渐增加(图1)。
2.1.2 CFSE 标记人肝癌HepG2细胞的毒性 流式细胞术检测结果表明,1~18 h,各浓度CFSE标记的人肝癌HepG2细胞的存活率无明显下降,表明在18 h以内,CFSE对人肝癌HepG2细胞的存活无明显影响(图2)。
2.1.3 CFSE 标记人肝癌HepG2细胞荧光强度的时间动力学 流式细胞术检测结果表明,1~18h,随着时间的推移,各浓度CFSE标记的人肝癌HepG2细胞的MFI值均逐渐下降, 6 h后趋于稳定,12 h后又有较小范围波动。在6~12 h,以2.5μmol/mL和5.0 μmol/mL的CFSE标记后的MFI值更为稳定(图3),表明后续测定细胞杀伤活性时,效应细胞和靶细胞的作用时间以6~12 h为宜。
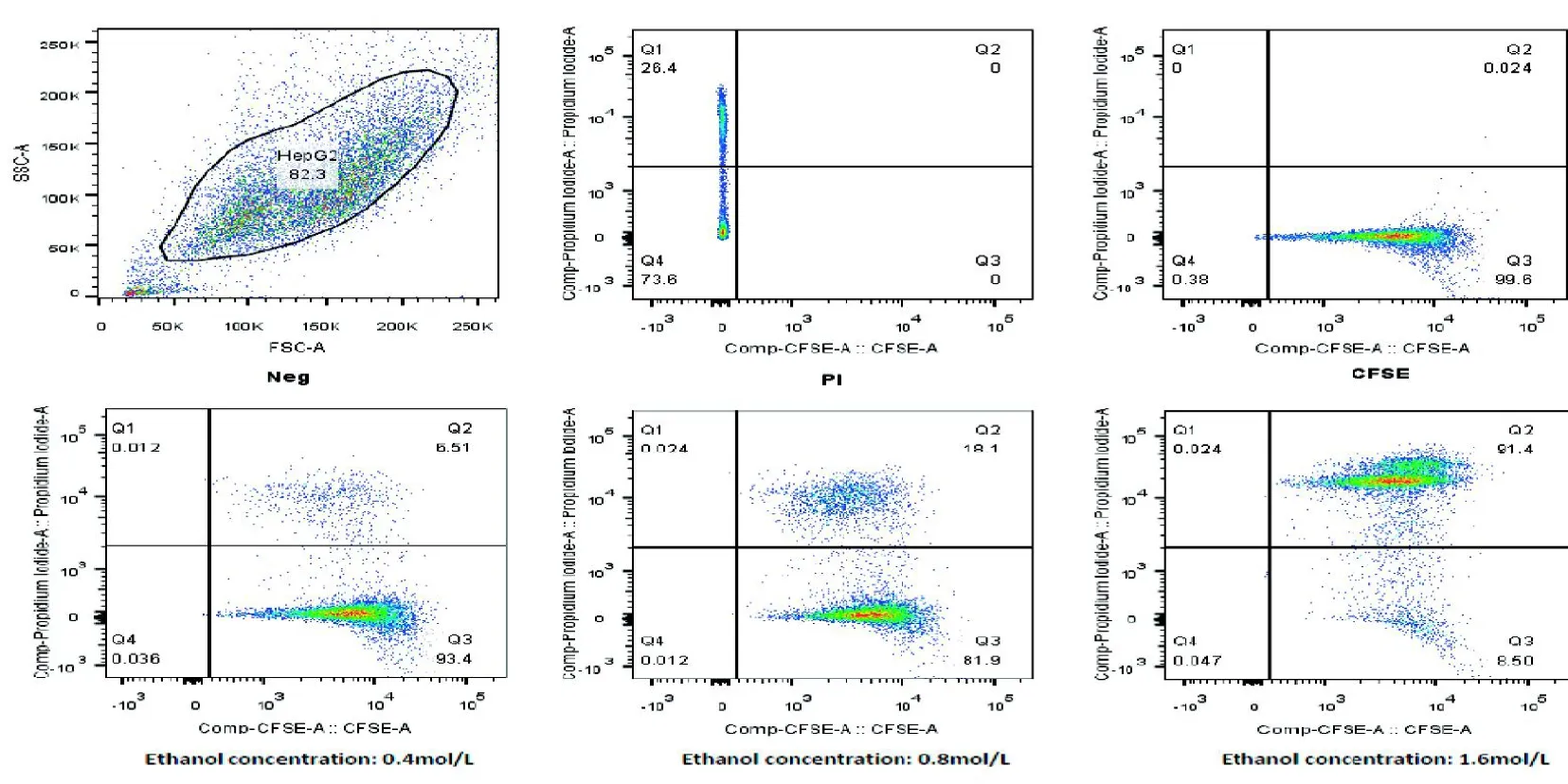
图1 CFSE 及PI 对靶细胞区分效果Figure 1 The differentiating effect of CFSE and PI on target cells

图2 CFSE对人HepG2细胞的毒性Figure 2 The cytotoxicity of CFSE to human HepG2 cells
2.2 CFSE 及PI 对效靶细胞的区分效果
流式细胞术检测结果表明,采用CFSE/PI 双标记能有效分离杀伤实验所需各组群:CFSE+PI-、CFSE+PI+、CFSE-PI+、CFSE-PI-,其中 CFSE+PI-为未被杀伤的靶细胞,CFSE+PI+为被杀伤的靶细胞,CFSE-PI+为效靶相互作用过程中死亡的效应细胞和CFSE标记前死亡的效应细胞,CFSE-PI-为效靶相互作用过程中存活的效应细胞(图4)。
2.3 效靶作用时间及效靶比对试验结果的影响
流式细胞术检测结果表明,效靶比在5∶1至40∶1时,效靶作用时间为12 h的细胞杀伤率较18 h及6 h高; 效靶比在40∶1以上时,则杀伤率随效靶作用时间的延长而增加。其中效靶比为10∶1时,效靶作用时间为12 h与作用时间为6 h的杀伤率相比有极显著性差异(P<0.01),效靶比为100∶1时,效靶作用时间为12 h与作用时间为6 h的杀伤率相比有显著性差异(P<0.05)(表1)。
效靶作用时间相同时,细胞杀伤率总体随效靶比的增加而增加,但效靶比在10∶1至80∶1间无显著性差异,直至效靶比上升至100∶1时,杀伤率才有明显增加: 效靶作用时间为12 h时,效靶比100∶1与10∶1相比有显著性差异(P<0.05),效靶作用时间为6h时,效靶比100∶1与10∶1相比有极显著性差异(P<0.01)(表1)。

图3 CFSE对人HepG2细胞荧光强度的时间动力学曲线Figure 3 The time dynamics of fluorescent density of CFSE-labeled human HepG2 cells
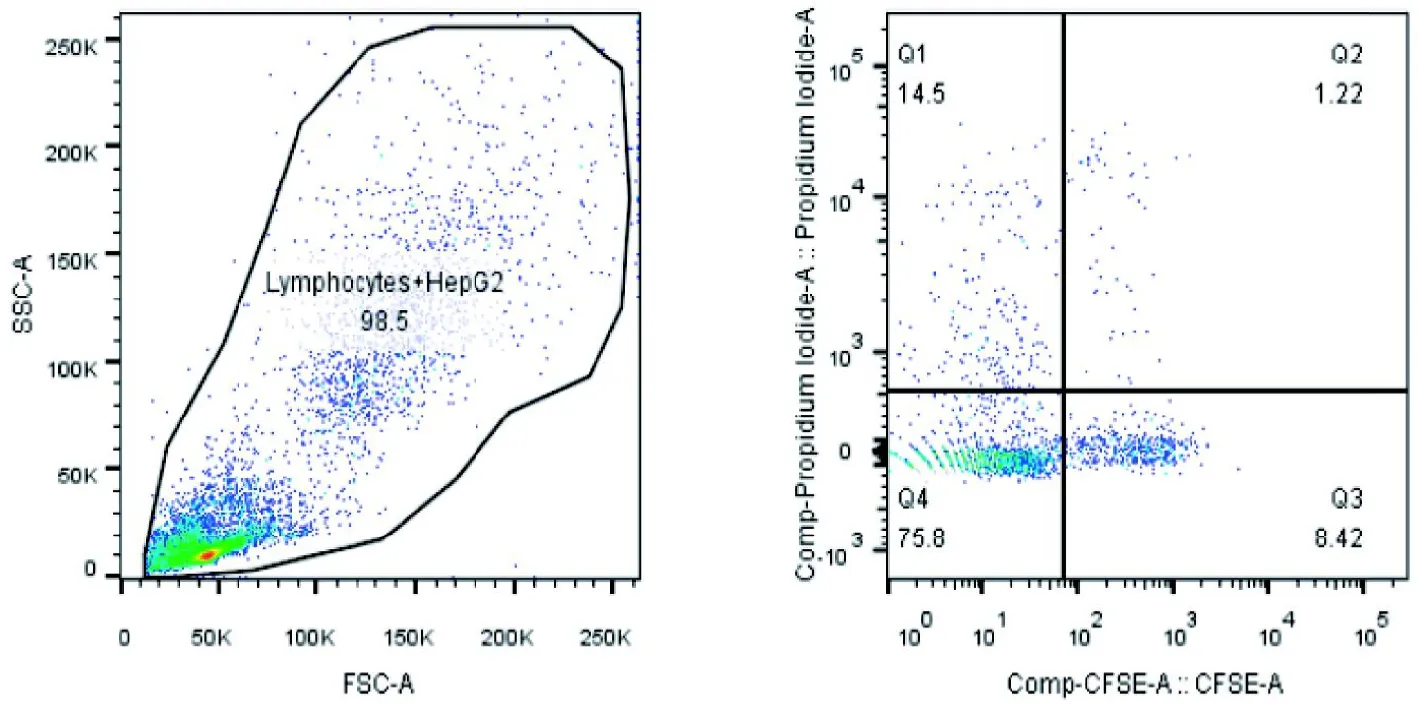
图4 CFSE 及PI 对效靶细胞区分效果Figure 4 The differentiating effect of CFSE and PI on effector cells and target cells

表1 效靶作用时间及效靶比对细胞杀伤率的影响Table 1 The effect of action time between effector and target cells and the effector to target cell ratios on the specific cellular killing activity %
3 讨论
在建立既能保留人体肿瘤生物学特性,且免疫功能相对正常的人肿瘤异种移植动物模型的过程中,我们需要找到一种方便操作的检测小鼠脾细胞对人肿瘤细胞杀伤作用的方法以应对较大的检测需求[10]。经典的51Cr释放法、LDH释放法、ELISPOT技术和MHC四聚体染色等技术由于各种原因,不能完全满足本实验对杀伤作用检测的要求。
流式细胞术是利用流式细胞仪进行的一种高速单细胞定量分析和分选技术,能对检测的每个细胞进行多个参数的检测。本实验通过采用适当的不同荧光染料,即可有效区分多种细胞及其存活状态,而流式细胞术这种基于单细胞水平上的检测手段也保证了多种细胞共检测时各种细胞间数量差距较大时检测的准确性和可靠性。
本文对流式细胞术检测小鼠脾细胞对人HepG2细胞杀伤活性的方法进行了初步的标准化探讨:CFSE和PI双染可有效区分各细胞群,实验中采用的各浓度CFSE对人肝癌HepG2细胞未见明显毒性。CFSE 标记人肝癌HepG2细胞荧光强度的时间动力学分析表明,2.5 μmol/mL和5.0 μmol/mL的CFSE标记的MFI值在6~12 h更为稳定, 且效靶作用时间为12 h的杀伤率较6 h高, 所以确定效靶作用时间为12 h。在对效靶比的考察中,结果表明10∶1和100∶1为适宜效靶比, 但考虑在模型建立过程中, 需对新生小鼠的脾细胞进行特异杀伤活性检测, 可能存在采集的脾细胞数量较少的情况, 故确定效靶比为10∶1。最终确定的实验方法为: 24孔板接种HepG2细胞, 贴壁, 至细胞汇合度约80%时, 以2.5 μmol/mL的CFSE标记10 min, PBS洗1次, 加入含10%胎牛血清DMEM高糖培养基调整浓度的小鼠脾淋巴细胞悬液, 以效靶比10∶1相互作用12 h, 收集细胞, PBS冲洗, 加入PI至终浓度为12.5 μg/mL,上流式细胞仪检测细胞的存活率, 并计算杀伤率。
本方法可有效、精确评价小鼠脾淋巴细胞对人肝癌HepG2细胞的杀伤作用,为后续模型的建立打下了基础。
