基因修饰家兔研究进展
2019-07-15范江霖刘恩岐
薛 莹 , 范江霖, 刘恩岐
(1. 西安交通大学医学部实验动物中心, 西安 710061;2. 西安交通大学心血管研究中心, 西安 710061;3. 日本山梨大学医学部分子病理学系, 日本山梨 409-3898)
家兔(Oryctolagus cuniculus)是最常用的实验动物之一, 由于其体型大小适中、繁殖周期短、容易进行各种手术,因而被广泛用于生物医学研究[1]。家兔对高胆固醇饮食敏感,是第一个用于研究人类动脉粥样硬化的动物模型[2]。由于心脏肌原纤维蛋白(sarcomeric protein)组成与人类相似,家兔也用于研究人类心肌疾病发病机理[3]。与其他体型较大的实验动物(如,猪、犬、非人灵长类动物)相比,家兔价格低廉,而且容易培育成无特定病原体(SPF)和近交系家兔。另外,家兔在进化上比啮齿类动物更接近人类[4],家兔也有足够血容量(100~150 mL/成年兔)来完成多个生化分析和反复测试[1]。
自1980年起,基因修饰(genetically modified,GM)动物研究和应用发展迅速。1985年,首例利用显微注射技术制作成功转基因家兔[5]。然而,直到1990年代,才开始使用转基因家兔研究脂蛋白代谢、动脉粥样硬化和肥厚性心肌病(hypertrophic cardiomyopathy, HCM)等,GM家兔人类疾病模型进入新时代[1]。
作为人类疾病动物模型,GM家兔显得尤为珍贵。因为家兔是介于小型啮齿动物类实验动物(如,小鼠和大鼠)和大型哺乳动物(如,犬和家畜)之间的重要物种,不仅可以作为实验动物模型来研究一些人类特定的疾病,而且可以作为生物反应器(bioreactor)生产用于实验或医药工业的重组蛋白(recombinant proteins)[6]。
基于我们在GM家兔制作、应用研究中一些体会,本文将简要描述GM家兔制作基本过程、讨论GM家兔模型在生物医学领域的应用价值,以期为大家介绍GM家兔作为人类疾病模型最新进展。
1 GM家兔培育历史
GM动物是指对动物基因进行人为修饰并且这种修饰可以稳定遗传的一类动物品系,包括转基因(transgenic)、基因敲除(knock-out, KO)、基因敲入(knock-in, KI)和敲低(knock-down)动物。
1980年,Gordon等利用DNA显微注射技术培育了世界上第一个转基因小鼠[7]。1985年,更大体型的转基因哺乳动物(包括家兔、绵羊、猪)也被制作出来[5]。体型较大的转基因动物具有特定的价值,不仅可以用作人类疾病动物模型,还可以作为生物反应器(如家兔、山羊、猪和牛)生产药用重组蛋白[6]。1980年代后期,两个实验独立地将一个突变体次黄嘌呤磷酸核糖转移酶(hypoxanthine phosphoribosyltransferase)基因导入到小鼠胚胎干细胞(embryonic stem cell, ES细胞), 再将被修饰ES细胞注射到囊胚培育成功KO小鼠[8,9]。核糖核酸干扰(RNA interference, RNAi)是一种内源性基因沉默机制, 通过双链RNA序列介导mRNA降解原理,使用RNAi技术获得ski基因敲低小鼠[10],表型与KO小鼠类似,使得利用RNAi技术构建基因敲低家兔成为可能。近年来, 随着锌指核酸酶(zinc-finger nucleases, ZFNs)、转录激活因子样效应物核酸酶(transcription-activator like effector nucleases, TALENs)和RNA介导的规律成簇间隔短回文重复(clustered regularly interspaced short palindromic repeats,CRISPR)/Cas9等基因操作技术的诞生, 为培育新一代KO家兔模型提供了新契机。已经证实, 利用ZFNs、TALENs技术、特别是CRISPR/Cas9基因组编辑技术培育KO家兔模型是可行的。如,Flisikowska等[11]采用ZFNs技术敲除了家兔IgM, 赖良学课题组[12,13]用ZFNs、TALENs技术分别敲除了家兔apoCIII、RAG 1和RAG 2基因, 建立了一个高效CRISPR/Cas9系统, 同时敲除了家兔CD36、LDLR, RyR2和apoE等4个基因[14]。
1985年,世界上第一例转基因家兔模型培育成功,该转基因家兔表达人生长激素基因[5]。在开始培育GM家兔时,虽然蛋白质表达水平低、外源基因无功能或作用,但这些最初研究却为利用GM家兔作为替代模型研究人类疾病(如, 代谢疾病、动脉粥样硬化、HCM等)奠定了基础[15]。
2 GM家兔模型建立
2.1 转基因家兔
常规转基因家兔培育方法包括显微注射法、转基因ES细胞囊胚注射法、基因转移到精子和卵母细胞、转染体细胞核移植以及病毒介导转基因技术等, 这些方法在我们以前的文献已有详细阐述[1,16],这里不再赘述。DNA原核显微注射是制作转基因家兔最成功、也最常用方法。
利用显微注射方法制作转基因家兔与同样方法制作转基因小鼠过程相似,差异之处在于家兔受精卵直径约为小鼠受精卵的2倍,但原核大小相似,家兔受精卵有一个厚厚的透明带,家兔细胞核对外源DNA的纯度似乎更敏感[1]。转基因家兔培育不仅耗时, 而且受很多条件限制。首先, 外源DNA制备、供体胚胎产量、注射后胚胎存活率、妊娠率、产仔数等都是非常重要影响因素, 这些因素容易人为控制和改进[17]。其次, 人们对转基因家兔阳性率、嵌合体(mosaic)、外源基因不表达以及异位表达(ectopic expression)缺乏足够的了解, 影响制作效率[18]。根据我们的经验, 通过原核显微注射DNA培育转基因家兔效率(转基因仔兔数/总仔兔数)在0.5%~5%[19-24]。也有人[25]提出雌、雄原核同时注射外源DNA可以增加转基因兔的生产效率,但有待进一步验证。总体来说,利用显微注射方法制作转基因家兔方法自诞生以来,没有大的改进,对影响家兔转基因效率的因素缺乏系统研究[1]。
“睡美人”(sleeping beauty, SB)转座子(transposons)是第一个证明能够在脊椎动物细胞中有效换位的转座子, SB转座子基因传递具有许多优点,如,简单、安全、廉价、受体基因永久插入,还可以转更大、更复杂的外源基因。SB转座子原核显微注射法成为转基因家兔构建的新方法[26]。
除了上述方法,也可通过精子介导法培育转基因家兔[27-29],逆转录病毒载体介导的转基因方法也有报道[30]。精子和逆转录病毒载体介导的基因转移似乎比显微注射更容易、更有效,但是,这些技术仅仅被应用于方法验证上,在人类疾病GM家兔模型建立和研究上还未见其应用。
2002年,利用体细胞核移植技术获得第一只克隆家兔[31],此后,李善刚等[32]也成功克隆了家兔,但克隆效率偏低,需要提高家兔核移植效率[33-35],以利通过体细胞核移植培育转基因和KO家兔[36-39]。
2.2 KO和KI家兔
1980年代初,由于ES细胞分离、培养成功,使得利用其制作KO动物模型成为可能。ES细胞来自囊胚内细胞团,具有分化成各个组织的能力,但在体外可以保持不分化。根据同源重组的原理,利用分子生物学和组织培养技术可以定点敲除ES细胞中一个感兴趣的基因,构建一个修饰后的ES细胞,然后将ES细胞注入早期胚胎的囊胚腔中,胚胎移植,可以获得嵌合体子代动物。经过修饰的ES细胞有可能分化成精子或卵子,修饰后的DNA则被传递到下一代[40]。1987年,KO小鼠培育成功[8]。小鼠、大鼠、绵羊、山羊、猪和牛等动物的ES或ES样细胞已经分离培养成功,然而,除了小鼠和大鼠外,目前还没有其他物种ES细胞可以稳定传代的报告,因此,利用ES细胞打靶突变培育KO动物仅仅局限于小鼠。显然, 依靠ES细胞获得KO家兔是不可能的。1998年,科学家们发现在动物细胞内存在一种基因表达调节机制,称为RNAi (RNA interference)。利用RNAi技术已经成功培育基因敲低小鼠模型[10],因此利用该技术制作基因敲低家兔模型理论上也是可行的[41]。
近年来,一些新的、具有划时代意义的DNA编辑工具出现,可以完全不依赖于ES细胞而实现基因特异性敲除。依靠特定核酸酶识别特定DNA序列,然后像“分子剪刀”(molecular scissors)一样在动物基因组中产生高效的双链断裂(doublestrand breaks, DSB), 使靶基因功能性消失或用于基因组DNA序列特定位点的整合。ZFNs、TALENs和CRISPR-Cas9正是基于以上原理发展起来并带来革命性变化的新技术[40,41]。
ZFNs由两部分组成, 首先是3~6个Cys2-His2锌指蛋白串联组成的DNA识别域, 另一部分是非特异性的核酸内切酶FokI的催化结构域。通过DNA识别域识别特定DNA序列后将催化结构域定位到目标位点从而通过核酸内切酶的作用切断DNA形成双链断裂, 通过非同源末端连接(non homology end joining, NHEJ)进行基因突变[41]。Flisikowska 等[11]设计了两对针对家兔IgM外显子1和2的ZFNs, 并将构建好的ZFNs基因显微注射到家兔受精卵原核,成功抑制了家兔IgM基因。Yang等[12]在研究中将ZFNs mRNA、家兔靶向apo-CIII基因注射于对家兔受精卵胞质中,发现ZFNs是产生KO家兔的有效方法。由于ZFNs采用较短的识别序列以及专利保护等导致ZFNs在靶序列选择和应用上受到限制。将效应子蛋白与FokI核酸酶催化域融合表达产生TALENs,通过分别识别靶位点上下游序列两条TALENs将其定位至特定基因靶位点,酶切产生DSB,诱发NHEJ导致基因插入或删除突变,从而制作出KO动物,是TALENs技术基本原理[41]。Song等[13]设计了一对针对家兔RAG基因第1、2外显子TALENs, 通过胚胎显微注射TALENs mRNA,成功地获得RAG KO家兔模型。CRISPR位点是由一串连续排列的短指向性重复序列中间夹杂一些短间隔序列(spacer), CRISPR通过产生RNA(CRISPR-derived RNA, crRNA)与CRISPR-associated protein(CRISPR/Cas9)相结合形成识别催化结构,可识别基因组特定DNA序列并切除。基于CRISPR/Cas9原理,研究者们设计了一套用于GM编辑的工具,利用single guide RNA(sgRNA)代替互补的crRNA,与Cas9一起发挥作用产生DSB。利用CRISPR/Cas9系统,研究者已经成功在多种哺乳动物(包括非人灵长类)中实现了基因突变, 在Cas9和gRNA共同作用下成功诱导特异性DNA识别、产生DSB、诱导NHEJ发生[41]。Yang等[14]利用该技术同时敲除4个基因位点(CD36,LDLR,RyR2,apoE),是使用CRISPR/Cas9构建KO家兔的第一例成功报道。
CRISPR/Cas9、ZFNs和TALENs在制作KO动物效率上差距并不明显,但CRISPR/Cas9基因编辑系统更加简单、高效,成为动物基因编辑最常用工具,而ZFNs和TALENs鲜有应用[40]。CRISPR/Cas9基因编辑系统虽然提高了KO及定点修饰(如,定点突变、基因插入)的效率, 但是基于同源重组机制的基因定点突变效率仍然较低。2016 年, Komor等[42]报告了一种新的单碱基编辑系统,利用该系统可以在不产生双链DNA断裂的情况下,利用sgRNA将 Cas9-胞嘧啶脱氨酶-尿嘧啶糖基化酶抑制子三者构成的融合蛋白,sgRNA 通过与靶位点互补配对,引导融合蛋白结合到靶位点发挥作用。融合蛋白中的胞嘧啶脱氨酶能够使非互补链中相应的胞嘧啶C经脱氨基作用转变为尿嘧啶U,而 DNA复制进一步使得U被T代替,而互补链上原来与C互补的碱基鸟嘌呤G将会变成腺嘌呤A,而尿嘧啶糖基化酶抑制子则能够抑制U的切除,最终实现非互补链上的C替换为T和互补链上G替换为A的精确编辑。基于该技术,赖良学团队[43]建立了一个高效单碱基编辑系统,在国际上率先在家兔上改变单个碱基, 精确地模拟出人类单碱基突变遗传病中的无义突变、错义突变和RNA错误剪切, 成功培育出白化病、早衰症、双肌臀等疾病模型兔。
很显然,得益于新近发展的DNA编辑技术(特别是CRISPR/Cas9),不依靠ES细胞也可以轻易制作KO、KI家兔模型,用于生物医学研究。可以预见,在不久的将来,依靠这些新技术,组织特异性KO家兔模型也将培育成功,大大丰富GM家兔模型资源。
3 GM家兔在心血管研究中应用
采用我们曾经使用的检索策略[15], 我们发现从1985年开始, 每年发表的GM家兔相关论文数量一直在增加, 上世纪末、本世纪初达到高峰, 近年来略有下降(图1)。GM家兔主要应用领域集中在生化分子生物学和心血管系统(图2)。下面简要介绍一下在GM家兔作为人类疾病动物模型的研究进展。
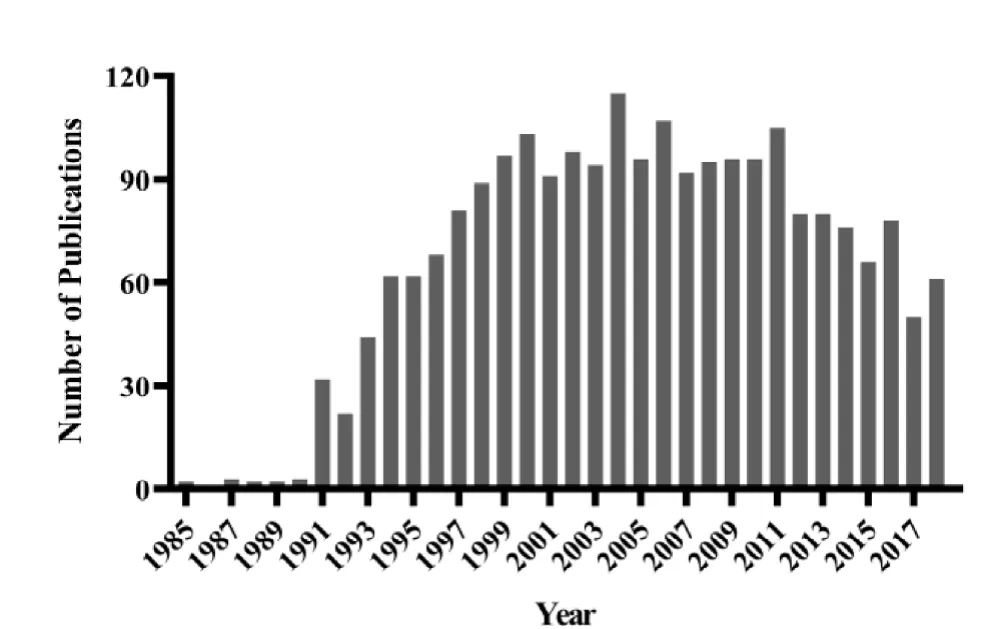
图1 不同年龄GM家兔相关论文数量
因为KO、KI家兔模型培育成功历史相对较短,目前GM家兔在生物医学研究中应用成果大多数来自转基因家兔模型。
全世界每年死亡人数的30%是由于心血管疾病(cardiovascular vascular disease, CVD),我国CVD病死亡率更是世界平均水平的1.5倍,是危害人类健康名副其实的第一杀手[44]。CVD病理基础是动脉粥样硬化,脂代谢异常可引起动脉粥样硬化发生和发展[45]。因此,研究动脉粥样硬化、脂代谢对预防和治疗人类CVD有重要意义。
3.1 脂代谢和动脉粥样硬化
利用转基因家兔模型开展人类相关疾病研究起始于1994年,Fan等[47]报道了家兔过表达人肝酯酶(hepatic lipase, HL)影响血脂和动脉粥样硬化以来,过表达人类15-lipoxyenase、ABCG 1、apo(a)、apoA-I、apoA-II、apoB-100、apoC-III、apoE2、apoE3、CETP、CRP、LCAT、LPL、MMP-12、PLTP、VEGF、U-II以及过表达家兔apoB mRNA编辑蛋白等基因的转基因家兔模型相继培育成功。通过杂交育种技术, 已成功将人类apo(a)、LCAT、LPL、MMP-12等基因转移到低密度脂蛋白(LDL)受体缺陷的家族性高脂血症(Watanabe heritable hyperlipidemic, WHHL)家兔背景下。此外,双表达人HL和apoE、apo(a)和apoB、HL和apoB基因的双转基因家兔及同时表达apoA-I/C-III/A-IV的3个基因转基因家兔模型也培育成功,用于研究这些基因在人类脂质代谢和动脉粥样硬化疾病发生和发展中的作用。

图2 GM家兔不同应用领域论文数量
转基因家兔模型在解析以上基因在脂代谢和动脉粥样硬化作用做出了重要贡献,由于篇幅限制,具体每个GM家兔贡献和相应文献可参照我们已发表相关综述[1,46,47]。
3.2 心脏病
在心脏病研究方面,两个研究小组[48,49]分别构建转基因家兔模型来研究心血管生理、模拟HCM。其中一个研究小组构建了β肌球蛋白重链(β-myosin heavy chain, MyHC)缺陷的转基因兔模型,发现其表型与表达人类MyHC突变型患者几乎相同:心肌肥大、肌细胞和肌原纤维排列紊乱、间质纤维化、过早死亡。MyHC转基因家兔模型也被用来评价药物对HCM和心肌纤维化影响[48,50-54]。另一个小组的James等使用小鼠α和β MyHC作为启动子、制作了过表达肌球蛋白轻链突变体(m149v)的转基因家兔, 来探讨这种突变与HCM关系[49,55]。最近,该研究小组[55-60]还构建了在心室表达心肌肌钙蛋白I(cTnI-146Gly)、α-MyHC、心脏G蛋白α(GSα)等转基因家兔模型研究人类心脏衰竭。cTnI-146Gly转基因家兔再现了人HCM表型[56],α-MyHC转基因家兔肌原纤维蛋白异样[57,58],GSα转基因家兔心率加快、收缩增强[59,60]。此外,Brunner等[61-63]成功构建表达人类钾通道突变基因KCNQ1和KCNH2转基因家兔,表现长心室复极延长(QT)综合征表型。
3.3 其它领域
除了CVD以外,GM家兔在免疫学研究中也有重要应用。如,家兔对HIV-1感染敏感、但进程缓慢,主要是由于人类和家兔CD4结合位点的病毒蛋白HIV gp20不同,有鉴于此,两个实验室建立了表达人CD4转基因家兔模型,发现来源于CD4转基因家兔淋巴细胞感染HIV-1后容易凋亡,表明用转基因家兔模型研究HIV可行[64-66]。此外,基于新一代基因编辑技术,免疫缺陷家兔模型也已经培育成功[4],拓展了GM家兔模型在免疫、肿瘤等的应用,也为未来人类肿瘤预防、诊断和治疗提供了独特的模型。
从图2可以看出,GM家兔模型在生物医学研究中应用极其广泛,这里不再赘述。另外,转基因家兔模型可以成为生物反应器,生产实验或医药工业用重组蛋白,家兔具有小动物(小鼠、大鼠)和大动物(山羊、绵羊、牛)无法比拟的优越性,该领域不属于人类疾病动物模型范畴,故这里也不作详细讨论,有兴趣读者可阅读我们相关综述[6]。
4 家兔与小鼠
家兔脂蛋白代谢和心血管特性与人类相似,而与生物医学研究中使用最广泛的小鼠模型不同:①家兔与人类脂蛋白谱(低密度脂蛋白丰富)相似,与小鼠(高密度脂蛋白丰富)不同; ②家兔的肝脏不能编码apoB48 mRNA,像人的肝脏一样只能合成apoB2100,而小鼠肝脏既能产生apoB2100, 又可以合成apoB48。因此,小鼠的apoB48既存在于肝源性极低密度脂蛋白中, 也存在于肠源性乳糜微粒之中,而人类的apoB48只存在于人的乳糜微粒之中;③家兔与人类血浆中有丰富胆固醇脂转运蛋白,而小鼠缺乏固醇脂转运蛋白; ④胆固醇饮食可以容易诱导家兔动脉粥样硬化,而大多数小鼠品系对此抵抗; ⑤与小鼠相比,家兔缺乏与人相似的apoA-II且具有较低的HL的活性[41,46]。家兔与小鼠的以上差异,暗示在研究脂蛋白代谢与动脉粥样硬化方面,家兔是一个独特的动物模型。
家兔也是心脏病研究独特的模型: ①与小鼠相比, 家兔心脏体积较大和心率缓慢,更利于清醒状态下的生理分析(如, 超声、心脏导管插入); ②人类和家兔间肌原纤维蛋白的相似性高。如, β-MyHC蛋白是人和家兔心室肌细胞主要亚型,超过肌原纤维中肌球蛋白总数80%,而α-MyHC是小鼠亚型,超过95%; ③与家兔和人类心脏相比, 小鼠没有表现出明显的正收缩-频率关系(positive force-frequency relationship); ④家兔β肾上腺素能受体信号转导途径的分子变化与人类心衰患者相似[40,41]。
动物物种间表型差异、同种动物个体差异受遗传背景和环境因素双重影响。即使同一GM的家兔和小鼠模型,因其遗传背景不同,表型也可能不同。如,过表达人LCAT家兔具有抗动脉粥样硬化作用、而在小鼠却促进动脉粥样硬化[67,68]; 转基因小鼠LPL高表达引起肌病(myopathies),家兔则不出现疾病[69,70]; ctTnI-146Gly转基因家兔心肌肥厚,转基因小鼠却不出现心肌肥厚[56,71]。可能是由于家兔脂蛋白代谢、心血管特性与小鼠不同,基因导入后可能产生不同甚至完全相反的表型。因此,对于研究诸如动脉粥样硬化、心脏衰竭、HCM、肥胖、糖尿病等复杂的疾病发病机理,寻找预防或治疗策略时,家兔模型可能是小鼠模型重要补充,因为家兔模型可能更近似于人类复杂的生理状况(如,脂代谢和心血管特征)。再如, 我们知道心血管疾病的病理基础是动脉粥样硬化,而动脉粥样硬化是一个慢性炎症过程[45]。最新研究[72]表明,小鼠炎症反应过程与人类不同,提示单纯使用小鼠模型研究人类炎症性疾病可能有缺陷。也许,家兔模型正好可以弥补这个缺陷。
当然,GM家兔模型制作和应用也有一些不足之处(主要是家兔这个物种本身造成),如,SPF和近交系家兔模型不常见、没有广泛使用; 构建和维持GM家兔需要更高成本; 解析GM家兔模型表型需要花费更长时间; 条件性KO家兔和“工具”家兔制作和维持成本高;缺乏种类足够多抗体用于组织学和分子生物学研究;缺乏精细家兔基因组序列信息(https://www.ncbi.nlm.nih.gov/genome/316?genome_assembly_id=203429)。还有,家兔是草食性动物,食性特征与人不一致; 高脂饲料诱导和WHHL等家兔动脉粥样硬化发生部位与人不一致[73];诱导家兔心肌梗死和脑梗模型困难; 等等,限制了家兔或GM家兔模型在生物医学研究中广泛使用。
5 展望
GM家兔在研究人类疾病发生和发展过程中有独特的、小鼠无法替代的作用,特别是在研究人类诸如高脂血症、动脉粥样硬化、心脏病、免疫学、肿瘤等复杂疾病方面,GM家兔模型为探讨其发病的分子机制开辟了新的途径。经过20多年的发展,GM家兔为我们认识许多人类疾病做出了宝贵的贡献。
动物转基因技术的一个重大缺陷是外源基因整合位点的随机性, 相对于转基因技术而言, 基因打靶(包括KO、KI和基因敲低)是研究基因功能更强大的手段。随着ZFNs、TALENs, 特别是CRISPR/Cas9等新的基因编辑技术的出现, 给家兔基因打靶带来了重大突破。随着这些新技术不断改进和优化, 更多、更新、更精确的GM基因家兔模型将会产生。不编码蛋白质的小RNA(microRNA, miRNA),或是长非编码RNA(long noncoding RNA, lncRNA)也将被引入到GM家兔研究中,培育miRNA或lncRNA KO或KI家兔将成为可能。此外,使用新GM技术可以建立拟人化家兔模型,将会使对人类疾病的研究更加深入。我们相信,未来GM家兔将成为生物医学研究不可或缺的动物模型,必将为研究人类疾病发生发展的分子机制、寻找切实可行预防、诊断和治疗措施提供帮助。
