环磷酰胺对布鲁氏菌侵染小鼠过程的影响
2019-07-15周光普周永顺徐杰谭君张凡高剑峰
周光普,周永顺,徐杰,谭君,张凡,高剑峰
(石河子大学生命科学学院,新疆 石河子832000)
无论从哪条通路进入,布鲁氏菌都会在体内扩散,并在网状内皮系统的细胞中建立一个生存和复制的生态位[1]。这种细菌可以产生全身性感染,也可以在给定的器官中优先定位繁殖。布鲁氏菌病的临床特征取决于疾病的阶段(急性、亚急性、慢性)所侵染的器官和系统,以及其他相关的器官和系统。尽管布氏菌病的性质千变万化,但炎症仍是布氏菌病的一个特征,受感染组织通常表现为炎症浸润。由于布鲁氏菌缺乏明显的毒力因子,布鲁氏菌病的病理表现可能源于炎症驱动过程[2]。
环磷酰胺(cyclophosphamide,CP)是一种广泛用于治疗肿瘤和严重自身免疫性疾病的细胞毒性烷基化剂[3]。据报道,CP可以降低多种免疫反应,被广泛用于动物的免疫抑制模型制作,来研究免疫增强剂的效果和原理[4-6],或者动物相关疾病模型的制作[7]。用环磷酰胺腹腔注射昆明小鼠,发现外周血白细胞数量降低,小鼠肝肾功能下降,淋巴细胞转化率降低[8],CP可以诱导骨髓细胞凋亡,影响小鼠造血功能,导致小鼠模型中外周血细胞含量发生变化[9]。总而言之,CP对机体的造血和免疫系统有广泛的抑制作用,并且CP的剂量、给药方式、时间和受试动物的品系、年龄、性别等因素与抑制的效果密切相关[10]。
本实验利用CP的生物学活性,使受试小鼠处于暂时性的可恢复的免疫低下状态,之后侵染布鲁氏菌M5。研究昆明小鼠在CP的作用下,对布鲁氏菌的相关炎症反应。为布鲁氏菌病发病机制的研究提供数据和图片支持,为进一步研究巨噬细胞和布鲁氏菌的相互作用奠定基础。
1 材料与方法
1.1 材料
6-8周龄,20±2 g清洁级雌性昆明小鼠80只,购自石河子大学实验动物中心,实验动物合格证号:2009-0006。
布鲁氏菌M5疫苗株由石河子大学生命科学学院细胞分子生物学实验室保存。
环磷酰胺购自sigma公司,TNF-a、IFN-γ、NO 试剂盒购自上海酶联生物科技公司,BSA显色试剂盒购自武汉博士德生物公司,TSA、TSB培养基购自BD医疗器械公司,F4/80抗体购自ThermoFisher公司。
微量移液器(eppendorf);恒温培养箱(DNP- 9162);生物安全柜(BAKER-SG403AHE);轮式切片机(Leica-RM2255);自动组织脱水机(KD-TS1A);组织包埋机(KD-BM);组织匀浆机(PB100-SP046);全自动酶标仪(ELX-800);全自动血细胞分析仪(XFA6100)
1.2 实验方法
1.2.1 实验方案
实验流程如图1所示,雌性昆明小鼠80只适应环境1周后,随机分成4组。第1组为对照组(Untreated)腹腔注射相同剂量的生理盐水,第2组为环磷酰胺组(CP)每只小鼠连续7 d腹腔注射40 mg/kg的CP,第3组为布鲁氏菌M5组(B.melitensis)在第0 d侵染1×106CFU布鲁氏菌M5,第4组环磷酰胺和布鲁氏菌M5结合组(CP+B.melitensis),连续7 d腹腔注射40 mg/kg的CP在第0 d侵染1×106CFU布鲁氏菌M5。

图1 实验方案Fig.1 Experimental protocols
1.2.2 日常观察记录
给药之日起观察小鼠临床症状:动物死亡数、健康状况与毒性状况、小鼠背毛与皮肤情况、眼睛、循环系统、自主运动和行为特点。记录每日体重与进食量,分别在接种布鲁氏菌后第3、7和14天每组处死6只小鼠,收集组织、血液进行后续实验分析。
1.2.3 血液分析
收集第一天Untreated和CP组小鼠尾静脉血液,用全自动血细胞分析仪进行细胞分析。
1.2.4 布鲁氏菌侵染小鼠
将布鲁氏菌M5株划线接种于TSA培养基中,倒置于37 ℃生化培养箱中培养72 h,在无菌条件下挑取边缘整齐、中间隆起、表面光滑的单菌落接种于TSB培养基中,置于200 r/min恒温摇床,37 ℃震荡培养72 h。8000 r/min离心2 min,用麦氏比浊管将菌液浓度调整到5×106CFU/mL。在实验的第0 天,B.melitensis和CP+ B.melitensis组小鼠每只注射200 μL含活菌数为1×106CFU。
1.2.5 脏器质量
在第3、7和14 天分别对小鼠进行扑杀,每组小鼠在上述3个时间点各扑杀6只。将小鼠尸体浸泡在75%酒精中5 min,然后固定在手术板上,无菌条件下剪开小鼠腹部,观察小鼠各组织病理变化情况,收集小鼠胸腺、肝、脾,称重并计算脏器相对质量。
脏器相对质量=器官重量(mg)/体重(g)×100%。
1.2.6 组织细菌计数
无菌条件下,将小鼠脾脏、肺脏和肝脏组织转移至15 mL无菌离心管中,加入5 mL无菌PBS,用组织匀浆机匀浆3 min,用无菌PBS将组织匀浆分别作1∶100和1∶1000稀释,然后分别用原液、1∶100稀释液、1∶1000稀释液各100 μL均匀涂布于TSA培养基中,每个浓度各接种3块平板,倒置37 ℃恒温培养箱中培养72 h,计算各平板菌落数量。
克脾菌落数=平板菌落数×10n/脾脏重量(g)×100%,n为稀释倍数。
1.2.7 组织化学观察
在无菌条件下取小鼠脾脏、肝脏和肺脏浸入4%多聚甲醛溶液中,24 h后换液,用于组织切片研究。将固定好的脾、肺和肝脏组织用刀片修成0.5 cm见方的组织块,自动脱水机进行脱水、透明和浸蜡。石蜡包埋组织,用切片机连续切片,厚度约4 μm。用F4/80抗体免疫组化学检测巨噬细胞浸润。
1.2.8 细胞因子检测
采集的小鼠非抗凝血,3000 r/min离心10 min,取上清,然后利用ELISA试剂盒(严格按照操作说明进行)测定TNF-a、NO 和IFN-γ的浓度大小。
2 结果与分析
2.1 一般观察结果
在实验的第五天,观察到CP组和CP+B.melitensis组小鼠出现明显的精神萎靡(驱赶时不愿活动),反应迟钝,行动迟缓,消瘦,嗜睡,而Untreated组和B.melitensis组小鼠没有明显的症状。在实验的第2 d,CP+B.melitensis小鼠出现被毛凌乱,精神沉郁,个别小鼠出现弓头缩背,行动迟缓,呼吸困难现象。从图2中可以看出,CP注射后小鼠体重开始下降,停药后体重趋于稳定。B.melitensis组小鼠体重没有明显增长,在第23 d的时候,与Untreated组差异显著(P<0.01),CP+B.melitensis和CP组小鼠差异极显著(P<0.001)。
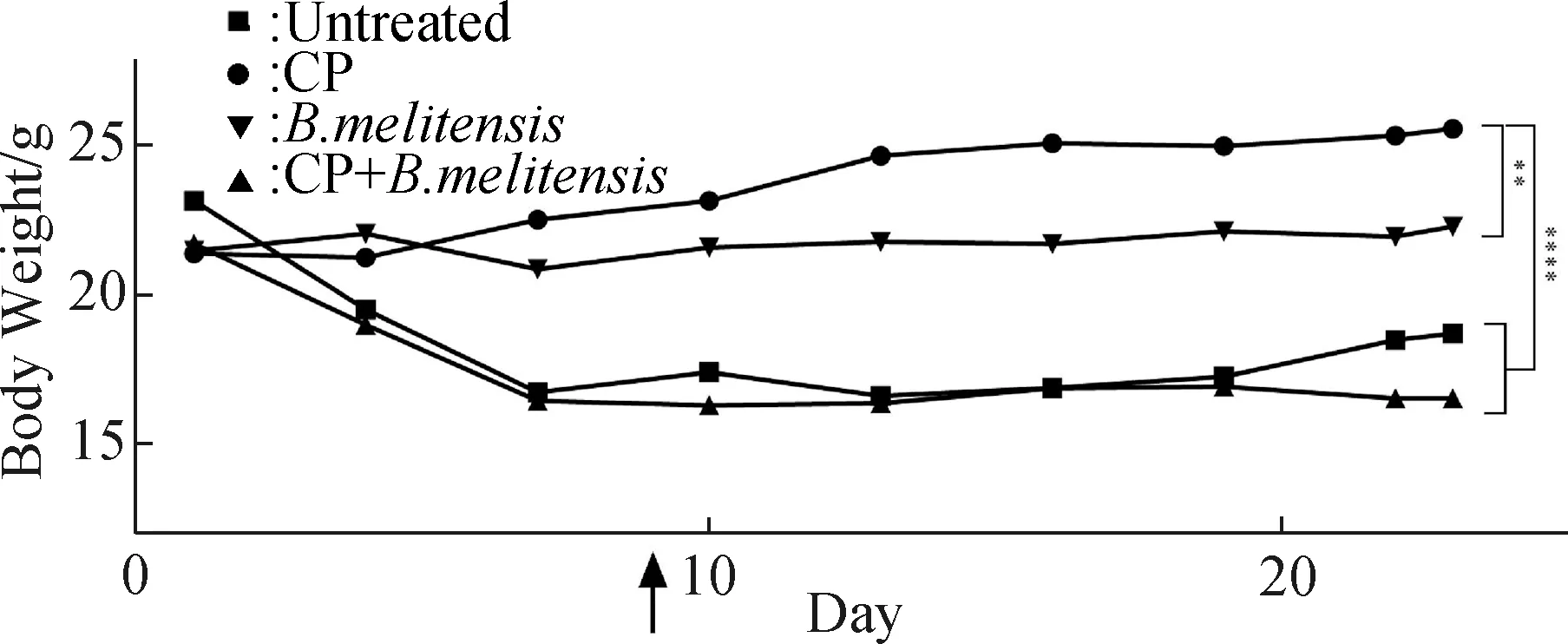
图2 昆明小鼠在试验中的体重变化Fig.2 Average (per group) body weight recording of the KM mice from day 0 and until day 23
2.2 血液分析
40 mg/kg剂量连续7 d注射CP后,小鼠外周血血液学检测结果如图3所示,与对照组相比,环磷酰胺处理组小鼠外周血白细胞总数、淋巴细胞总数和粒细胞总数降低均超过50%,差异具有统计学意义(P<0.01,P<0.01,P<0.001)(图3)。

图3 第8 d血液学指标变化,星号表示与对照组相比差异的显著性Fig.3 Day 8 hematology result,Asterisks represent P-value significance
2.3 脏器相对质量
脏器相对质量见(图4)。
Untreated组CP组B.melitensis组和CP+B.melitensis组小鼠侵染布鲁氏菌M5后,第3、7和14 d无菌分离小鼠脾脏、胸腺、肝脏称重,计算相对质量。
结果发现第3 d,CP组受环磷酰胺影响脾脏指数显著低于Untreated组(P<0.05)。第7 d,CP+B.melitensis组脾脏相对质量显著高于Untreated组(P<0.05),其总体平均值是Untreated组的2倍而B.melitensis组脾脏相对质量平均值虽高于Untreated组但差异不显著。在第14 d,CP+B.melitensis组和B.melitensis组脾脏指数均显著高于Untreated组(P<0.05)。胸腺指数受环磷酰胺影响最为明显,注射环磷酰胺小鼠均发现严重的胸腺萎缩。CP组和CP+B.melitensis组胸腺指数在第3、7和14 d均低于对照组,差异极显著(P<0.01)。B.melitensis组胸腺指数略低于Untreated组,但差异不显著。CP+B.melitensis组和B.melitensis组肝脏指数在第3、7和14 d均高于Untreated组,在第7 d时CP+B.melitensis组小鼠肝脏指数与Untreated组差异极显著(P<0.01),其余时间CP+B.melitensis组和B.melitensis组与Untreated组相比差异显著(P<0.05)。
图4 布鲁氏菌注射后第3、7和14 d脏器与体重的比值Fig.4 Average (per group) viscera/body coefficient recording of the KM mice at days3,days 7 and days 14
2.4 组织细菌计数
布鲁氏菌侵染小鼠3、7和14 d后,分离计数脾脏、肝脏和肺脏细菌,结果如图5所示。脾脏、肝脏和肺脏内,CP+B.melitensis组小鼠的活菌数在3、7和14 d与B.melitensis组小鼠相比差异极显著(P<0.001)。
2.5 免疫组织化学观察
免疫组织化学观察见(图6)。
用F4/80抗体的组织化学检测结果如图6所示。在脾脏中(图6A),Untreated组结果显示了清晰地细胞间隙和少量的成熟巨噬细胞(黄色颗粒)。得到的组织学定量结果证实:CP+B.melitensis小鼠(p<0.01),B.melitensis小鼠(P<0.01)相较于Untreated组,向脾脏迁移的巨噬细胞数量明显增多(数据未展示)。随着时间的推移,观察到在CP+B.melitensis和B.melitensis组织中的巨噬细胞浸润越来越多。Untreated组小鼠巨噬细胞浸润较少,成分散的状态分布在脾脏中,被布鲁氏菌侵染的脾脏,巨噬细胞浸润呈现聚集的状态。在肺脏的组织化学检测结果(图6B)中,可以明显观察到Untreated组和CP组肺脏都能看到相对完整且均匀的肺泡结构,CP+B.melitensis和B.melitensis组几乎没有完整的肺泡结构,这可能是小鼠表现出呼吸困难的主要原因。组织学定量结果也显示出,在第3、7和14 d 巨噬细胞浸润的数量CP+B.melitensis组(P<0.05)和B.melitensis组均显著高于Untreated组。在肝脏中也观察到了相似的结果(图6C),Untreated组显示出清晰地细胞间隙和细胞形态。CP+B.melitensis和B.melitensis组在第3、7和14 d随着时间的推移,细胞间隙越来越不明显,且与Untreated组相比,巨噬细胞浸润有显著增加(P<0.05)。
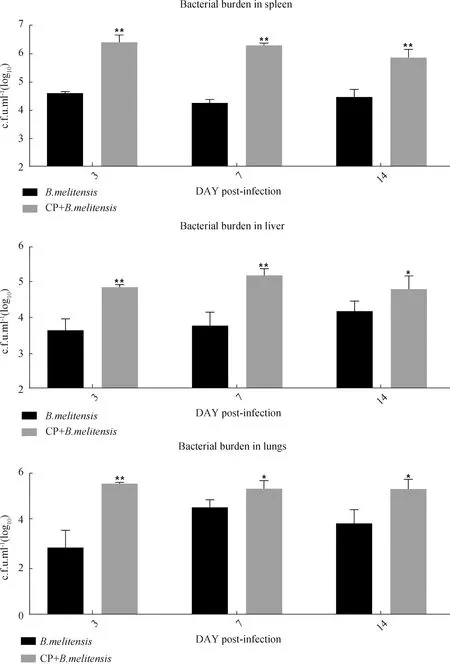
图5 组织细菌分离结果Fig.5 Bacterial burden (c.f.u.) in spleen
2.6 细胞因子检测
在第3 d时,CP 组、B.melitensis组和CP+B.melitensis组IFN-γ的含量相较于Untreated组含量显著减少(P<0.05),CP 组TNF-α的含量含量显著降低(P<0.05),B.melitensis组和CP+B.melitensis组NO含量相较于Untreated组含量略有升高差异不显著。
在第7 d时,CP+B.melitensis组IFN-γ含量显著高于Untreated组(P<0.01),B.melitensis组和CP+B.melitensis组TNF-α含量显著低于Untreated组(P<0.05),CP+B.melitensis组NO含量显著高于Untreated组(P<0.01)。
第14 d时,相较于Untreated组,B.melitensis组和CP+B.melitensis组IFN-γ和NO含量显著升高(P<0.05),TNF-α含量均显著降低组(P<0.05)(表1)。

表1 血清细胞因子含量变化Tab.1 Change of the cytokine levels in the serum
注:*表示在对应天数与对照组相比P值显著性(*表示P<0.05,**表示P<0.01)。
3 讨论
环磷酰胺(Cyclophosphamide, CP)是自体免疫性疾病、癌症、血液和骨髓移植中最常用的药物。如前所述,CP的免疫抑制的效果与其剂量、给药方式等因素相关。因此,本研究首先评价了CP对小鼠免疫活性的影响。免疫器官的相对质量表现免疫器官的发育状况,能够间接反映机体当前的免疫状态。我们发现40 mg/kg的CP连续7 d腹腔注射雌性6-8周龄昆明小鼠,能够使小鼠体重明显下降,外周血白细胞、粒细胞和淋巴细胞数量减少,胸腺和脾脏质量下降。说明CP对小鼠产生了一定程度的骨髓抑制[11],并且诱导了脾脏和胸腺细胞凋亡[12-13],故而引起了小鼠免疫能力的降低,我们观察的结果,与之前的环磷酰胺诱导小鼠产生免疫抑制的结果一致[8, 10, 11]。
我们观察到,布鲁氏菌M5在侵染免疫抑制小鼠过程中,产生了更加明显的被毛凌乱、弓头缩背等临床反应,并且在其组织器官中分离出了更多的布鲁氏菌(图5)。说明在CP的作用下,为布鲁氏菌在小鼠体内的繁殖提供了更加舒适的环境,对布鲁氏菌的生存产生了极大的影响。这些数据在今后的研究中可能是有用的,可以方便了解抗菌素药物或着疫苗对布鲁氏菌侵染宿主的保护效果,也可以研究在免疫功能受损情况下的布鲁氏菌病的情况。更有意义的是,我们可以从环磷酰胺处理的动物体内分离出吞噬细胞,研究宿主病原体的相互作用,以阐明免疫功能受损时巨噬细胞MHC抗原递呈相关的白细胞功能和细胞因子的特异性[7]。
众所周知,脾脏在机体免疫过程中发挥了巨大作用,布鲁氏菌的侵染会导致脾脏肿大[14]。我们的实验也观察到类似的结果,B.melitensis小鼠脾脏质量第7 d时相较于Untreated小鼠升高了50%,同时CP+B.melitensis小鼠脾脏质量升高了138%(图4)。我们知道,脾脏肿大主要是由脾脏炎性细胞浸润引起的,故而我们推测CP引起了更加强烈的炎性细胞浸润。免疫组化结果证实了我们的推测,在脾脏中我们我们发现了更多的巨噬细胞浸润(图6A),这可能是引起CP+B.melitensis小鼠脾脏异常肿大的原因。有趣的是,我们还发现CP小鼠在第7 d脾脏质量相较于Unterated小鼠略有上升(图4),推测可能是CP小鼠脾脏髓外代偿性造血[15]引起的。而在肝脏和肺脏中也发现了相似的细胞浸润结果(图6:B、C),说明在脏器内可能产生了更强的炎症反应,这可能是导致小鼠呼吸困难等临床症状的原因[2]。在CP作用后,炎症反应的加剧和或抑制可能与CP减少免疫抑制因子或调节T细胞的作用相关[16]。而CP+B.melitensis小鼠脏器内有更多的布鲁氏菌生存,这种结果很明显并不是炎症反应减弱或者免疫细胞募集减少导致的,更有可能的原因是巨噬细胞杀灭布鲁氏菌能力下降或者引起了不同的细胞浸润类型[7]。
巨噬细胞参与布鲁氏菌感染的早期炎症反应和宿主防御[17]。免疫组化结果显示(图6),CP+B.melitensis小鼠巨噬细胞招募增加,提示巨噬细胞大量浸润可补偿感染早期免疫细胞的减少。巨噬细胞大量浸润可能导致CP+B.melitensis小鼠感染后血清中促炎因子IFN-γ升高(表1)。IFN-γ调节免疫,能够提高巨噬细胞对抗原的吞噬活性,还能够激活T、B 淋巴细胞,从而提高机体的免疫应答能力[18]。而TNF-α抑制有利于布鲁氏菌在宿主细胞的生存繁殖,对 TNF-α的分泌抑制是布鲁氏菌重要的生存策略[19]。在我们的研究中,发现了相似的结果,并且CP对TNF-α抑制过程没有明显的作用。NO具有抑菌、抗病毒和抗肿瘤的特性,增加NO产量也能增强局部宿主防御机制,产生过量时会对细胞产生毒性[20]。CP+B.melitensis小鼠在CP的作用下,产生了更多的NO细胞因子,B.melitensis小鼠免疫能力相对健全,可以在布鲁氏菌侵染过程中调节自身的免疫平衡。在胸腺中,NO诱导细胞凋亡,可能在T细胞的选择和发育中发挥效应分子的作用[21],有趣的是,我们在B.melitensis小鼠中发现了胸腺萎缩(图4),说明在B.melitensis小鼠中NO对胸腺可能产生了细胞毒性。总而言之,CP+B.melitensis小鼠产生了更强的炎症反应,但是其具体的分子机制还需要进一步研究。
综上所述,本文是首次报道CP对布鲁氏菌感染小鼠的过程的影响。描述了CP诱导的小鼠免疫抑制,可能为布鲁氏菌的侵染过程提供新的见解。研究布鲁氏菌的毒力机制和宿主间的相互作用,对于制定更好的公共防疫和新的疫苗与药物具有重大意义。
