过氧化物酶体增殖物激活受体γ共激活因子1α与线粒体自噬在心肌肥厚中的作用研究进展
2019-07-15余肖琴唐黎群卢风燕刘庆沙静钟云春
余肖琴 唐黎群 卢风燕 刘庆 沙静 钟云春
310009 杭州,浙江爱德医院干部科(余肖琴、卢风燕、刘庆、沙静、钟云春);310014 杭州医学院附属浙江省人民医院干部科(唐黎群)
自噬性程序性细胞死亡主要参与了长半衰期蛋白质的降解[1]。其在细胞内具有高度保守性的降解过程,一般由其自噬体包裹大分子物质和受损细胞器至溶酶体内降解。心肌细胞是高度分化的终末细胞,自噬可以帮助心肌细胞降解衰老、受损及功能异常的细胞器及蛋白质,以维持心肌细胞的能量代谢及细胞自我更新[2],并保持心脏正常功能活动。心肌异常自噬有可能导致心肌细胞肥大,也有可能阻止心肌肥厚发生,目前是心肌肥厚研究的热门靶点之一,而相关分子机制尚存争议。
1 自噬
自噬是一种进化上高度保守的细胞内分解代谢的过程,包括对细胞质组分,如受损的细胞器、毒蛋白聚集体与细胞内病原体的降解[3]。基础自噬在真核细胞中起着关键作用,当吞噬泡特异性或非特异性地包裹自噬靶标后,形成双层膜结构的自噬体。然后自噬体与溶酶体发生融合,并被溶酶体内的水解酶降解以供能量产生或物质再利用。在自噬溶酶体中降解的物质参与合成代谢反应来维持能量水平并用于合成高阶结构(核酸、蛋白质或细胞器),进而维持细胞代谢、稳态和存活[4]。初始自噬泡的形成需要由Beclin1、VPS34和VPS15复合物组成[5]。其次,由两个类泛素缀合系统介导膜的膨胀,微管相关蛋白1轻链3(MAP1LC3)和自噬蛋白ATG12-ATG5复合物与ATG16L的组装,及与磷脂酰乙醇胺相连的微管相关蛋白1轻链3的共轭[6]。自噬泡扩张直到其边界围绕其目标融合,形成具有双重膜的结构,称为自噬体。最后,自噬体与溶酶体融合[3]。
2 线粒体自噬
2005年,Lemasters[7]首先提出了线粒体自噬,线粒体自噬主要是指线粒体通过自噬机制选择性清除受损及功能障碍的线粒体的过程。通过该过程线粒体得以保持质量与数量上的动态平衡,从而保持整个细胞的稳态状态。
2.1 线粒体自噬与心肌能量代谢
心肌细胞富含线粒体,线粒体的数量占整体心肌体积的35%左右,对维持心肌正常功能及代谢具有重要意义。心肌能量代谢紊乱是心肌肥厚的重要特征,而线粒体是能量代谢产生ATP的主要细胞器,正常成人心脏约95%以上的ATP合成来源于线粒体氧化磷酸化过程。Warburg效应是一种从线粒体氧化磷酸化到有氧糖酵解的能量转移,广泛存在于各种癌症中。有趣的是,越来越多的研究表明Warburg效应在非肿瘤性疾病中同样起着至关重要的作用。例如,Warburg效应的干预改善了心肌肥厚和心力衰竭过程中的线粒体功能和心功能[8]。另外,还有研究发现心肌线粒体功能障碍和代谢异常引起心肌梗死细胞凋亡与心力衰竭的加重[9]。
2.2 过氧化物酶体增殖物激活受体γ共激活因子1α与心肌能量代谢及心肌自噬的关系
由于心肌储备减少,衰老与心脏功能下降有关。心脏重构包括多种变化,如线粒体功能的降低和过氧化物酶体增殖物激活受体γ共激活因子1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC-1α)的表达,这是线粒体生物合成和代谢适应的中心调节器。在心肌中,PGC-1α的中度过表达抵消了许多关键的与年龄有关的重构改变,如通过改善血压、年龄相关的细胞凋亡和胶原积累以及参与线粒体生物合成等,保护心肌免于凋亡。而适度的过表达降低了老年心脏的病理重构,从而有助于改善老年心脏功能[10-12]。PGC-1α既是调节能量代谢相关基因的转录因子,又是线粒体生物合成的主要调节因子[13-16]。该蛋白质与核受体PPARγ相互作用,使该蛋白与多种转录因子相互作用。这种蛋白可以与cAMP反应元件结合蛋白和核呼吸因子(nuclear respiratory factors,NRFs)相互作用,并调节其活性。它提供了外部生理刺激与线粒体生物合成调节的直接联系[14]。有报道称耐力运动可激活人骨骼肌PGC-1α基因[15]。运动诱导骨骼肌PGC-1α增加自噬[16]和未折叠蛋白反应[17]。PGC-1α与NRF-1和NRF-2相互作用,以激活线粒体中的呼吸链、线粒体转录因子(TFAM、TFB1M、TFB2M)等基因。在代偿性肥大过程中,PGC-1α的表达水平升高,线粒体生成与细胞大小也成比例增加。病理性肥大时,PGC-1α表达下调,氧化能力下降,导致能量饥饿和心功能不全[18]。
PGC-1α在生理性和病理性肥大中介导代谢变化。同时,PGC-1α表达减少与心脏肥大和衰竭有关,PGC-1α表达增加被认为是正常心脏适应的重要组成部分。调节线粒体生物合成使得PGC-1α及其下游部件NRF-1和TFAM表达增加(图1)。

Pathological stimulus:病理刺激;Physiological adaptations:生理调整;PGC-1α:过氧化物酶体增殖物激活受体γ共激活因子1α;CREB:环磷酸腺苷反应元件结合蛋白;FKHR:横纹肌肉瘤分叉(促凋亡因子);TF-1:转录因子1;TF-2:转录因子2;NRF-1:核呼吸因子-1;TFAM:线粒体转录因子A;Nucleus:原子核;mtDNA:线粒体基因组;Mitochondria:线粒体图1 PGC-1α在线粒体生物合成中的作用机制[19]
3 心肌肥厚与线粒体自噬
心肌肥厚可见于高血压性心脏病、冠状动脉粥样硬化性心脏病及其他心脏疾病的心脏结构改变,临床上病情进展可表现为急慢性心功能不全、心律失常及心原性休克等。而具体的分子机制及信号通路均在研究中。既往研究结果认为肾素-血管紧张素系统激活、氧化应激、心肌纤维化、心肌细胞凋亡、线粒体损伤等均有可能参与此过程中。在病理情况下,心肌细胞内线粒体会出现较大程度的受损,此时线粒体自噬会明显上调。自噬增强是对长期压力后负荷刺激的一种适应性反应。越来越多的证据揭示了自噬体-溶酶体途径(autophagosomal lysosomal pathway,ALP)在心脏肥大与心力衰竭中的活性改变中的重要作用。
心肌ALP不足的结果是慢性压力超载,通过协调增加两种途径,恢复或改善ALP,将有助于对慢性压力负荷引起的心脏肥大和心力衰竭的治疗[20](图2)。
3.1 线粒体与心肌病的发生
线粒体在成人心肌细胞中分别定位在三种亚细胞中:纤维间质、肌膜下和核周[21]。纤维间质的线粒体在大小和形状上是相对均匀的。它们在肌原纤维之间纵向排列,位于Ca2+释放的地方。其主要功能是提供肌肉收缩的ATP。肌膜下和核周线粒体不同于纤维间质的线粒体,组织、形状和尺寸变化较大。这些线粒体参与代谢产物和电解质通过。肌膜和核周线粒体可能在核转录中起作用[22]。
线粒体融合-裂变在新生儿心肌细胞中最明显,有确凿证据表明这些过程在成人心脏中也很重要。例如,参与融合-裂变的蛋白质在成人心脏中高表达[23]。超微结构分析运动训练的小鼠左心室显示存在大量线粒体,被认为是多个融合事件的结果。这些形态变化伴随着线粒体呼吸的改变、线粒体自噬和线粒体生物合成,最终体现在心肌病中。
3.2 心肌肥厚细胞线粒体自噬的相关机制
由于心肌是高度氧化的组织,线粒体在维持心脏的最佳性能方面起着中心作用。线粒体自噬,线粒体融合、裂变、生物合成,以及线粒体形态、质量和丰富度,均常被关联在心肌肥厚中进行研究。通过将线粒体自噬、能量代谢和营养供应之间的平衡联系起来,线粒体形态的改变可作为心脏病理重构过程中生物能量适应的重要机制。线粒体自噬是细胞选择性清除受损线粒体的过程,及时清理功能紊乱线粒体并重复利用其内容物,对合成新线粒体尤为重要,因此线粒体融合-裂变与自噬对肥厚心肌生理功能起着极为关键作用。在生理状态及应激状态下,多种因子可调控心肌细胞线粒体自噬,进而发挥保护心肌细胞的作用。有文献报道了线粒体融合-裂变和线粒体自噬在心血管疾病的发生及进展过程中发挥作用,其中,线粒体融合-裂变会影响心肌肥厚和失代偿等。这些发现将有助于改善心肌肥厚的预防与治疗[20]。
为应对各种环境压力,细胞可以不合成ATP,线粒体主要产生活性氧,进而引起细胞损伤,启动凋亡途径。然而,细胞已进化出现抵抗异常线粒体产生活性氧的防御机制[24]。其中最根本的办法是将这些功能紊乱的线粒体选择性隔离和降解,即线粒体自噬。在病理情况下,肥厚心肌细胞内线粒体会出现较大程度的受损,此时线粒体自噬会明显上调,以便在受损线粒体对细胞造成进一步损伤之前将其清除,但当应激刺激过强或持续时间过长时,受损线粒体数量超过线粒体自噬能力时,会导致受损线粒体聚集,其可产生大量活性氧、释放促凋亡因子,以及通过膜通透性转运孔的开放导致细胞死亡。
类似的可引发线粒体依赖的细胞死亡的刺激可引起线粒体自噬。这两种高度调节的平衡过程将决定心肌细胞是否存活或死亡。明确线粒体和线粒体自噬在肥厚心肌病中的作用是非常有意义的。因为线粒体损伤与多种心血管疾病关联,所以适当清除功能失调的线粒体是非常关键的[25]。
线粒体生物合成和线粒体自噬在维持线粒体质量和修复中是同样重要的。目前线粒体自噬的作用特别受到关注,有证据表明它在心肌细胞损伤修复与病理中起着重要保护作用。因此,如果将线粒体自噬作为一个有用的治疗靶点,将决定何时调控线粒体自噬活动,可以防止、抵消或逆转特定的心血管疾病活动。
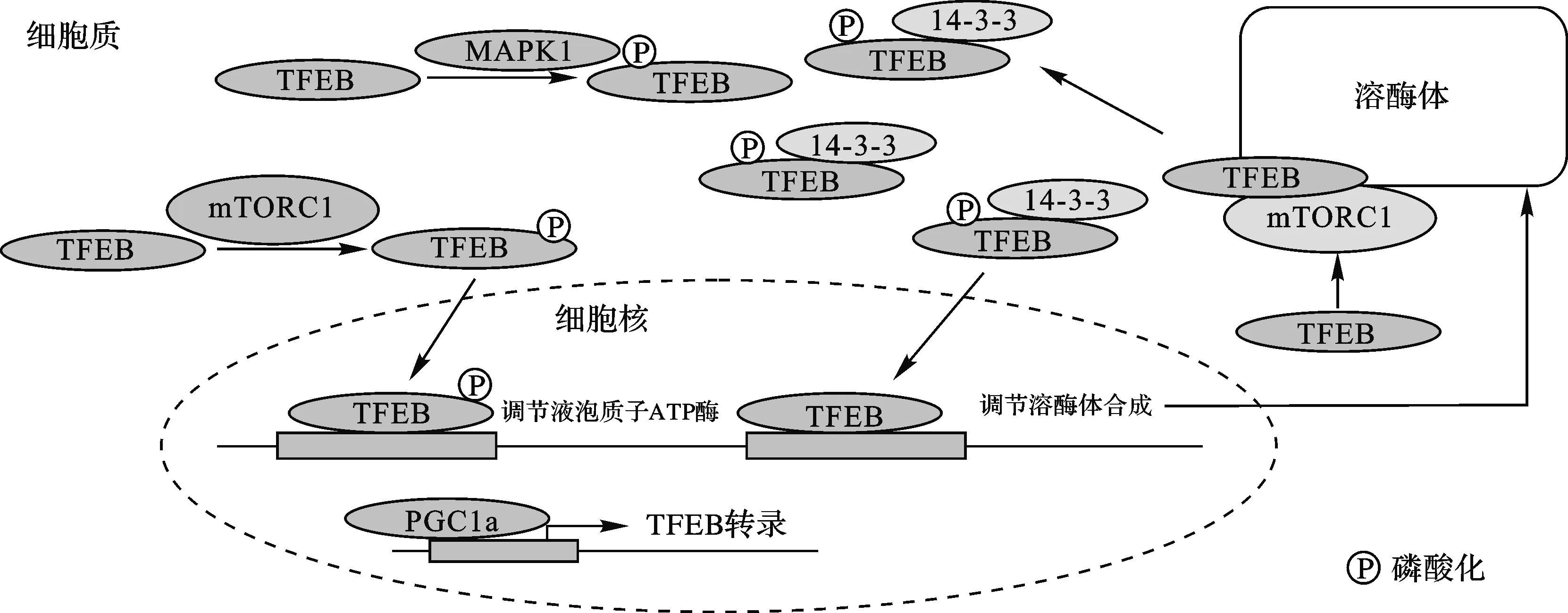
TFEB:转录因子EB;mTORC1:雷帕霉素靶点蛋白复合物1;MAPK1:丝裂原活化蛋白激酶1;PGC-1α:过氧化物酶体增殖物激活受体γ共激活因子1α图2 转录因子EB相关的调控作用[20]
4 小结
心肌肥厚的相关研究一直是热点,而自噬-线粒体自噬-能量代谢也是目前心肌肥厚的研究热点,鉴于PGC-1α的重要性,我们试图在既有研究基础上阐述自噬-线粒体自噬-能量代谢-PGC-1α之间的关系及其对心肌肥厚的影响,为进一步开展研究提供方向。
适当线粒体自噬对于维持心脏正常功能具有重要作用。线粒体自噬受阻会导致受损或功能障碍的线粒体在细胞内聚集;而线粒体自噬过度会使线粒体过度降解影响能量代谢,两者均可影响心脏生理功能。在某些病理条件下,如心肌缺血再灌注损伤,线粒体自噬的程度会发生改变,而此时适当的调控线粒体自噬可产生心肌保护作用。但在某些疾病中,有时难以区分线粒体自噬的异常是疾病的原因还是结果,故单纯针对线粒体自噬的程度的改变而加以干预,可能会存在风险,尽管如此,以线粒体自噬作为治疗靶点,也可在心肌保护方面提供新思路。我们推测对线粒体自噬的进一步研究将揭开心肌细胞能量代谢、线粒体功能,以便为治疗疾病提供新方法。
利益冲突:无