脲酶抑制剂与硝化抑制剂对稻田土壤硝化、反硝化功能菌的影响
2019-07-13张文学王少先夏文建刘增兵李祖章刘光荣
张文学,王少先,夏文建,孙 刚,刘增兵,李祖章,刘光荣
(江西省农业科学院土壤肥料与资源环境研究所/农业部双季稻营养与农业环境观测实验站/国家红壤改良工程技术研究中心,南昌 330200)
尿素是一种高浓度的酰胺态氮肥,因其较高的含氮量被作为农业生产上最常用的氮肥,但是尿素施入农田后会导致氮素损失是一直被关注的。硝化-反硝化作用是稻田氮素损失的重要途径[1],而且硝化、反硝化一般是紧密相连、相继发生的,又被称为成对硝化和反硝化过程[2],这两个反应过程被证明均由土壤微生物所驱动[3]。
硝化作用可分为两步:氨氧化过程 (NH3→NO2-)与亚硝酸盐氧化过程 (NO2-→NO3-),氨氧化过程被认为是硝化作用的限速步骤[3-7]。氨氧化过程又可以分两步为NH3→NH2OH→NO2-,且分别由氨单加氧酶(ammonia monooxygenase,AMO) 与羟胺氧化还原酶(hydroxylamine oxidoreductase,HAO) 催化完成[8]。氨单加氧酶是一种胞内酶,由基因amoA、amoB和amoC编码的三个亚基组成,由于amoA基因的序列具有一定的保守性,且所编码的蛋白亚基含有该酶的活性位点,因此常被作为氨单加氧酶的功能标记基因[4-5]。氨氧化细菌 (ammonia oxidizing bacteria,AOB)、氨氧化古菌 (ammonia-oxidizing archaea,AOA) 作为氨氧化的主要完成者,均含有编码氨单加氧酶的基因amoA、amoB和amoC[9],且amoA基因被作为研究AOB与AOA的标记基因。反硝化作用(NO3-→NO2-→NO→N2O→N2) 一般发生在嫌气或低氧的环境,硝酸盐在硝酸盐还原酶 (Nar)、亚硝酸盐还原酶 (Nir)、NO还原酶 (Nor) 和N2O还原酶 (Nos) 的催化作用下依次还原为NO2-、NO、N2O、N2,对编码以上四种酶的功能基因主要有narG、nirK/nirS、norB、nosZ[3,10],由于亚硝酸盐还原酶 (Nir) 催化的反应是反硝化过程中关键的限速步骤,因此,关于编码该酶的功能基因nirK和nirS的研究也较多,主要用作反硝化微生物群落的分子标记物[11],而且,研究发现nirK基因对环境因子的响应较nirS基因更灵敏[12-13]。
由于脲酶抑制剂可以通过抑制脲酶活性以达到延缓尿素水解为铵态氮的目的,硝化抑制剂可以抑制铵态氮的硝化作用,从而减少NO3-的形成、淋失以及随后的反硝化损失[14-15],二者常被用在农业生产上提高氮肥利用率[16-17]。有报道指出,参与硝化、反硝化菌的群落结构以及丰度对土壤养分、pH、温度等理化性状的变化有着灵敏的响应[3,18-19]。但关于两种抑制剂及其配施对稻田硝化与反硝化菌群结构、丰度的影响报道较少。本文以南方红壤稻田为研究对象,在添加脲酶抑制剂NBPT与硝化抑制剂DMPP之后,研究了分蘖期与孕穗期土壤中铵态氮、硝态氮含量、amoA与nirK基因丰度以及AOB、AOA与反硝化细菌群落结构的变化,旨在进一步揭示抑制剂的作用机理及其对土壤环境的影响。
1 材料与方法
1.1 试验地点
试验于2012年4—7月在江西省农业科学院土壤肥料与资源环境研究所南昌试验基地 (28°21′12″N,115°54′25″E) 进行。该区属于亚热带湿润气候,海拔高度20 m,平均气温17.8℃,≥ 10℃的积温为5432℃,无霜期长达240~307 d,年降水量1662 mm,降水季节分配不均,全年降水50%以上集中在4—6月。供试土壤为第四纪红粘土发育的潮砂泥田,土壤质地为壤土。播种前土壤有机质含量20.12 g/kg,全氮含量2.06 g/kg、硝态氮含量1.8 mg/kg、铵态氮含量16.2 mg/kg、有效磷2.6 mg/kg、速效钾94.55 mg/kg、pH 4.97、土壤容重为1.19 g/cm3。
1.2 供试材料与试验设计
水稻供试品种为株两优30,脲酶抑制剂为NBPT (N-丁基硫代磷酰三胺),硝化抑制剂为DMPP(3,4-二甲基吡唑磷酸盐)。供试肥料品种:氮肥为尿素 (含N 46%)、磷肥为钙镁磷肥 (含P2O512%)、钾肥为氯化钾 (含K2O 60%)。
试验共设5个处理:1) 不施氮肥 (CK);2) 尿素(U);3) 尿素 + 脲酶抑制剂 (U + UI);4) 尿素 + 硝化抑制剂 (U + NI);5) 尿素 + 脲酶抑制剂 + 硝化抑制剂 (U + UI + NI)。设3次重复,各小区随机区组排列,每个小区面积30 m2(5 m × 6 m),各小区以50 cm的分隔行隔开,且保持小区间的田埂高出地面40 cm,并用塑料薄膜包裹田埂以防止相互串水串肥,实现各小区独立排灌的管理目的。试验氮 (N)、磷(P2O5)、钾 (K2O) 用量分别为 135 kg/hm2、75 kg/hm2和150 kg/hm2。抑制剂与尿素混匀施入,抑制剂用量为尿素的1%。氮肥和磷肥作基肥于移栽前一次性施入;钾肥分3次施入,40%作基肥,30%作分蘖肥,30%作孕穗肥。试验于2012年3月10日播种,4月23日移栽,7月20日收获,水稻种植密度以及各项栽培管理措施同当地农民习惯。
样品采集:在水稻分蘖期、孕穗期分别采集各小区耕层土壤,一部分保存于4℃冰箱用于测定土壤铵态氮、硝态氮含量,另一部分保存于-20℃用于土壤DNA提取,分析AOB、AOA以及反硝化细菌的基因丰度与群落结构。
1.3 样品测定与数据分析
1.3.1 土壤中铵态氮与硝态氮含量的测定 土壤中的铵态氮与硝态氮含量用1 mol/L的KCl溶液浸提,采用全自动间断化学分析仪 (Smartchem TM200 discrete chemistry analyzer) Smartchem 200测定。
1.3.2 土壤微生物总DNA的提取 将土壤样品按照土壤DNA提取试剂盒 (Fast DNA SPIN Kit for soil MP-bio,USA) 的说明进行操作,并用0.7% (w/v) 的琼脂糖检验DNA,提取成功的样品保存于-20℃冰箱待用。
1.3.3 聚合酶链式反应 (PCR) 对提取成功的DNA模板进行聚合酶链式反应 (polymerase chain reaction,PCR),运用特异性引物对土壤中特定微生物的DNA片段进行扩增。AOB与AOA的amoA基因所用的扩增引物分别为amoA-1F/amoA-2R[20]与Crenamo A23f/Crenamo A616r[21-22],反硝化细菌的nirK基因所用的引物为F1aCu/R3Cu[23],具体引物序列以及PCR反应程序见表1。PCR反应体系共25 μL:12.5 μL 的 2 × EasyTaq PCR SuperMix (TransGen 生物技术公司,中国北京),0.5 μL的上、下引物和1 μL稀释10倍的DNA模板,10.5 μL的灭菌双蒸水,终体积为25 μL。在MyCycler热循环仪 (Bio-Rad公司)进行PCR反应,所有PCR产物采用1%的琼脂糖凝胶电泳检验PCR扩增反应的效果。
1.3.4 荧光定量PCR AOB、AOA的amoA基因和nirK基因的定量PCR利用荧光定量PCR仪Bio-Rad iQ5 (Bio-Rad,USA) 分析,运行程序按定量试剂盒说明书执行。PCR体系包括:5 μL SYBR Green I PCR Mix (TaKaRa,Dalian,China),0.2 μL 的引物,0.8 μL DNA 模板,终体积为10 μL。AOB、AOA的amoA基因和nirK基因定量PCR所用引物见表1。含有目标基因片段的质粒从108—102进行10倍浓度梯度连续稀释制作标准曲线,通过溶解曲线确定定量PCR的扩增特异性;每个样品重复3次。反应结束后,运行程序会根据标准曲线以及样品的Ct值(每个样品管内的荧光信号到达设定阈值时所经历的循环数) 定量计算出样品的起始拷贝数。

表1 PCR引物序列及反应程序Table 1 Primers and conditions used for the conventional PCR
1.3.5 变性梯度凝胶电泳 (DGGE) 聚丙烯酰胺浓度为8% (w/v),AOB、AOA与nirK型反硝化细菌的DGGE变性浓度分别为50%~70%、30%~50%与45%~65%。在1倍TAE缓冲液中,75 V电压、60℃条件下电泳16 h,电泳后用1 μL的SyBR green I (Invitrogen) (稀释10000倍) 核酸染料染色30 min,然后用Bio-Rad成像系统 (Bio-Rad,USA)拍照。DGGE图谱采用Quantity One软件分析样品的电泳条带特征,聚类分析采用UPGMA运算法则。
1.3.6 序列比较与系统发育分析 将DGGE图谱中的优势菌群切胶回收纯化,并用表1中相应的引物进行PCR扩增,将扩增产物进行纯化后测序[生工生物工程 (上海) 股份有限公司],测序得到的序列信息输入NCBI (www.ncbi.nlm.nih.gov) 通过Blast与Gene Bank中的已知序列比对,确定序列的微生物种类,并运用MEGA6.0软件的邻接法 (Neighbor joining method) 进行系统发育分析。
1.3.7 数据处理 数据经Excel 2007整理后,采用SAS9.1软件进行统计分析;PCR-DGGE成像用quantity one软件分析。
2 结果与分析
2.1 土壤铵态氮与硝态氮含量
稻田土壤中的铵态氮含量明显高于硝态氮的含量(图1)。在水稻分蘖期,与处理U相比,处理U +UI和U + UI + NI的铵态氮含量显著降低,而处理U +NI与处理U相比无显著差异,这可能由于NBPT减缓了尿素水解,显著降低了此时土壤的铵态氮含量,而单独添加DMPP则无此效应。在孕穗期,所有处理的土壤铵态氮含量较分蘖期的均急剧下降,可能是由于分蘖期到孕穗期水稻快速生长对氮肥的大量吸收所致;施氮肥的四个处理相比,添加NBPT的处理U + UI与U + UI + NI的铵态氮含量明显高于处理U与U + NI的,这可能由于NBPT此时已分解,失去了对脲酶活性的抑制作用,尿素进一步水解,增加了铵态氮的含量,可为水稻的后期生长提供充足的氮源。
与土壤铵态氮含量相比,硝态氮含量极低,且同一时期内处理间的差异均不显著 (P> 0.05),这说明添加NBPT虽然显著降低了分蘖期土壤中铵态氮的含量,但是对于硝态氮含量没有显著影响,这可能由于淹水条件下硝化作用极弱,导致铵态氮的含量对硝化作用无明显影响,同理,硝化抑制剂DMPP对硝化反应的影响也很微弱。
2.2 土壤硝化、反硝化菌丰度
处理间AOB的amoA基因拷贝数存在显著差异(图2)。在分蘖期,AOB的amoA基因拷贝数范围在2.0 × 106~3.4 × 106copies/g,施氮处理中 AOB 的amoA基因拷贝数显著高于不施氮处理;处理U +NI与U + UI + NI的amoA基因拷贝数显著低于处理U和U + UI。这说明施用氮肥显著增加了分蘖期稻田土壤中AOB的丰度,然而添加硝化抑制剂DMPP能够有效抑制AOB的生长。在孕穗期,所有施氮处理相比CK均增加了土壤amoA基因拷贝数,而施用氮肥4个处理间无显著差异,说明施用氮肥对孕穗期的AOB生长依然有促进作用,但DMPP对AOB的抑制作用已消失,可能此时DMPP的时效性已过。
图3显示,AOA的amoA拷贝数范围在17.3 ×106~20.5 × 106copies/g之间,是氨氧化细菌amoA基因拷贝数的6.1~10.2倍,说明在红壤稻田AOA在数量上居于主导地位;AOA的amoA基因拷贝数在分蘖期明显高于孕穗期的,说明生育期对AOA的丰度有明显影响,而所有处理间始终无显著差异,说明AOA的丰度对施用氮肥、NBPT以及DMPP均无明显响应。
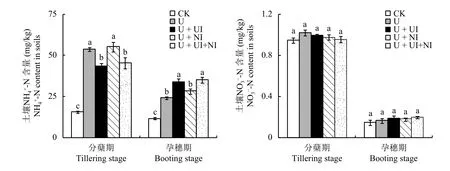
图1 土壤铵态氮与硝态氮含量Fig.1 Contents of NH4+-N and NO3--N in soils
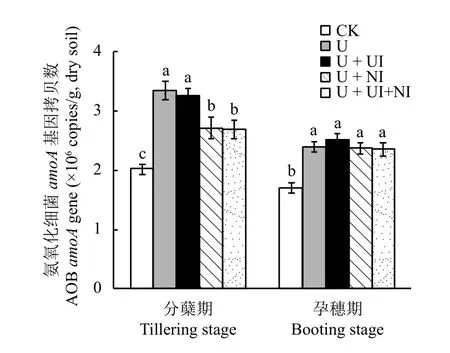
图2 土壤氨氧化细菌 (AOB)amoA基因拷贝数Fig.2 Ammonia-oxidizing bacterial (AOB)amoAgene copy numbers in soils
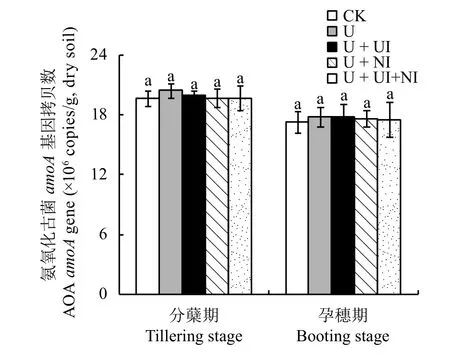
图3 土壤氨氧化古菌 (AOA)amoA基因拷贝数Fig.3 Ammonia-oxidizing archaeal(AOA)amoAgene copy numbers in soils

图4 土壤反硝化细菌nirK基因拷贝数Fig.4 Denitri fi ernirKgene copy numbers in soils
由图4可知,nirK基因拷贝数在21.0 × 107~36.3 × 107copies/g之间,在分蘖期与孕穗期,施氮肥处理的nirK基因拷贝数均显著高于不施氮肥的,而处理U、U + UI、U + NI与U + UI + NI在分蘖期或孕穗期均无显著差异,说明施用氮肥可以显著提高nirK型反硝化细菌的丰度,而脲酶抑制剂NBPT或硝化抑制剂DMPP对此无明显影响。分蘖期的nirK基因拷贝数均显著高于孕穗期的,可能主要原因是孕穗期土壤中氮肥的消耗导致反硝化细菌的响应,另外,不同生育期土壤生态环境的变化对此也存在有一定程度的影响。从三种菌群丰度来看,古菌amoA/细菌amoA拷贝数比值大于6.1,而nirK/(细菌amoA+ 古菌amoA) 拷贝数比值大于11.1,这可能由于稻田特定的生态环境所决定。
2.3 土壤铵态氮、硝态氮含量与硝化、反硝化菌丰度的相关性
由表2可知,AOB的丰度与分蘖期铵态氮、硝态氮以及孕穗期的铵态氮含量呈极显著正相关 (P<0.01),说明AOB对氮肥的施入有灵敏的响应,而且对氨氧化作用有重要的贡献;另外,因为NBPT对土壤NH4+-N含量有明显的调节作用,因此推测NBPT对AOB的丰度也有着间接的影响。AOB的丰度与孕穗期的硝态氮含量相关性不显著,可能由于此时硝态氮含量过低所致。
AOA丰度与两个时期的土壤铵态氮、硝态氮含量的相关性均不显著 (P> 0.5),表明AOA比较稳定,对氮肥的施入没有明显响应。
反硝化细菌与分蘖期铵态氮、硝态氮以及孕穗期的铵态氮含量呈极显著正相关 (P< 0.01),这与AOB的规律相似。以上结果说明,AOB与反硝化细菌对氮肥的施入反应灵敏,而AOA则比较稳定。
2.4 硝化、反硝化菌的群落结构特征
运用变性梯度凝胶电泳 (DGGE) 的方法研究AOB的群落结构。首先利用引物amoA-1F/amoA-2R对AOB的amoA基因进行PCR扩增,扩增产物再通过DGGE分析,得到相应的DGGE图谱 (图5)。与不施氮肥相比,施用氮肥对分蘖期与孕穗期AOB的群落结构均有明显影响,主要表现为优势条带明显增多。在分蘖期,CK处理的主要条带包括B3和B4,施用氮肥的4个处理还明显增强了B1和B2条带的信号强度;然而,单施氮肥处理与添加了抑制剂的处理 (U与U + NI、U + UI、U + UI + NI)之间AOB的图谱差异不大,且条带B2和B3信号强度均较高,表明B2与B3是施氮肥稻田土壤中AOB的优势菌群。此外,我们发现不同生育期对AOB群落结构的影响在处理CK的差异比较明显,分蘖期处理CK的优势条带为B3,而在孕穗期优势条带转变为B2,表明随着时间的推移,土壤AOB优势菌群是动态变化的,这可能与气候条件变化或者土壤养分的消耗有关。优势菌群B3在孕穗期时,所有处理的信号均明显变弱,这可能由于条带B3所代表的AOB对氮肥的响应更灵敏,随氮肥的减少,B3丰度明显下降。经聚类分析 (UPGMA) 的结果表明,所有处理分为两大类,分蘖期的CK处理和孕穗期的CK单独一簇,其余处理聚为一簇,两个时期所有施用氮肥处理的AOB群落结构的相似度大于68%,表明施用氮肥显著影响了AOB的群落结构,而脲酶抑制剂NBPT和硝化抑制剂DMPP对AOB群落结构的影响较小。
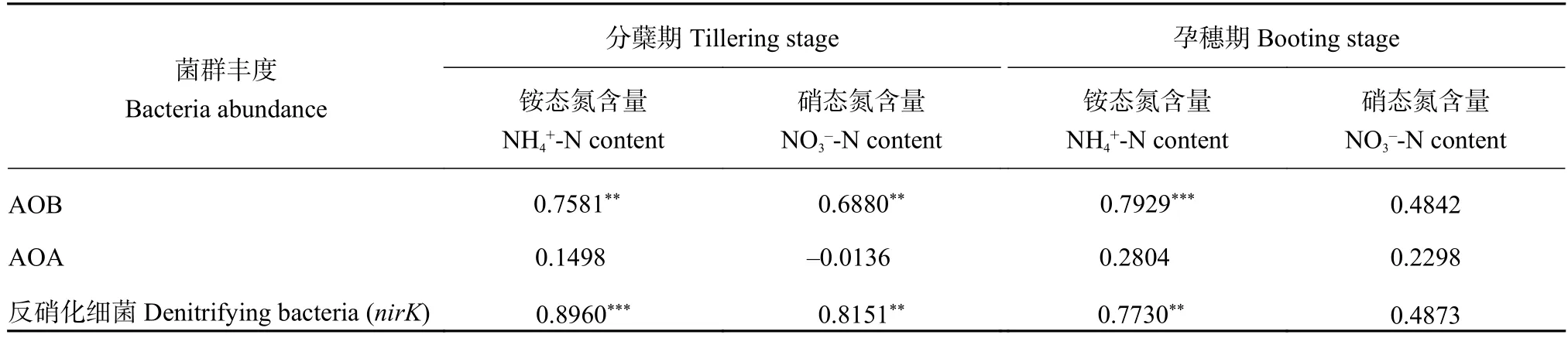
表2 土壤铵态氮、硝态氮含量与硝化、反硝化菌丰度的相关性Table 2 Relations between contents of NH4+-N and NO3--N with abundances of AOB, AOA and denitrifying bacteria in soils
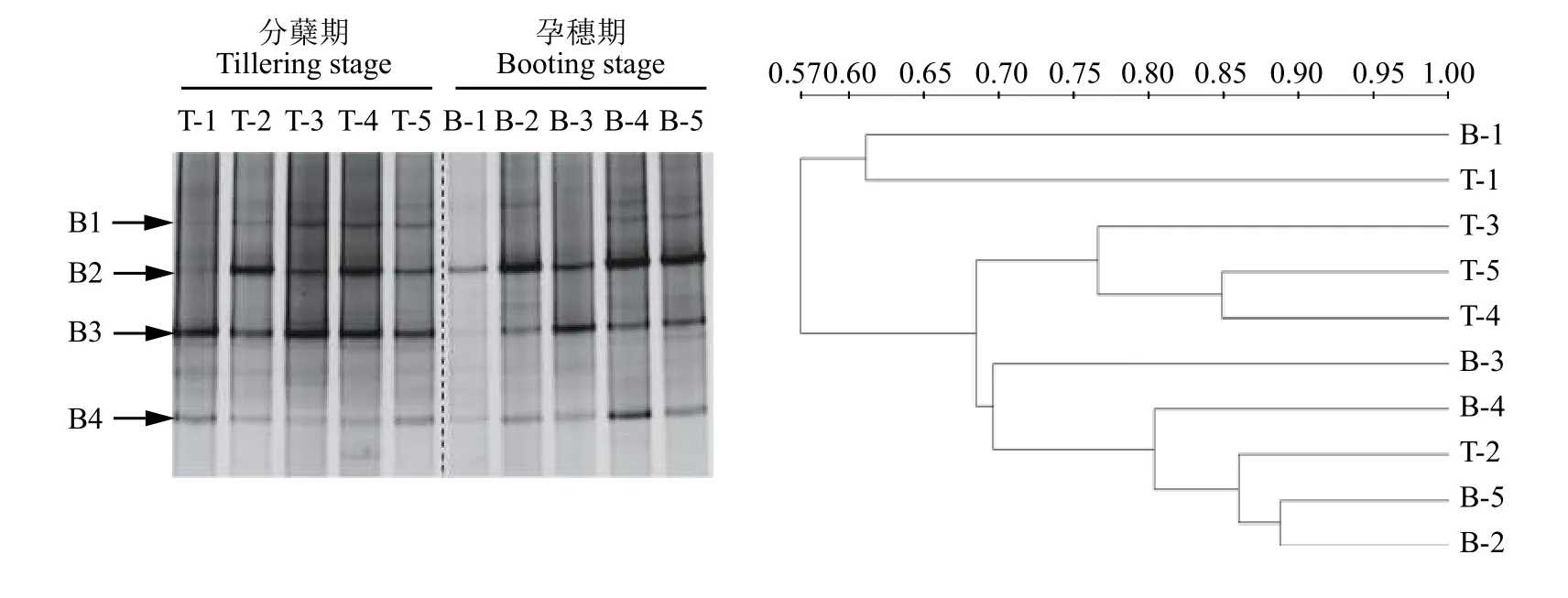
图5 氨氧化细菌amoA基因的DGGE图谱及其聚类分析Fig.5 DGGE profile and clustering analysis of DGGE patterns of ammonia-oxidizing bacterialamoAgene
对AOB的DGGE凝胶上的4个条带进行切胶纯化测序,所得序列经NCBI数据库的BLAST比对分析后发现,所有序列与数据库中来源于土壤的氨氧化细菌amoA基因的相似性大于96%。将检测到的4个基因序列及其相似序列构建系统发育树 (图6)可知,B1与B3聚为一簇,二者同源性较高,B2与B4各自为一簇;与B1和B3同源性较高的序列有来源于砂壤土的亚硝化单胞菌目 (Nitrosomonadales)以及来源于红壤、酸性土壤、湖泊的氨氧化细菌amoA基因;与B2同源性较高的序列有来源于土壤的亚硝化螺菌属 (Nitrosospirasp.) 以及来源于稻田氨氧化细菌的amoA基因;与B4同源性较高的序列有来源于土壤的亚硝化螺菌属以及亚硝化叶菌属(Nitrosolobus multiformis)。
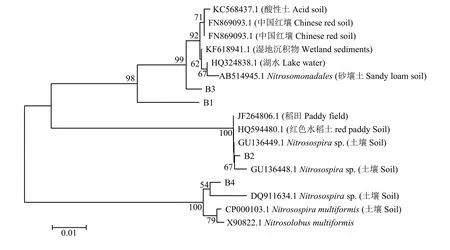
图6 amoA基因的系统进化树Fig.6 Phylogenetic tree of ammonia-oxidizing bacterialamoAsequences from DGGE bands using neighbor-joining analysis
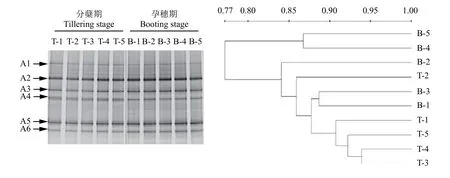
图7 氨氧化古菌amoA基因的DGGE图谱及其聚类分析Fig.7 DGGE profile and clustering analysis of ammonia-oxidizing archaealamoAgene
利用引物crenamoA 23fd和crenamoA 616rd对AOA的amoA基因进行PCR扩增,随后进行DGGE分析,相应的DGGE图谱见图7。所有处理均包括6条主要的条带 (A1—A6),说明这6条带是稻田土壤中AOA的优势菌群。相比AOB的群落结构变化,各处理对AOA的群落没有明显影响;两个时期间也无显著变化,说明该稻田土壤中AOA对不同施肥处理以及环境变化不敏感,在水稻不同生育期间较为稳定。聚类分析 (UPGMA) 的结果表明,两个时期所有处理的氨氧化古菌群落结构的相似度大于77%,说明施用氮肥、脲酶抑制剂NBPT以及硝化抑制剂DMPP对AOA的群落结构均无明显影响。
对AOA的DGGE凝胶上的6个条带进行切胶纯化测序,所得序列经NCBI数据库的BLAST比对分析后发现,与数据库中AOA的amoA基因相似度高于92%,将目的序列及其相似的序列建立系统发育树 (图8),所有条带被分为两大类:条带A2、A5与A3、A6聚为一簇,A1、A4聚为一簇,说明A2、A5、A3、A6序列同源性较高,A1与A4的序列同源性较高;与A2、A5同源性较高的序列主要来自于酸性土壤,与A3、A6同源性较高的序列主要来源于红壤以及稻田AOA的amoA基因;而与A1、A4聚为一簇的主要来自于玉米地及沉积物AOA的amoA基因等。
利用引物F1aCu/R3Cu对反硝化细菌的nirK基因进行PCR扩增,并进行DGGE分析 (图9),所有处理在分蘖期的条带数明显多于孕穗期的,其中条带K1、K2、K3、K5与K7信号强度最为强烈,说明包含这5类nirK基因的细菌是该稻田土壤中nirK型反硝化菌的优势菌群;施用氮肥以及不同抑制剂对分蘖期的反硝化细菌群落结构没有明显影响。在孕穗期,所有处理的各条带均明显变弱,尤其是不施肥处理下,可见条带更为稀疏,说明此时nirK型反硝化细菌的丰度明显下降,这可能与此时氮肥已大量消耗有关,因为反硝化细菌对氮肥有灵敏的响应[12]。聚类分析 (UPGMA) 的结果表明,两个时期所有处理的反硝化细菌群落结构被分为三大类:孕穗期的CK处理单独一簇,其余处理的聚为一簇,分蘖期的所有处理聚为一簇,说明不同生育期对nirK型反硝化菌群落结构有着明显的影响。以上结果说明,水稻生育期以及施用氮肥对nirK型反硝化菌群落结构有明显影响,而两种抑制剂则无此效应,这说明两种抑制剂的作用具有专一性,对反硝化细菌无明显影响。
对反硝化细菌nirK基因DGGE凝胶上的7个条带进行切胶测序分析,所得序列经NCBI数据库的BLAST比对分析,建立系统发育树 (图10),系统发育树明显的分为两簇,大多数条带 (K1、K2、K3、K4、K5和K6) 分布在第一簇中,这一簇的nirK基因序列主要来源于农田、高山草甸、稻田等,而K7单独分布在另一簇,与其它nirK基因遗传距离较远。
3 讨论
脲酶抑制剂可以提高氮素利用率[16,24],本研究表明,添加NBPT (或NBPT与DMPP配施) 延缓了尿素水解,显著提高了水稻孕穗期土壤中的铵态氮含量,为水稻后期生长提供充足氮肥,这可能是其增产增效的主要原因,而单独添加DMPP则无此效应,说明稻田不适宜单独添加硝化抑制剂。

图8 氨氧化古菌amoA基因的系统进化树Fig.8 Phylogenetic tree of ammonia-oxidizing archaealamoAsequences from DGGE bands using neighbor-joining analysis
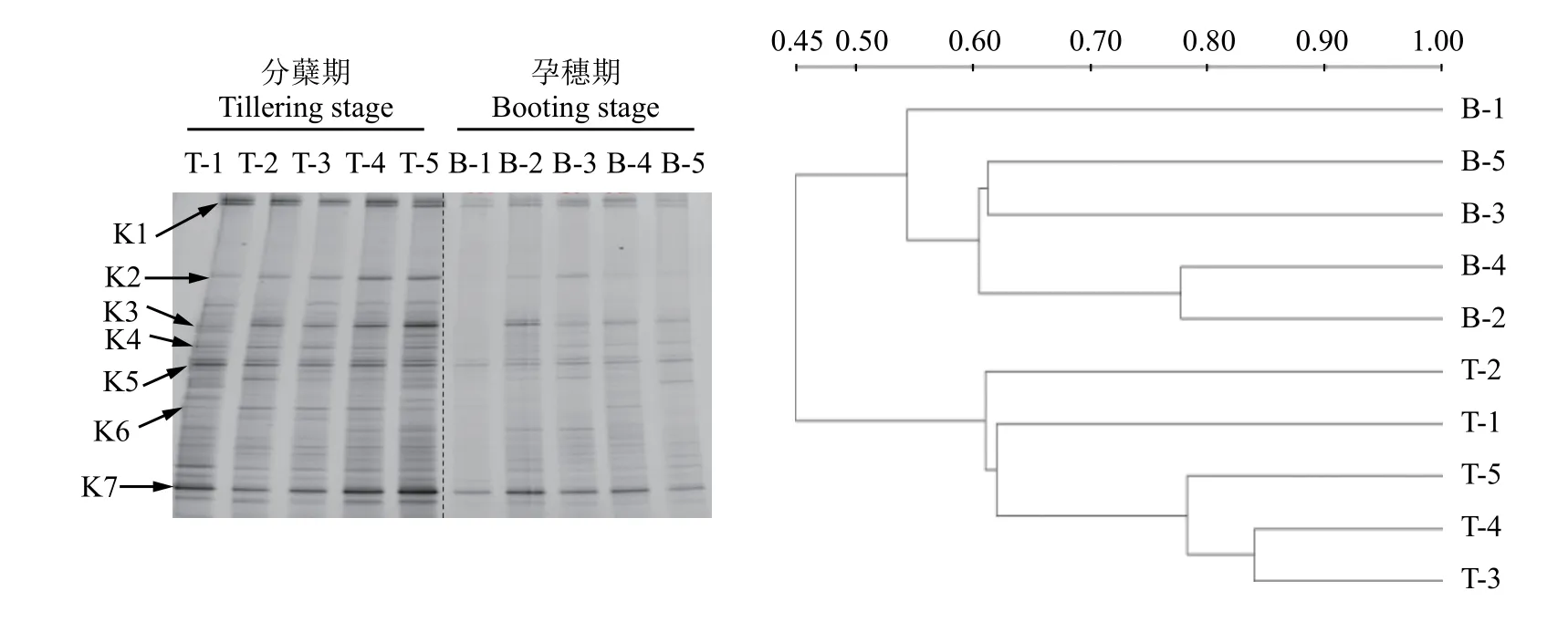
图9 反硝化细菌nirK基因的DGGE图谱及其聚类分析Fig.9 DGGE profile and clustering analysis of denitrifying bacterialnirKgene
有研究表明,土壤养分、pH以及施肥制度等环境因素对AOB、AOA的生长繁殖有不同程度的影响[25-28]。农田施入氮肥可明显促进AOB的生长[29],增加其丰度[30-31],而对AOA则无明显影响[32-33]。不同的硝化抑制剂对AOB以及AOA的影响不同,有的可显著抑制AOB的生长[34-37],对AOA没有明显影响[38];有的则效果相反[39-40],这可能由于不同抑制剂的作用机理不尽相同所致,因为抑制剂可通过抑制硝化菌的生长、呼吸[16,41-42]或活性[16]等多种方式来发挥作用。本研究表明,施用氮肥显著增加了分蘖期与孕穗期稻田土壤中AOB的丰度,然而添加硝化抑制剂DMPP在分蘖期能够有效抑制AOB的生长,到孕穗期对AOB的抑制作用消失,可能此时DMPP已降解所致。DMPP对AOA的生长则始终无明显的影响,这可能与本试验地的稻田土壤性质以及生态环境有关,或者由于AOA有较强的稳定性而导致。由此可知,DMPP在稻田减弱硝化反应的主要途径是通过抑制AOB的生长而实现。添加NBPT对AOA、AOB的丰度无明显影响,证明NBPT仅与土壤中的脲酶结合起作用,抑制其活性,对土壤微生物无明显的直接影响。
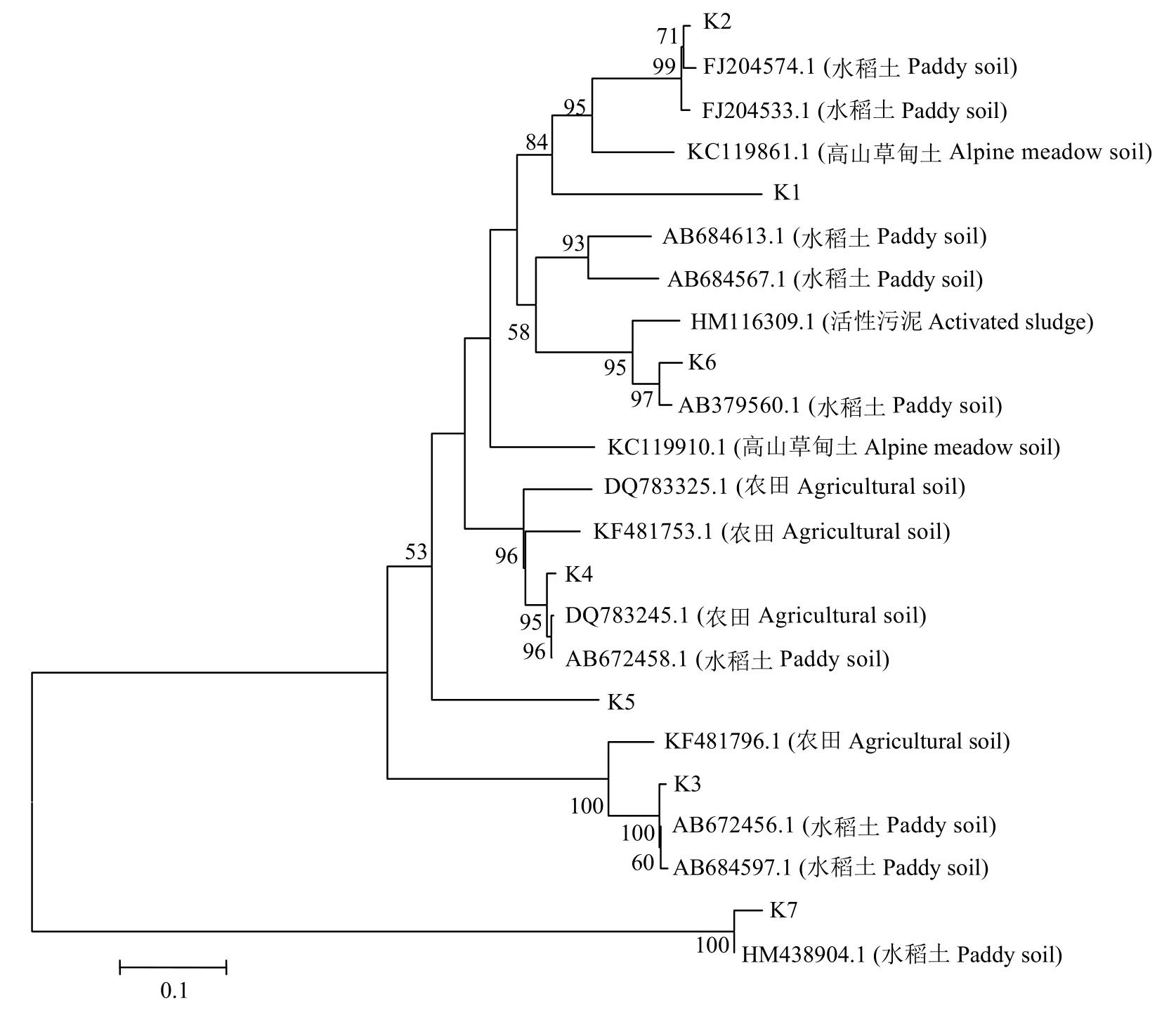
图10 反硝化细菌nirK基因的系统进化树Fig.10 Phylogenetic tree of denitrifying bacterialnirKgene based on DGGE band sequences using neighbor-joining analysis
土壤理化性质如土壤养分、含水量、pH、有机质等因素同样影响着反硝化细菌的群落结构和种群丰度[13,43]。有研究表明,施用氮肥可以明显提高反硝化细菌nirK、nirS基因的丰度[12,44-47]。本研究结果证明,施用氮肥可显著提高nirK型反硝化细菌的丰度,随着氮肥消耗,到孕穗期,所有处理下反硝化细菌的丰度明显下降,而添加抑制剂NBPT与DMPP的则没有表现出明显的变化,这说明氮肥可直接引起反硝化细菌的响应,不同生育期则可能通过土壤理化性质或土壤微生态的变化间接地影响反硝化细菌的丰度,而抑制剂则无此效应,进一步说明NBPT与DMPP对土壤环境的安全性。有报道指出,DMPP可通过降低底物浓度而间接影响nirK型反硝化菌的丰度[48],本研究没有监测到此种关联,可能由于所试稻田长期淹水,反硝化反应底物浓度极低所致。
有报道指出,在水稻田等pH较低的土壤中,AOA的数量远超过AOB的[49-50],且在氨氧化过程中发挥主导作用[38],同时,反硝化细菌nirK基因的拷贝数又远超过amoA(AOA + AOB) 基因的拷贝数[11]。本研究的结果也表明,古菌amoA/细菌amoA拷贝数比值大于6.1,而nirK/(细菌amoA+ 古菌amoA) 拷贝数比值大于11.1,与以上结论一致。
从三种菌群丰度与铵态氮、硝态氮含量的相关性分析来看,AOB与nirK反硝化细菌的丰度与分蘖期时期土壤中铵态氮、硝态氮含量以及孕穗期铵态氮含量呈极显著正相关,证明了二者对氮肥的敏感性,而AOA则没有此相关性,说明AOA的稳定性,与Chen等报道一致[32]。由于NBPT对铵态氮含量有明显的调节作用,由此推测,NBPT对AOB以及反硝化菌也有间接的影响。
施用化肥对土壤硝化、反硝化菌群落结构及其组成有着明显的影响[19]。本研究中DGGE指纹图谱表明,施用氮肥明显增加了图谱中AOB的条带数,随着氮肥的消耗,反应灵敏的优势菌群到了孕穗期信号强度明显减弱;施用氮肥对反硝化细菌群落结构的影响,主要体现在氮肥大量消耗后的孕穗期,此时,不施氮肥处理的DGGE图谱中优势菌群条带仅剩3条依稀可辨,远远少于施氮肥处理的;AOA在两个时期对氮肥均没有明显的响应。另外,抑制剂的施用在DGGE图谱中也没有表现出明显影响,可能由于DGGE图谱只是定性地反应群落组成,而抑制剂只对菌群丰度有影响,对其组成没有影响所致。
4 结论
1) NBPT显著提高了分蘖期土壤铵态氮含量,显著降低了孕穗期的铵态氮含量,AOB与nirK反硝化细菌的丰度与土壤中铵态氮、硝态氮含量有极显著正相关关系,AOA则与两种形态的氮相关性不显著,说明AOA比较稳定,AOB与反硝化细菌对氮肥有灵敏的响应,尤其是无机氮离子,而NBPT可调节铵态氮含量,因此,NBPT对AOB与nirK反硝化细菌的丰度可能有着间接的影响。
2) 硝化抑制剂DMPP对AOB有明显的抑制作用,但仅表现在分蘖期,孕穗期抑制作用基本消失,而对AOA以及反硝化细菌则始终没有明显影响,DMPP在稻田抑制硝化作用的途径是通过抑制AOB的生长来实现的。
3) DGGE图谱直观地反映了三种菌群对氮肥的响应,AOB与反硝化细菌的群落结构在施用氮肥下条带数明显增加,而AOA则无明显响应,再次证明AOB与反硝化细菌对氮肥的敏感性以及AOA的稳定性。
4) 脲酶抑制剂NBPT对三类微生物的群落结构以及丰度没有明显的直接影响,硝化抑制剂DMPP仅在分蘖期对AOB的生长有抑制作用,这说明NBPT与DMPP对土壤生态的安全性。
