SH2B1对肝癌细胞增殖、凋亡及Akt/mTOR通路的影响
2019-07-12周正,郑伟
周 正,郑 伟
(中国医科大学附属盛京医院肿瘤科,沈阳 110000)
肝癌是我国常见、危害极大的恶性肿瘤,以原发性肝癌较为常见,其病因及确切分子机制尚不完全明确[1-2]。肝癌早期症状不明显,多数一经发现即为晚期,研究肝癌发生、发展分子学机制对于肝癌的诊治具有重要意义[3]。Src同源性2 b衔接蛋白1(Src homology 2 binding protein 1,SH2B1)是含有SH2和PH结构域的信号接头蛋白,在代谢平衡、免疫调节方面发挥重要作用,与多种恶性肿瘤的增殖、迁移过程有关。研究发现,SH2B1在非小细胞肺癌、肺腺癌等恶性肿瘤患者癌组织中高表达,但在肝癌中研究较少[4-6]。本研究重点探讨肝癌细胞株HepG2中SH2B1表达水平异常情况及沉默SH2B1表达对肝癌细胞增殖、凋亡以及蛋白激酶B/哺乳动物雷帕霉素靶蛋白(protein kinase B/mammalian target of rapamycin,Akt/mTOR)通路的影响,为临床治疗肝癌提供新的理论依据。
1 材料与方法
1.1材料 人正常肝细胞株QSG-7701、肝癌细胞株HepG2均购自中国科学院细胞库;慢病毒载体系统、Lipofectamine 2000购自美国Invitrogen公司;Trizol、二喹啉甲酸提取试剂盒购自南京凯基生物科技发展有限公司;改良杜氏伊格尔培养基(Dulbecco′s modified eagle medium,DMEM)、RPMI(Roswell Park Memorial Institute)1640培养基购自南通市百奥迈科生物技术有限公司;细胞计数试剂盒-8(cell counting Kit-8,CCK-8)实验相关试剂购自美国Promega公司;鼠源一抗[SH2B1、Bax、Bcl-2、caspase-3、p-Akt、Akt、mTOR、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)]、二抗(辣根过氧化物酶标记的山羊抗鼠)购自美国Cell Signal Technology。
1.2方法
1.2.1荧光实时定量聚合酶链反应法检测肝癌细胞中SH2B1 mRNA表达情况 采用荧光实时定量聚合酶链反应法测定正常肝细胞株QSG-7701、肝癌细胞株HepG2及重组转染后各组细胞中SH2B1 mRNA相对表达量。根据SH2B1序列设计mRNA引物,以GAPDH为内参,并交由生工生物工程(上海)股份有限公司合成,SH2B1引物序列为5′-GCGCATCGTTACCATCATCACG-3′,3′-TTCTTCCTCTGTCCGACGGTCT-5′,GAPDH引物序列为5′-ATTGGAAC-GATACAGAGAAGATT-3′,3′-GGAACGCTTCACGAATTTG-5′。通过Trizol试剂盒提取细胞总RNA,并将2 μg RNA反转录为cDNA。配置实时定量聚合酶链反应体系,完成后将其放入荧光定量聚合酶链反应仪上进行反应,程序设定为:95 ℃预处理5 s,95 ℃ 15 s,60 ℃ 30 s,72 ℃ 15 s,以上3个步骤共循环40次。反应结束后对Ct值进行数据分析,采用2-ΔΔCt算法[7]计算SH2B1 mRNA相对表达量。
1.2.2细胞培养 从液氮罐中取出装有人正常肝细胞株QSG-7701、肝癌细胞株HepG2细胞的冻存管,于37 ℃水浴锅中快速解冻,待其完全解冻后置于离心管内,离心半径10 cm,1 000 r/min离心5 min,弃上清,加1 mL DMEM培养基悬垂细胞,吹打混匀,吸入无菌培养瓶,加入4 mL培养基混匀,置于温度为37 ℃、体积分数为5% CO2的恒温培养箱中,培养24 h。按照实验室方法进行细胞传代,取第3代进行细胞接种。
1.2.3重组慢病毒转染HepG2细胞获得稳定转染细胞株 针对SH2B1基因利用软件设计合成两条单链DNA Oligos,将两条DNA oligos退火配对产生双链,与慢病毒载体GV248连接,构建重组慢病毒载体[SH2B1-短发夹RNA(short hairpin RNA,shRNA)-绿色荧光蛋白(green fluorescent protein,GFP)-GV248作为SH2B1 shRNA组、NC-shRNA-GFP-GV248作为NC shRNA组],同时以一段不针对任何基因的无关序列作为空白组,采用DMEM培养基(10%胎牛血清)培养293T细胞至细胞密度为70%,用Lipofectamine 2000将重组慢病毒载体与辅助质粒转染293T细胞,培养6 h,更换新鲜培养基,48 h后在4 ℃环境中放置15 min,以离心半径10 cm,1 500 r/min 离心5 min,弃去细胞碎片,收集上清(包含病毒),-80 ℃保存。取对数生长期的HepG2细胞于转染前1 d接种于12孔板,每孔5×104个细胞,37 ℃,5% CO2条件下培养,按感染复数值感染细胞(感染复数为50),加入5 μg/mL的聚凝胶。24 h后更换为含胎牛血清的RPMI 1640培养基,此后每隔2天换液一次,当转染效率达到80%以上时,加入嘌呤霉素进行压力筛选出稳定转染细胞株。
1.2.4免疫印迹法(Western blot法)检测SH2B1蛋白及Akt/mTOR通路相关蛋白表达 取1.2.3中各组细胞,加入RIPA(Radio Immunoprecipitation Assay Lysis Buffer)裂解液,使用超声波在室温下匀浆,4 ℃离心半径10 cm,10 000 r/min离心15 min,取上清液。使用BCA蛋白试剂盒测定细胞中总蛋白含量,制备电泳凝胶,进行聚丙烯酰胺凝胶电泳,转移蛋白至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜,0.01 mol/L的磷酸缓冲盐溶液洗膜(5 min×3次),封闭。封闭完成后加入适宜浓度一抗(SH2B1,Bax、caspase-3、Bcl-2、p-AKT,AKT,mTOR,1∶1 000),4 ℃封闭过夜,24 h后弃去一抗,清洗PVDF膜,加入相应二抗(辣根过氧化物酶偶联的山羊抗鼠),37 ℃封闭2 h,弃去二抗,清洗PVDF膜,滴加电化学发光显色液,通过凝胶成像系统捕获蛋白条带图,使用Tanon 600图像分析系统拍照并进行定量分析,以GAPDH为内参。
1.2.5CCK-8法检测细胞增殖能力 各组培养0、24、48、72、96 h时吸光度值,按照1.2.3分组,取对数生长期SH2B1细胞放入离心管内,以离心半径10 cm,1 000 r/min离心5 min弃上清,加入含10%胎牛血清的RPMI 1640培养基,吹打混匀,制成细胞悬液,取10 μL细胞悬液,加入含1 mL RPMI 1640的微量离心管内,吹打混匀,取10 μL稀释细胞悬液,细胞计数板计数,以1.0×105个/mL细胞密度接种于12孔板,每孔100 μL,每组3个复孔。在37 ℃、5% CO2、饱和湿度条件下分别培养24、48、72、96 h,每孔加入10 μL浓度为1.5 mg/mL的CCK-8,在培养箱内孵育4 h后,读取吸光度值(A),绘制细胞生长曲线,测定时以未接种细胞只加培养基孔的A值为空白对照调零。
1.2.6双染流式细胞术检测细胞凋亡能力 使用磷脂酰丝氨酸蛋白抗体/碘化丙啶(phosphatidylserine protein antibody/propidium iodide,Annexin V/PI)细胞凋亡检测试剂盒及流式细胞仪检测细胞凋亡情况。3组细胞缺氧培养48 h,胰酶消化收集细胞,预冷磷酸缓冲盐溶液洗涤2次,离心弃上清液,配制成1×106个/mL的细胞悬液,100 μL细胞悬液加入5 μL磷脂酰丝氨酸蛋白抗体-异硫氰酸荧光素(phosphatidylserine protein antibody/fluorescein isothiocyanate,Annexin V-FITC)和5 μL磷脂酰丝氨酸混匀,室温避光孵育15 min,流式细胞仪检测凋亡率。实验重复3次。
2 结 果
2.1肝癌细胞中SH2B1表达情况 与正常肝细胞相比,肝癌细胞中SH2B1 mRNA、SH2B1蛋白相对表达量显著升高(P<0.05)。见图1、表1。
2.2HepG2细胞慢病毒转染后SH2B1表达变化 各组SH2B1 mRNA、SH2B1蛋白表达比较差异有统计学意义(P<0.01),与空白组、NC shRNA组相比,SH2B1 shRNA组SH2B1 mRNA、SH2B1蛋白表达显著降低(P<0.05)。见图2、表2。

a:正常肝细胞;b:肝癌细胞图1 两组肝细胞中SH2B1蛋白表达情况表1 两组肝细胞中SH2B1 mRNA、SH2B1蛋白相对表达情况比较
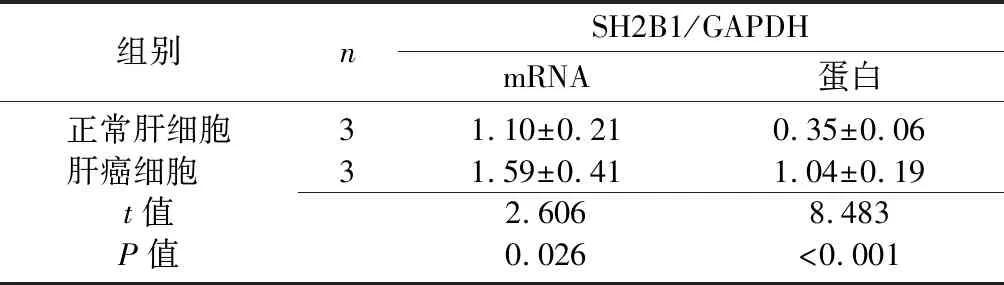
组别nSH2B1/GAPDHmRNA蛋白正常肝细胞31.10±0.210.35±0.06肝癌细胞 31.59±0.411.04±0.19t值2.6068.483P值0.026<0.001
SH2B1:Src同源性2b衔接蛋白1;GAPDH:甘油醛-3-磷酸脱氢酶

a:空白组;b:NC shRNA组;c:SH2B1 shRNA组图2 慢病毒转染后HepG2细胞SH2B1蛋白表达情况
2.3沉默SH2B1表达对HepG2细胞增殖的影响 各组转染24 h、48 h、72 h、96 h后OD值呈下降趋势
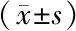

组别nSH2B1/GAPDHmRNA蛋白空白组31.06±0.211.03±0.18NC shRNA组31.04±0.191.02±0.17SH2B1 shRNA组30.57±0.09ab0.64±0.10abF值15.67612.481P值<0.0010.001
NC:阴性对照组;shRNA:短发夹RNA;SH2B1:Src同源性2b衔接蛋白1;GAPDH:甘油醛-3-磷酸脱氢酶;a与空白组比较,P<0.05;b与NC shRNA组比较,P<0.05
(P<0.05);与空白组相比,NC shRNA组各时间点OD值差异无统计学意义(P>0.05);与NC shRNA组和空白组相比,SH2B1 shRNA组转染48 h、72 h、96 h后OD值显著降低(P<0.05);各组在组间、时点间、组间和时点间交互作用比较差异均有统计学意义(P<0.05)。见表3。
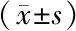
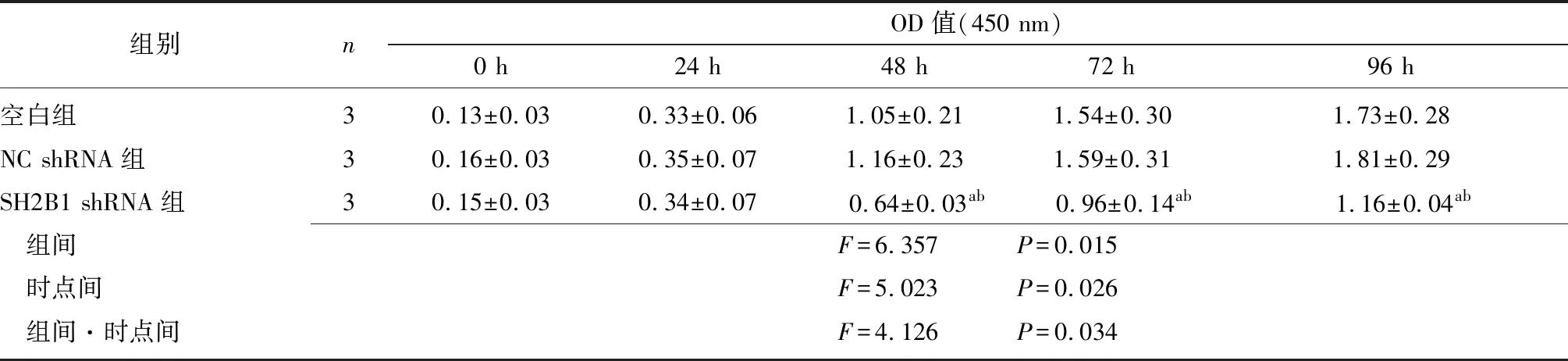
组别nOD值(450 nm)0 h24 h48 h72 h96 h空白组30.13±0.030.33±0.061.05±0.211.54±0.301.73±0.28NC shRNA组30.16±0.030.35±0.071.16±0.231.59±0.311.81±0.29SH2B1 shRNA组30.15±0.030.34±0.070.64±0.03ab0.96±0.14ab1.16±0.04ab 组间F=6.357 P=0.015 时点间F=5.023 P=0.026 组间·时点间F=4.126 P=0.034
NC:阴性对照组;shRNA:短发夹RNA;SH2B1:Src同源性2b衔接蛋白1;a与空白组比较,P<0.05;b与NC shRNA组比较,P<0.05
2.4沉默SH2B1表达对HepG2细胞凋亡的影响 空白组、NC shRNA组、SH2B1 shRNA组凋亡率分别为(13.21±2.13)%、(17.62±2.18)%和(30.62±4.16)%,各组比较差异有统计学意义(F=27.725,P<0.001),空白组与NC shRNA组细胞凋亡率比较差异无统计学意义(P>0.05),与空白组、NC shRNA组相比,SH2B1 shRNA组细胞凋亡率显著升高(P<0.05)。
2.5沉默SH2B1表达对HepG2细胞凋亡相关蛋白的影响 各组Bax、Bcl-2、caspase-3蛋白水平比较差异有统计学意义(P<0.05),空白组与NC shRNA组Bax、Bcl-2、caspase-3蛋白水平比较差异无统计学意义(P>0.05),与空白组、NC shRNA组相比,SH2B1 shRNA组细胞中Bax、caspase-3蛋白水平显著上升(P<0.05),Bcl-2蛋白水平下降(P<0.05)。见图3、表4。

a:空白组;b:NC shRNA组;c:SH2B1 shRNA组图3 免疫印迹检测凋亡相关蛋白表达表4 各组凋亡相关蛋白表达情况比较

组别nBax/GAPDHBcl-2/GAPDHcaspase-3/GAPDH空白组30.32±0.060.54±0.110.33±0.07NC shRNA组30.34±0.070.51±0.100.32±0.06SH2B1 shRNA组30.73±0.15ab0.34±0.02ab0.85±0.17abF值15.51310.92022.115P值0.0040.010<0.01
NC:阴性对照组;shRNA:短发夹RNA;SH2B1:Src同源性2b衔接蛋白1;GAPDH:甘油醛-3-磷酸脱氢酶;a与空白组比较,P<0.05;b与NC shRNA组比较,P<0.05
2.6沉默SH2B1表达对Akt/mTOR通路的影响 各组p-Akt、mTOR蛋白表达比较差异有统计学意义(P<0.05),空白组与NC shRNA组比较p-Akt、mTOR蛋白表达差异无统计学意义(P>0.05),与空白组和NC shRNA组比较,SH2B1 shRNA组p-AKT、mTOR蛋白水平明显降低(P<0.05)。见图4、表5。

a:空白组;b:NC shRNA组;c:SH2B1 shRNA组图4 Akt/mTOR通路相关蛋白表达情况表5 各组Akt/mTOR通路相关蛋白表达情况比较
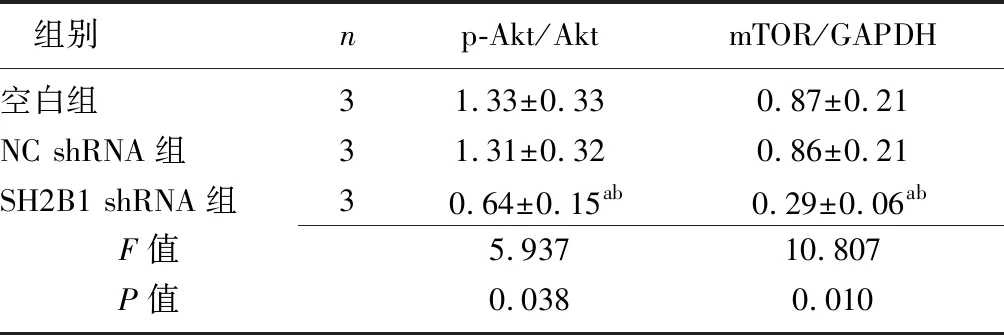
组别np-Akt/AktmTOR/GAPDH空白组31.33±0.330.87±0.21NC shRNA组31.31±0.320.86±0.21SH2B1 shRNA组30.64±0.15ab0.29±0.06abF值5.93710.807P值0.0380.010
NC:阴性对照组;shRNA:短发夹RNA;SH2B1:Src同源性2b衔接蛋白1;Akt:蛋白激酶B;mTOR:哺乳动物雷帕霉素靶蛋白;GAPDH:甘油醛-3-磷酸脱氢酶;a与空白组比较,P<0.05;b与NC shRNA组比较,P<0.05
3 讨 论
SH2B1属于SH2B家族,包含SH2和PH区域,在生长发育、免疫调节、代谢平衡中发挥重要作用[6]。SH2B1过往研究多集中在脂肪调控、血糖控制等代谢类疾病方面[7-8],近年来研究发现SH2B1在胃癌、肺癌等恶性肿瘤中存在异常表达[9-10]。Liu等[9]研究表明,SH2B1在胃癌中高表达,且参与胃癌增殖、侵袭、迁移过程。Zhang等[10]研究表明,SH2B1在非小细胞肺癌组织及非小细胞肺癌细胞株中高表达。本研究中,SH2B1在肝癌细胞株HepG2中表达显著高于人正常肝细胞株,推测SH2B1高表达可能与肝癌的发生、发展相关。借助慢病毒载体转染SH2B1后,HepG2细胞中SH2B1 mRNA、SH2B1蛋白表达量显著降低,提示本研究转染效率较高。
癌细胞增殖能力强是癌症发展迅速的原因之一[11]。本研究结果显示,转染SH2B1 shRNA 24 h,HepG2细胞增殖缓慢,且3组间比较差异无统计学意义(P>0.05),48 h后SH2B1 shRNA组OD值显著低于空白组及NC shRNA组,提示沉默SH2B1表达对肝癌细胞增殖有一定抑制作用。研究表明,下调胃癌细胞中SH2B1表达后,胃癌细胞凋亡率显著升高[12]。本研究中流式细胞术检测显示,沉默SH2B1表达后细胞凋亡率显著升高,与在胃癌中表达一致,此外促凋亡相关蛋白Bax、凋亡执行蛋白caspase-3表达增加,抑制凋亡蛋白Bcl-2表达下降,提示沉默SH2B1表达可促进细胞凋亡相关蛋白表达和HepG2细胞凋亡,控制肝癌细胞生长速度。
Akt/mTOR信号通路参与控制细胞自噬、运动、增殖、生长及存活等多种细胞过程,其激活异常与人类多种疾病有关,大量研究发现,其在肿瘤细胞的发生、发展过程中发挥重要作用[12-14]。研究表明Akt/mTOR信号通路在肝癌中存在异常激活,阻断Akt/mTOR信号通路是治疗肝癌的新思路[15-17]。Akt是细胞存活的主要调节因子,通过直接抑制促凋亡蛋白或抑制由转录因子产生促凋亡信号参与调解细胞存活[18]。mTOR底物磷酸化可增强合成代谢或限制分解代谢,从而促进细胞生长[19]。本研究中,沉默SH2B1表达后,Akt磷酸化、mTOR蛋白水平显著降低,提示沉默SH2B1表达可能抑制Akt磷酸化、mTOR蛋白表达,推测一方面Akt磷酸化降低可直接促进促凋亡蛋白Bax、caspase-3表达,促进肝癌细胞凋亡,另一方面Akt磷酸化引起级联反应,抑制mTOR蛋白表达,抑制肝癌细胞的增殖,具体机制有待进一步研究。
综上所述,SH2B1在肝癌中高表达,沉默SH2B1表达可抑制肝癌细胞增殖,促进细胞凋亡,其机制可能是通过抑制Akt/mTOR信号通路活性发挥作用的。提示SH2B1可能作为治疗肝癌的靶点,具有一定的应用前景。但本研究也存在不足,SH2B1通过Akt/mTOR信号通路抑制肝癌细胞增殖、促进凋亡的相关机制有待进一步探究。
