NaCl-KCl-MgCl2熔盐Mg2+在钨电极上的电化学还原机理
2019-07-12田亚斌董泉叶昌美黄晶明王昭文杨凤丽杨少华
田亚斌, 董泉, 叶昌美, 黄晶明, 王昭文, 杨凤丽, 杨少华
(江西理工大学冶金与化学工程学院,江西 赣州341000)
金属镁在有色金属材料中占据着重要的地位,因其能与其他金属制成性能优异的合金,广泛应用于航空航天、高铁、医学等诸多领域[1-6].金属镁的生产方式主要有2种:分别为热还原法和电解法.热还原法需要在真空以及上千摄氏度的高温下进行,对设备以及操作要求较高,并且操作流程较长,存在效率低、能耗高等问题[7].电解法凭借流程短,设备简单易操作,提取金属纯度高等优点适用于工业实践当中.
为了搞清Mg2+的还原机理,促使一大批研究者进行了深入的研究,其中唐浩等[8]研究了723 K温度时LiCl-KCl-MgCl2熔盐中Mg2+的电化学还原过程,认为Mg2+的阴极析出是1步反应转移2个电子过程.因电解质当中LiCl极易吸水,杨少华等[9]选取氟化物电解质体系研究了1 173 K时LiF-MgF2-BaF2-KCl体系当中以MgO为原料Mg2+的电化学还原过程,认为Mg2+在钨电极上是受扩散控制的1步反应转移2个电子的不可逆过程.王姗姗等[10]研究了873 K在LiCl-KCl熔盐中Ni电极上Mg2+的电化学行为,认为是1步反应得2个电子析出过程,且在Mg2+析出前存在欠电位合金化过程.
工业生产注重效益同时兼顾环保,故原料需来源广泛、廉价且产生的废料等易于处理.因LiCl与LiF价格昂贵,故选取氯化物体系当中LiCl-X体系或氟化物体系当中LiF-X体系不利工业效益最大化;而氟化物体系对设备腐蚀性较强,增加了隐性成本,且氟化物难于处理,故选取氯化物体系中廉价的NaCl-KCl可以做到效益最大化,且产生的氯气易于回收,兼顾了环保.随着近年来MgCl2生产工艺的成熟[11-12],致使MgCl2纯度以及产能提升,价格下降.文中以NaCl-KCl为电解质体系,替代LiCl-X体系或LiF-X体系,以MgCl2为原料,于1 073 K温度下利用电化学工作站设备通过电化学暂态技术,研究Mg2+在钨电极上的电化学还原过程,期望解析Mg2+在钨电极上的电化学还原机理,为工业生产起到指导意义.
1实 验
1.1 实验原料及试剂
实验当中所使用的原料及试剂见表1.
实验当中所使用的三电极参数如表2所列.
实验简易装置示意图如图1所示.

表1 原料及试剂参数Table 1 Raw materials and reagents

表2 三电极体系的规格参数Table 2 Specification parameters of three electrodes system

图1 电化学测试装置示意Fig.1 Electrochemical test device schematic
1.2 实验过程
将NaCl、KCl、无水氯化镁、坩埚以及洁净的刚玉管一并置于160℃烘箱内烘24 h,然后将烘干的电解质NaCl-KCl迅速准确称量按照摩尔比1∶1混合均匀后置于干燥箱内待用.实验前配置1 mol/L的NaOH溶液,将钨丝、钨棒在实验前浸泡2 h.实验时用无水乙醇与去离子水将工作电极与辅助电极表面冲洗干净,晾干后用砂纸打磨至镜面,参比电极仅使用细的金相砂纸打磨光亮即可.然后将钨丝与铂丝外套刚玉管与钨棒固定住组成三电极体系.将称好的NaCl-KCl-MgCl2置于刚玉坩埚内放置于电阻炉内缓慢加热至1 073 K,待炉内温度稳定30 min后,使用提拉炉精准控制三电极的升降操作.最后使用电化学工作站设备进行实验数据的测量及存储.
2 结果与讨论
2.1 循环伏安法
温度为1 073 K时,NaCl-KCl-MgCl2熔盐体系当中相关化合物的理论分解电动势如表3所列.

表3 理论分解电动势Table 3 Theoretical decomposition potential
从表3的理论分解电动势可以初步判断,MgCl2的理论分解电动势最正,在NaCl-KCl-MgCl2熔盐体系当中,Mg2+会优先在工作电极上得电子析出.故选取NaCl-KCl电解质体系研究Mg2+在钨电极上的电化学机理合理.
为了更好地研究NaCl-KCl-MgCl2熔盐中Mg2+在钨电极上的电化学还原机理,首先对NaCl-KCl电解质进行循环伏安曲线测试,其结果如图2所示,从图2中可以看出电位在-2.0 V到-0.5 V之间,无氧化还原峰的产生,表明在-2.0 V到-0.5 V电势范围内,NaCl-KCl电解质的电化学性质稳定.当扫描电位从-2.0 V继续向负方向扫描,此时电解质当中的Na+开始得电子析出,随着扫描电位向负方向进一步增大K+开始得电子析出.
在NaCl-KCl电解质体系当中添加原料1%MgCl2(质量百分数,下同),在1 073 K温度下,对熔盐体系进行循环伏安测试,结果如图3所示.
从图3可以看出,电位负向扫描时在-1.38 V附近存在一个还原峰R1,电位正向回扫时在-0.90 V附近存在一个与还原峰 R1相对应的氧化峰 O1,表明:Mg2+在钨电极上的电化学还原是1步反应转移2个电子过程.随着扫描速率的增大,Mg2+还原峰电位负向移动.同时氧化峰电流(IPO)与还原峰电流(IPR)存在:|IPO/IPR|>1.5,且氧化峰与还原峰对称性较差,表明Mg2+在钨电极上的电化学还原是不可逆过程.

图2 1 073 K时NaCl-KCl电解质的循环伏安曲线(S=0.322 cm2)Fig.2 Cyclic voltammetry curve of NaCl-KCl electrolyte at 1 073 K(S=0.322 cm2)
根据Randles-seveik方程[13-14]:

对图3循环伏安数据作Ip-v1/2关系曲线,结果如图4所示.
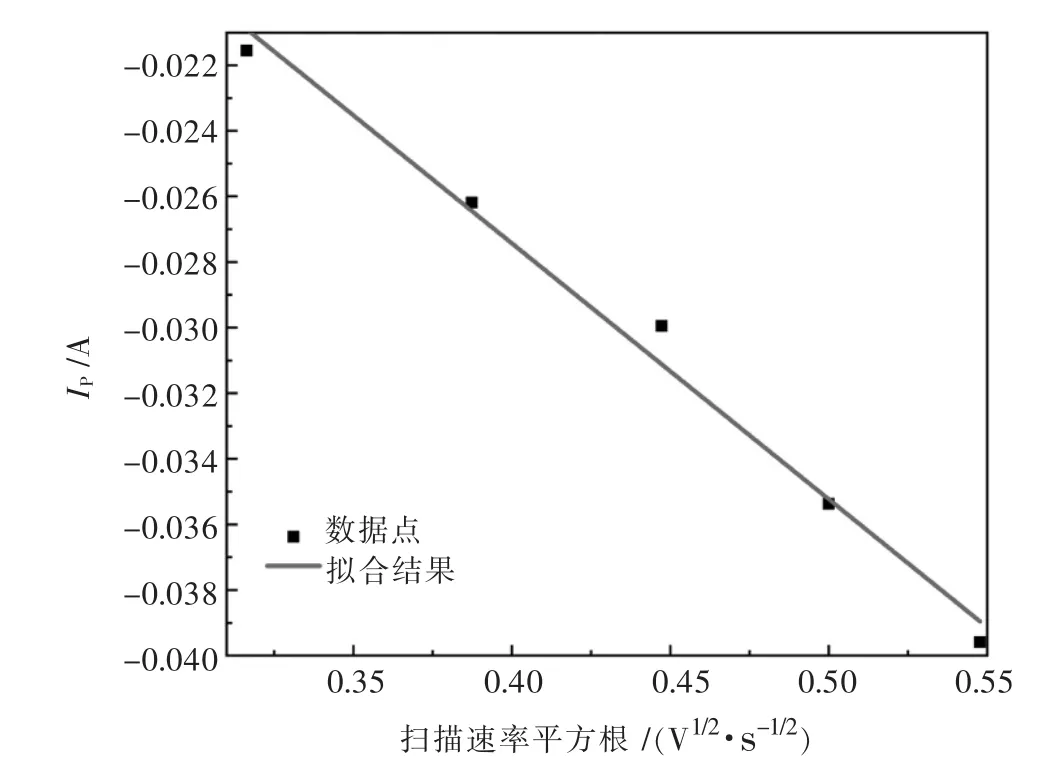
图4 1 073 K时还原峰值电流Ip与扫描速率v1/2关系曲线Fig.4 Relationship between reduction peak current Ipand scan rate v1/2at 1 073 K
从图4可以看出拟合曲线呈良好线性,即Ip-v1/2有良好的线性关系,符合Randles-seveik方程,表明:1 073 K时NaCl-KCl-1%MgCl2熔盐Mg2+在钨电极上的电化学还原受扩散控制.
根据Heyrovsky-llkovic方程[15-17]:
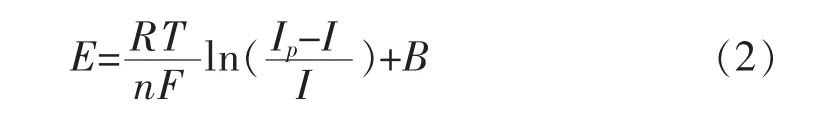
对图3中扫描速率为0.1 V/s的循环伏安峰值处数据作 E-ln[(Ip-I)/I]关系曲线,结果如图 5所示.

图 5 1 073 K 时 E-ln[(Ip-I)/I]关系曲线Fig.5 Relationship between E and ln[(Ip-I)/I]at 1 073 K
从图 5 可以看出 E-ln[(Ip-I)/I]之间呈线性,且拟合方程斜率为 0.049 27,即 RT/(nF)=0.049 27,n≈2.验证了R1峰即为Mg2+的还原峰.
2.2 计时电位法
为了进一步验证循环伏安测试结果的可靠性.1 073 K时,以MgCl2为原料,NaCl-KCl为电解质,测试NaCl-KCl-1%MgCl2熔盐中Mg2+在钨电极上的不同恒电流条件下的计时电位曲线,结果如图6所示.

图6 1 073 K时不同恒电流条件下镁在钨电极上的计时电位曲线(S=0.322 cm2)Fig.6 Chronopotentiometry curve of magnesium on tungsten electrode under different constant current conditions at 1 073 K(S=0.322 cm2)
从图6可以看出,在-1.38 V附近与-2.5 V附近存在2个平台,其中第1个平台电位对应循环伏安曲线测试的R1峰析出电位,即Mg2+的析出电位.第2个平台电位对应电解质体系当中Na+与K+的析出电位.计时电位测试结果进一步验证了循环伏安测试结果的准确性.同时进一步说明了Mg2+在钨电极上是1步反应转移2个电子过程.此外发现随着施加电流强度的增加,过度时间在不断减小,电位平台向负方向移动,表明:1 073 K时NaCl-KCl-MgCl2熔盐中,Mg2+在钨电极上的电化学还原是受扩散控制的不可逆过程.
2.3 计时电流法
在NaCl-KCl为电解质,MgCl2为原料,1 073 K时根据循环伏安当中Mg2+的析出电位范围内,测试镁在钨电极上的计时电流曲线,其结果如图7所示.
图7中电流迅速衰减即金属镁晶粒开始形成,当电流达到一定值后镁的新相开始形成不再继续长大,进而形成粉体从钨电极表面脱落,电流信号发生轻微的增大,随着Mg2+的不断析出,电极表面的Mg2+浓度下降,熔盐当中Mg2+向电极表面的扩散与Mg2+的析出最终会达到一个平衡状态.
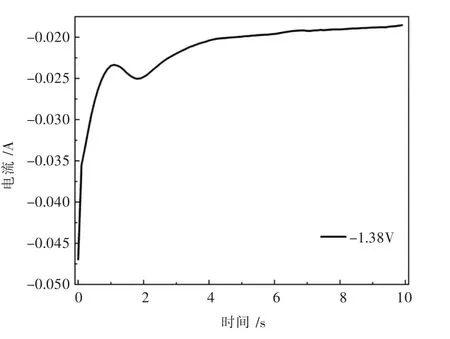
图7 1 073 K时Mg2+在钨电极上的计时电流曲线(S=0.322 cm2)Fig.7 Chronoamperometry of Mg2+on tungsten electrode at 1 073 K(S=0.322 cm2)
Mg2+在钨电极上的电化学还原受扩散控制,为了确定Mg2+的扩散系数引入Cottrel方程.
Cottrel方程:
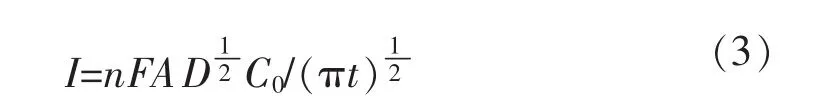
对计时电流曲线数据作I-t1/2关系图,结果如图8所示.

图8 I与t-1/2的关系Fig.8 Relationship between I and t-1/2
根据方程 (3)计算出熔盐中Mg2+的扩散系数为3.81×10-6cm2/s
为了进一步研究Mg2+在钨电极上的电结晶成核方式,使用2种成核理论进一步分析[18].
对于瞬时成核存在方程(4):

对于渐进成核存在方程(5):

图9和图10所示分别为1 073 K时在恒电位-1.38 V时极化电流I与t1/2和I与t3/2关系曲线.对比图9、图10可以看出:I-t3/2线性关系较差,I-t1/2之间呈良好的线性关系,符合瞬时成核方程.表明:Mg2+在钨电极上的电结晶过程是瞬时成核方式.

图9 I-t1/2/s1/2关系曲线Fig.9 Relationship between I and t1/2

图10 I-t3/2/s3/2关系曲线Fig.10 Relationship between I and t3/2
3结 论
1)1 073 K 时, 以MgCl2为原料,NaCl-KCl-1%MgCl2熔盐中Mg2+在钨电极上的电化学还原是1步反应转移2个电子的不可逆过程,电极反应为:Mg2++2e-→Mg.
2)1 073 K 时,NaCl-KCl-1%MgCl2熔盐中,Mg2+在钨电极上的电结晶过程是瞬时成核方式.
