中华蟾蜍消化道生长抑素免疫反应细胞形态和分布密度的增龄变化
2019-07-11刘溯源姚利汪寅伍亮张志强
刘溯源,姚利,汪寅,伍亮,张志强
(1安徽农业大学动物科技学院动物医学系,2安徽农业大学动物科技学院水产养殖学系,合肥 230036)
关于脊椎动物消化道内分泌细胞的增龄变化,大多数研究集中于哺乳动物,如小鼠[1]、大熊猫(Ailuropoda melanoleuca)[2]和长爪沙鼠(Merionesunguiculatus)[3]等。两栖动物变态发育,变态前后消化道内分泌细胞的形态学特征和分布密度变化较大[4-8],但关于登陆后不同年龄段间的比较研究很少[9-10]。生长抑素(Somatostatin SS)细胞参与动物消化功能的调节过程,抑制胃泌素等激素的分泌,对肠道细胞起保护作用[11-12]。中华蟾蜍(Bufo gargarizans)变态前后多种消化道内分泌细胞的出现时间早晚不同,SS细胞在变态高峰期数量较少,见于胃部和十二指肠,幼蟾期分布于食管至空肠各段,且分布密度明显增加[6]。本研究进一步以幼体、亚成体和成体雄性中华蟾蜍为研究对象,对其登陆后消化道SS细胞的形态学特征和分布密度进行比较,将为深入理解其消化生理特征提供形态学基础。
材料和方法
1 实验材料
实验用雄性中华蟾蜍于2018年7月中下旬捕自安徽省合肥市包河区大圩镇晓南村池塘(117.38°E、31.76°N),取幼体、亚成体和成体各8只,体重分别为(8.763 ± 0.945)g、(21.325 ± 0.392)g 和(70.425 ± 5.089)g,体长分别为(4.6 ± 0.1)cm、(6.3 ± 0.1)cm和(8.9 ± 0.2)cm。用双毁髓法处死不同年龄组的动物,之后解剖取出消化道,取食管、贲门、胃底、幽门、十二指肠、空肠、回肠和直肠各段,每段长约0.5~1cm。去除消化道内容物后,各段组织固定于改良的Bouin’s液(不含冰醋酸)中18~24h,再经常规梯度乙醇脱水、二甲苯透明、石蜡包埋后,用轮转切片机(浙江省金华市科迪仪器设备有限公司,型号:KD-2258)切片,片厚4~5μm。
2 免疫组织化学染色
参照牛鑫鑫等[13]对花背蟾蜍(Pseudepidalea raddei)的研究方法,用卵白素-生物素-过氧化物酶复合物(ABC)法免疫组织化学染色鉴别和定位不同年龄中华蟾蜍消化道各段中的SS细胞。其中,兔抗人生长抑素单克隆抗体(ZA-0567)和兔链霉卵白素-生物素法检测系统(SP-9001)购自北京中杉金桥生物技术有限公司,一抗和试剂盒均为美国ZYMED公司产品。染色程序简述如下:石蜡切片常规脱蜡至水后,先经3%H2O2甲醇溶液处理切片10min,用于消除内源性过氧化物酶的活性;之后,再将切片用正常山羊血清孵育10min,用来封闭非特异性反应部位,用滤纸吸取羊血清至切片上只有一层薄膜覆盖为止,迅速滴加约50µl的一抗(SS抗血清)覆盖全部材料,置于孵育盒中4℃过夜。滴加生物素化的二抗(生物素标记山羊抗兔IgG聚合物)和辣根酶标记链霉卵白素复合物(SABC)工作液,含有二抗和SABC的切片均在室温条件下孵育1 h,滴加前后均用磷酸盐缓冲液清洗切片3次,每次5 min。阳性细胞通过DAB-H2O2染色试剂盒来显示,镜检控制染色程度,并及时终止阳性反应,之后用稀释20倍的苏木精溶液复染,经常规脱水和透明处理后,中性树胶封片。阴性对照片以正常羊血清和磷酸盐缓冲液代替一抗,其余步骤同上。
3 SS阳性细胞计数与拍照
用Motic-BA 210型显微镜观察切片,计数SS阳性细胞的数量,并拍照,放大倍数为400×。每一年龄组的8只蟾蜍,每只蟾蜍从食管至直肠的8个部位,每个部位均随机选取1张切片,每张切片计数3个视野,以3个视野的平均值表示该只蟾蜍该部位SS细胞的分布密度,以8只蟾蜍的平均值表示该年龄组该部位SS细胞的分布密度。
4 统计与分析
用SPSS 19.0 for windows进行数据处理。以双因素方差分析(Two-wayANOVA)(年龄×消化道部位)统计不同年龄组消化道不同部位SS细胞分布密度的差异。以单因素方差分析(One-wayANOVA)及多重比较(Multiple comparisons)post hoctest统计同一年龄组消化道不同部位、不同年龄组同一部位SS细胞分布密度的差异。文中数据均以平均值± 标准误(Mean ± SE)表示,P< 0.05为差异显著,P< 0.01为差异极显著。
结 果
1 消化道SS细胞形态学特征的增龄变化
形态学上,SS细胞分为闭合型细胞和开放型细胞。闭合型SS细胞呈圆形,幼体主要分布于直肠(图1A)和回肠,食管偶见(图1B);亚成体主要分布于十二指肠(图1C),贲门(图1D)偶见;成体主要分布于幽门(图1E)、十二指肠和直肠(图1F),食管(图1G)和贲门(图1H)偶见。
开放型细胞形态多样,呈三角形、楔形、长棒状、短棒状或不规则形。幼体的SS开放型细胞主要分布于胃底(图1I)和幽门,食管(图1J)、贲门(图1K)和十二指肠(图1L)少见;亚成体主要分布于幽门(图1M),食管、贲门、十二指肠、空肠和回肠(图1N)偶见;成体主要分布于幽门和直肠(图1O),食管、贲门和胃底(图1P)偶见。
2 消化道SS细胞分布密度的年龄和部位差异
SS细胞分布密度的年龄(F2,168= 8.906,P<0.01)和消化道部位(F7,168= 5.062,P< 0.01)差异都极显著,但两者之间无交互作用(F7,168= 0.974,P> 0.05)。
幼体回肠和直肠SS细胞的分布密度较高,食管、贲门较低,但部位间的差异不显著(F7,56= 1.296,P> 0.05)。亚成体幽门显著高于贲门(F7,56= 2.237,P< 0.05),但与其他部位无显著性差异。成体幽门和直肠显著高于食管、贲门和胃底(F7,56= 2.874,P< 0.05),但与其他部位间的差异不显著(表1)。
成体空肠SS细胞的分布密度显著高于亚成体和幼体(F2,21= 6.528,P< 0.01),直肠成体显著高于幼体(F2,21= 4.294,P< 0.05),但与亚成体无显著差异(表1)。

图1 中华蟾蜍消化道生长抑素细胞形态学特征的增龄变化。A,幼蟾直肠圆形的SS细胞;B,幼蟾食管圆形的SS细胞;C,亚成体蟾十二指肠圆形的SS细胞;D,亚成体蟾贲门圆形的SS细胞;E,成蟾幽门圆形的SS细胞;F,成蟾直肠圆形的SS细胞;G,成蟾食管圆形的SS细胞;H,成蟾贲门圆形的SS细胞;I,幼蟾胃底短棒状的SS细胞;J,幼蟾食管不规则形的SS细胞;K,幼蟾贲门长棒状的SS细胞;L,幼蟾十二指肠三角形的SS细胞;M,亚成体蟾幽门楔形的SS细胞;N,亚成体蟾空肠短棒状的SS细胞;O,成蟾直肠三角形的SS细胞;P,成蟾胃底不规则形的SS细胞。EP,上皮;SG,胃腺;箭头,SS阳性细胞;比例尺,15μmFig. 1 Age-related changes of morphological characters of somatostatin (SS) cells along the digestive tract of Bufo gargarizans. A, round shaped SS cells in the rectum of juvenile toads; B, round shaped SS cells in the esophagus of juvenile toads; C, round shaped SS cells in the duodenum of subadult toads; D, round shaped SS cells in the cardia of sub-adult toads; E, round shaped SS cells in the pylorus of adult toads; F, round shaped SS cells in the rectum of adult toads; G, round shaped SS cells in the esophagus of adult toads; H, round shaped SS cells in the cardia of adult toads; I, short-bar shaped SS cells in the fundus of juvenile toads; J, irregular shaped SS cells in the esophagus of juvenile toads; K, long-bar shaped SS cells in the cardia of juvenile toads; L, triangle shaped SS cells in the duodenum of juvenile toads; M, wedge shaped SS cells in the pylorus of sub-adult toads; N, shortbar shaped SS cells in the jejunum of sub-adult toads; O, triangle shaped SS cells in the rectum of adult toads; P, irregular shaped SS cells in the fundus of adult toads. EP, epithelium; SG, stomach gland; arrows, SS positive cells; scale bar, 15μm
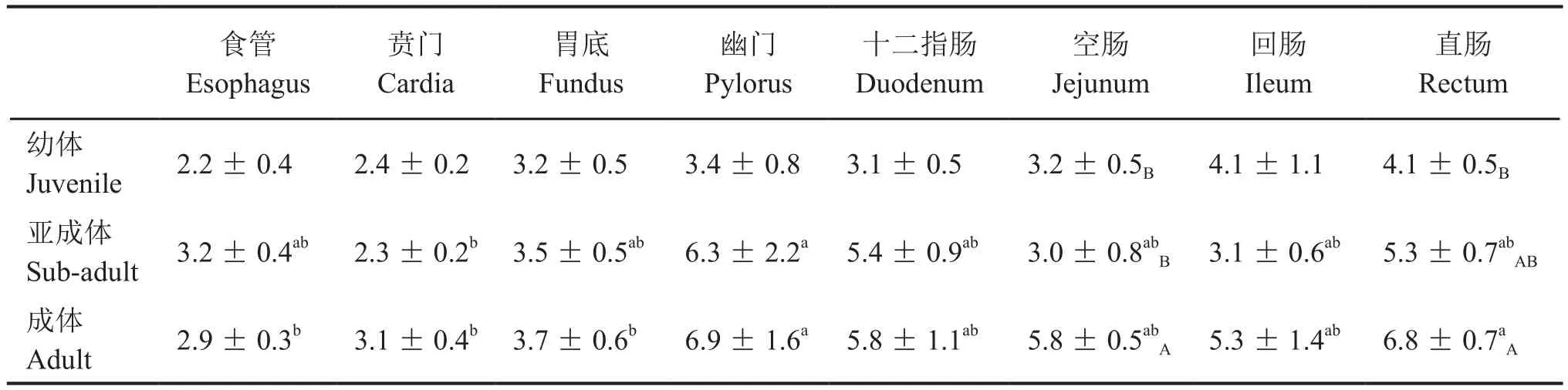
表1 中华蟾蜍消化道生长抑素免疫反应阳性细胞分布密度的年龄和部位差异(细胞个数/400×视野)Tab. 1 Age-related and segmental differences of distribution densities of somatostatin immunoreactive positive cells along the digestive tract in Bufo gargarizans (cells/400× fields)
讨 论
中华蟾蜍登陆后消化道SS细胞的形态学特征多变,亚成体和成体的分布密度部位间的差异明显,空肠和直肠的分布密度随年龄增加而升高,这可能与SS细胞的功能及个体的消化生理状态有关。
1 中华蟾蜍消化道SS细胞形态学特征的增龄变化
中华蟾蜍消化道SS细胞最早出现于变态高峰期的胃部和十二指肠,幼蟾期从食管至空肠都有分布,以闭合型细胞为主,并开始出现开放型细胞[6]。登陆后,中华蟾蜍幼体、亚成体和成体消化道SS细胞分为呈圆形的闭合型细胞,或有细胞质突起伸向邻近细胞的开放型细胞,这与其他两栖动物相同[9]。大熊猫胃肠道[2]和长爪沙鼠肠道[3]SS细胞的形态学特征都无明显的年龄变化;大鼠生后1d、7d、18d、28d和45d胃肠道各段均有SS细胞分布,形态多样,18d时小肠段以开放型细胞为主,SS细胞有细胞质突起伸向肠腔,或有突起与邻近细胞相接触[14-15]。中华蟾蜍消化道SS细胞形态多变,这可能主要与SS细胞抑制胃泌素等其他内分泌激素分泌的生理功能有关,有助于保护胃肠黏膜[12]。
2 同一年龄组中华蟾蜍消化道SS细胞分布密度的部位差异
中华蟾蜍消化道SS细胞在变态高峰期偶见于胃部和十二指肠,幼蟾期有较多数量的阳性细胞分布于食管至空肠各段[6]。牛蛙(Rana catesbeiana)消化道SS细胞在变态前期已见于消化道各段,但各段的分布密度无明显差异,变态高峰期和变态后期食管无分布,贲门、胃体和肠道前段的密度增加明显[7];从41至46期,极北鲵(Salamandrella keyserlingii)肠道SS细胞41期未见,43期的密度显著高于其他时期[8]。变态前后,非洲爪蟾(Xenopus laevis)胃和前肠SS细胞的密度随发育进程而逐渐升高[17],而欧洲林蛙(Rana temporaria)蝌蚪主要分布于胃和前肠[4-5]。大鼠SS细胞于生后1d就已分布于胃肠各段,生后1~45d胃窦部的密度随日龄的增长而逐渐增多,肠道在18d 时最高[15];生后5d、15d、30d和 60d的雄性昆明小鼠腺胃的密度显著高于肠道各段[18]。中华蟾蜍幼体消化道各段的SS细胞数量相对稳定,亚成体和成体幽门密度最高,成体在直肠也有一个密度高峰,但密度低谷都位于消化道前端,暗示SS细胞在幽门可能主要起抑制胃蠕动、减少胃部血流量和平衡其他激素分泌的作用,在直肠主要执行抑制肠蠕动和保护肠黏膜的功能[12,16]。
3 中华蟾蜍消化道同一部位SS细胞分布密度的年龄差异
中华蟾蜍消化道SS细胞的密度从幼体至成体空肠和直肠部位上升明显。研究发现,哺乳动物随发育进程的推进,胃部SS细胞的密度变化较大。例如,大鼠生后胃窦部SS细胞随日龄的增长而逐渐增多[15],而小鼠则在生后第15d腺胃部SS细胞达到高峰,30d时数量回落,至60d时又回升至与15d时接近的水平[18]。中华蟾蜍登陆后食管和胃部SS细胞的分布密度均无显著变化,空肠和直肠密度上升,这与大鼠和小鼠均不相同。随着年龄增加,中华蟾蜍空肠SS细胞的分布密度持续升高,说明在亚成体阶段已具备较强的消化和吸收食物的能力,增加的SS细胞数量有助于抑制肠液的分泌,平衡其他激素的含量,使机体的消化和吸收能力处于稳定状态。直肠是中华蟾蜍重吸收水分和外排食物残渣的主要通道,该处较多的SS细胞可能对肠黏膜组织起保护作用。
综上所述,登陆后同一年龄组中华蟾蜍消化道各部位SS细胞的形态学特征和分布密度不尽相同,不同年龄组空肠和直肠SS细胞的密度有明显的增龄变化,这可能是不同年龄段中华蟾蜍适应各自消化生理状态的形态学基础之一。
