基于量子点荧光探针的过氧化氢酶活性及酶量的快速测定
2019-07-10翟晨王书雅时超黄蔚霞
翟晨 王书雅 时超 黄蔚霞

摘要 [目的]提出一种基于量子点荧光探针的过氧化氢酶活性及酶量检测方法。[方法]以谷胱甘肽(GSH)稳定的CdTe/CdS量子点为荧光探针,对过氧化氢酶活性及酶量进行定量分析。[结果]酶活性检测基于荧光猝灭法,对荧光猝灭机理进行探讨,并对试验参数进行优化,得到反应溶液最优pH为9,量子点与过氧化氢最优反应时间为10 min。在最优条件下,对过氧化氢酶活性进行检测,检测范围为0.25~12.00 U/L,过氧化氢和酶反应前后荧光差值(F1- Fn)与猝灭前荧光值(F0)的比与过氧化氢酶活性有较好的相关性(R2=0953)。酶量检测基于竞争免疫荧光法,通過对固化时间、抗体浓度等参数的优化,获得酶量检测的最优模型,检测范围为0.04~1.40 mg/L(R2=0.964)。通过简单的样品前处理,对大米中的过氧化氢酶活性及酶量进行检测,得到酶活性检测加标回收率为92.0%~114.0%,酶量检测加标回收率为85.0%~115.0%。[结论]该方法操作简单、准确、灵敏,通过一次简单的样品前处理,获得酶活性及酶量检测的食品样品提取液,为食品中过氧化氢酶活性及酶量的快速测定提供了一种新的思路。
关键词 CdTe/CdS-GSH量子点;荧光探针;过氧化氢酶活性;过氧化氢酶量;快速测定
中图分类号 TS207.3文献标识码 A
文章编号 0517-6611(2019)11-0194-04
doi:10.3969/j.issn.0517-6611.2019.11.056
Abstract [Objective] The research aimed to propose a method for detecting catalase activity and enzyme amount based on quantum dot fluorescent probe.[Method]CdTe/CdS quantum dots stabilized by glutathione (GSH) were used as fluorescent probes to quantitatively analyze catalase activity and enzyme amount.[Result]Catalase activity quantitatively determine based on fluorescent quenching effect of CdTe/CdSGSH QDs, parameters affecting the fluorescent response were optimized, the optimal pH of the reaction solution was 9, the optimal reaction time of QDs and H2O2 was 10 min. Under the optimum conditions, the determination of catalase was in the range from 0.25 U/L to 12.00 U/L. The difference value of fluorescence intensity after reaction of H2O2 and catalase was labeled as “Fn-F1”, the fluorescent value before quenching was labeled as “F0”, the ratio of “Fn-F1” and “F0” had a good relationship (R2=0. 953) with catalase activity. This developed method was applied to detect catalase activity in rice samples, the recovery ratio was 92.0%-114.0%.Catalase amount quantitatively determine based on fluoroimmunoassay method, under the optimum conditions, the fluorescence strength of QDs had a good relationship (R2=0.964) with concentration of catalase in the range from 0.04 mg/L to 1.40 mg/L, the recovery ratio was 85.0%-115.0%.[Conclusion] The method is simple, accurate and sensitive. The food sample extract obtained by enzyme preparation and enzyme amount detection by a simple sample preparation provides a new idea for the rapid determination of catalase activity and enzyme amount in food.
Key words CdTe/CdSGSH quantum dots;Fluorescence probe;Catalase activity;Catalase amount;Rapid determination
基金项目 国家重点研发计划(2016YFD041204)。
作者简介 翟晨(1988—),女,山东淄博人,工程师,博士,从事食品品质与安全的快速检测技术研究。*通信作者,高级工程师,博士,从事食品品质与安全的检测技术研究。
收稿日期 2018-11-18
过氧化氢酶是一类广泛存在于动物、植物和微生物体内的末端氧化酶,是生物演化过程中建立起来的生物防御系统的关键酶[1-2]。通过过氧化氢酶活性的预测可以早期预警储藏玉米是否污染AFB1[3]、优化粮食储存条件[4-5]、监测果蔬品质劣变状态[6]、检测种子活性[7]等,因此准确且灵敏地预测过氧化氢酶活性具有重要意义。但预测过氧化氢酶活性需要进行酶提取,酶脱离生物组织,活性会发生一定的变化,因此结合酶量的检测可更全面地说明生物组织内过氧化氢酶的变化规律。
测定过氧化氢酶活性的常用方法有高锰酸钾滴定法、碘量滴定法、分光光度法和气量法等[8],這些方法准确度较高,但灵敏度较低,难以监测到样品中过氧化氢酶活性的微量变化,因此需要开发一种快速、准确、灵敏的过氧化氢酶活性检测方法。过氧化氢酶含量的检测常用方法有荧光PCR[9]、免疫印迹法[10]、考马斯亮蓝染色法[11]等,这些方法从基因或者蛋白层面分析酶量,但存在前处理复杂、检测时间长、特异性差等缺点。因此需要开发一种准确、灵敏,且通过一次简单的样品前处理,能够快速获得酶活性及酶量的检测方法。
量子点是一种“准零维”的纳米颗粒,具有吸收谱较宽、发光效率高以及稳定性好等优异的光学特性[12-13]。量子点的发光性能与其表面状态密切相关,其荧光猝灭作用都是由量子点表面状态的变化而引起的[14-15]。量子点作为新型荧光探针具有高灵敏度、快速、低检测限的优势[16],近几年在小分子快速检测方面应用较多。笔者提出一种基于以谷胱甘肽稳定的CdTe/CdS量子点(CdTe/CdS-GSH)为荧光探针的过氧化氢酶活性及酶量检测方法,通过一次简单的样品前处理,快速、灵敏地获得样品中的过氧化氢酶活性及酶量,为过氧化氢酶的精准检测提供一种新的研究思路。
1 材料与方法
1.1 仪器与试剂
Hitachi F-7000荧光分光光度计;Hitachi U-3900分光光度计;Sartorius PB-10型pH计;Eppendorf 5415R小型高速冷冻离心机。
CdTe/CdS-GSH 量子点购买于苏州星烁纳米科技有限公司;羧基化磁性纳米球购买于武汉珈源量子点技术开发有限责任公司;过氧化氢酶(2 000 U/mg)及过氧化氢酶抗体均购买于上海士锋生物科技有限公司;过氧化氢、NaH2PO4、Na2HPO4、NaOH、1-乙基-(3-二甲基氨基丙基)碳二亚胺(EDC)、N-羟基丁二酰亚胺(NHS)等试剂均为分析纯;试验中所用水为纯水器Milli-Q reference处理的超纯水。
1.2 过氧化氢酶活性检测
在室温下,用pH 7.4的PBS缓冲溶液制备一系列不同活性的过氧化氢酶溶液,与定量过氧化氢反应10 min后,得到反应液A。在一系列10 mL比色管中,分别加入500 μL CdTe/CdS-GSH 量子点溶液以及1 mL新鲜制备的反应液A,用缓冲溶液定容至5 mL,充分摇匀后室温下放置一段时间进行反应。
将以上制备好的溶液润洗并倒入10 mL四面通透的比色皿中,在325 nm激发光激发下,测定并记录586 nm处荧光强度F,激发、发射狭缝宽度均是5 nm。
1.3 过氧化氢酶量检测
1.3.1 过氧化氢酶抗体-磁性粒子复合物。25 mg/mL的磁性粒子中加入6 mg/mL EDC和4 mg/mL NHS PBS缓冲溶液(pH 6.0),室温下振荡反应30 min,磁分离,PBS溶液洗涤3次后加入5 μL过氧化氢酶抗体(pH 7.4),在37 ℃下振荡孵育2 h,磁分离,洗涤3次除去未结合的抗体,得到过氧化氢酶抗体-磁性粒子复合物。
1.3.2
过氧化氢酶-量子点复合物。取CdTe/CdS-GSH 量子点溶液150 μL,经EDC和NHS室温下活化15 min,加入过氧化氢酶溶液(pH 7.4),置于37 ℃摇床上2 h,加入10 g/L牛血清白蛋白(BSA)溶液以封闭量子点上未反应的羧基位点,将偶联反应所得到的溶液放置于4 ℃过夜保存。
将已知浓度的过氧化氢酶溶液与10 μL过氧化氢酶抗体-磁性粒子复合物在37 ℃下振荡反应30 min,磁分离,用pH 7.4 PBS溶液洗涤3次后,用PBS溶液定容至1 mL,加入过氧化氢酶-量子点复合物,37 ℃下振荡反应30 min,磁分离,洗涤3次,去除多余的过氧化氢酶-量子点复合物,将该溶液进行荧光扫描,在325 nm激发光激发下,测定并记录586 nm处荧光强度F,激发、发射狭缝宽度均是5 nm。
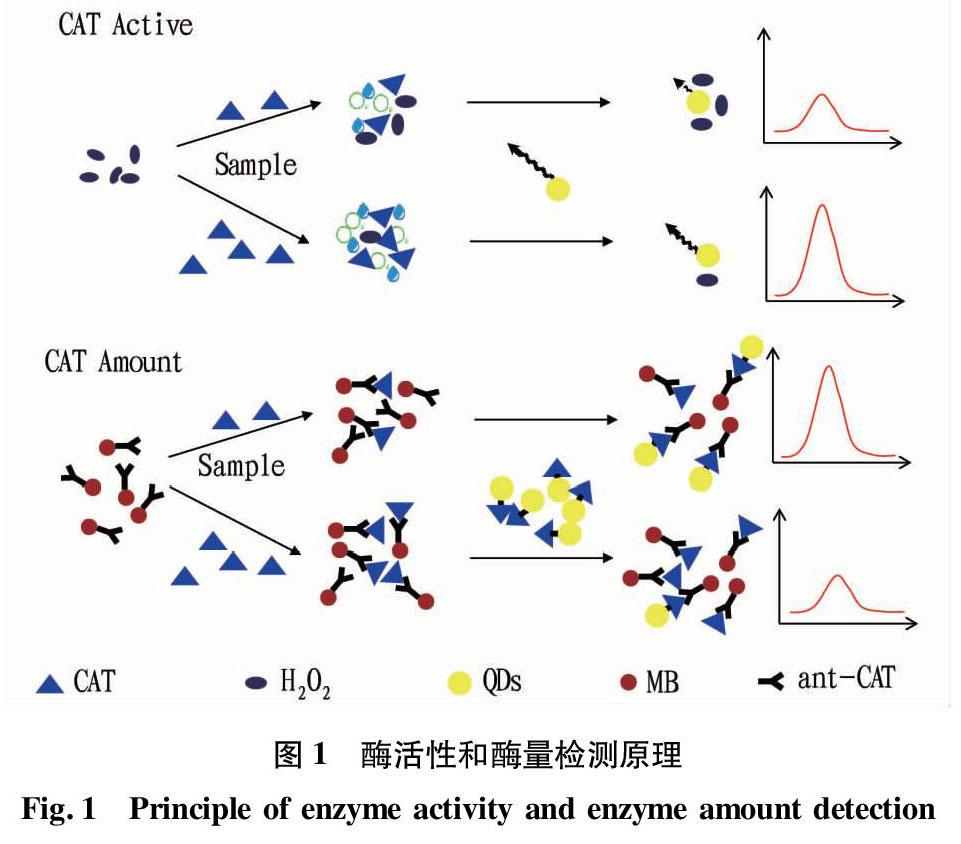
1.4 酶活性及酶量检测原理
过氧化氢导致CdTe/CdS-GSH 量子点荧光猝灭,猝灭前(F0)后(Fn)的荧光比值(Fn/F0)与过氧化氢的浓度呈负相关。过氧化氢酶活性越强,底物过氧化氢被分解的越多,荧光猝灭程度越小,过氧化氢与酶反应前(F1)后(Fn)的荧光差值与荧光猝灭前(F0)荧光值的比为[(Fn- F1)/ F0],该值与过氧化氢酶活性建立数学关系。
通过酰胺反应,分别制备过氧化氢酶抗体-磁性粒子复合物、过氧化氢酶-量子点复合物。样品中的酶通过免疫反应首先与过氧化氢酶抗体-磁性粒子结合,过氧化氢酶-量子点复合物再与过氧化氢酶抗体-磁性粒子复合物混合,使抗体中剩余的结合位点通过与过氧化氢酶将CdTe/CdS-GSH量子点结合到磁性粒子上,通过磁铁吸附,除去未结合的量子点。通过量子点的荧光强度,判断抗体与样品中酶反应后剩余的结合位点数,进而得到样品中过氧化氢酶量。酶活性及酶量检测原理如图1所示。
1.5 加标回收试验
为了验证该方法是否可以应用于实际样品中微量过氧化氢酶活性及含量的检测,以大米为研究对象,进行加标回收试验。将大米放置于烘箱中,在100 ℃环境下过夜,使样品中的过氧化氢酶灭活。将加热处理过的大米打碎并充分研磨,研磨后将大米分成均匀的小份,每小份添加不同量的过氧化氢酶(微量,样品总质量增加可忽略),在冰水浴下再次进行充分研磨后将每份样品加入5 mL pH 7.4 PBS缓冲溶液,充分摇匀,在0 ℃下6 000 r/min离心20 min,取上清液按照“1.2”及“1.3”方法进行过氧化氢酶活性及酶量检测[5,17]。
2 结果与分析
2.1 基于量子点猝灭的酶活性检测
2.1.1 猝灭机理探讨。
采集过氧化氢猝灭量子点前后的荧光光谱,并进行分析,从325 nm激发光激发下的波长扫描光谱图(图2a)可看出,随着过氧化氢浓度增大,荧光峰强度越来越小,且逐渐蓝移,当荧光强度降至原来的50%时,波长蓝移约8 nm。推测原因是过氧化氢具有强氧化性,能够氧化量子点导致表面产生新的缺陷,量子点的有效尺寸减少,且增加了非辐射方式的电子跃迁,减少了量子点本身的电子-空穴直接复合,即减小了激子态荧光的产生,从而导致荧光猝灭[18-19]。从量子点与过氧化氢反应前后的紫外-可见吸收光谱(图2b)可以看出,CdTe/CdS-GSH 量子点的吸收峰在538 nm处,过氧化氢在350~650 nm处无明显吸收峰,过氧化氢与量子点反应后,吸收峰蓝移且峰值逐渐降低,当过氧化氢浓度较高时,该吸收峰基本消失,这是由于量子点表面缺陷导致荧光物质吸收光谱发生改变。从图2a中插图的荧光猝灭的Stern-Volmer曲线可以看出,F0/F值随着过氧化氢浓度增大而逐渐增大,但是该增长曲线非直线,说明量子点的荧光猝灭是通过复杂的多元作用实现的[20]。
2.1.2 检测参数优化。
反应溶液pH、量子点与过氧化氢反应时间等条件影响方法的灵敏度。如图3a所示,量子点猝灭前,在酸性环境下荧光值较低,随着pH增加荧光值逐渐增高,在pH为9.0左右时荧光值最高。量子点与一定浓度的过氧化氢溶液反应后,相比猝灭前,荧光强度有明显下降,由图3a可见,当pH为9.0时该比值最小,即该pH时,量子点由过氧化氢的氧化而造成的猝灭最敏感,进而对过氧化氢的浓度变化也最灵敏,综上所述,试验的缓冲溶液选取pH为9.0的磷酸二氢钠-氢氧化钠缓冲溶液。
过氧化氢氧化量子点,导致量子点荧光猝灭,该氧化时间是否影响猝灭效果需要进行探讨,从图3b可看出,量子点与不同浓度的过氧化氢(Ⅰ,浓度较低;Ⅱ,浓度较高)反应,荧光值均迅速下降,过氧化氢浓度较高时,单位时间内下降幅度较大,当反应时间超过10 min后,无论过氧化氢浓度高低,量子点荧光值基本恒定,该现象可能是过氧化氢氧化量子点达到饱和导致,因此量子点与过氧化氢的最优反应时间为10 min。
2.1.3 预测模型建立。
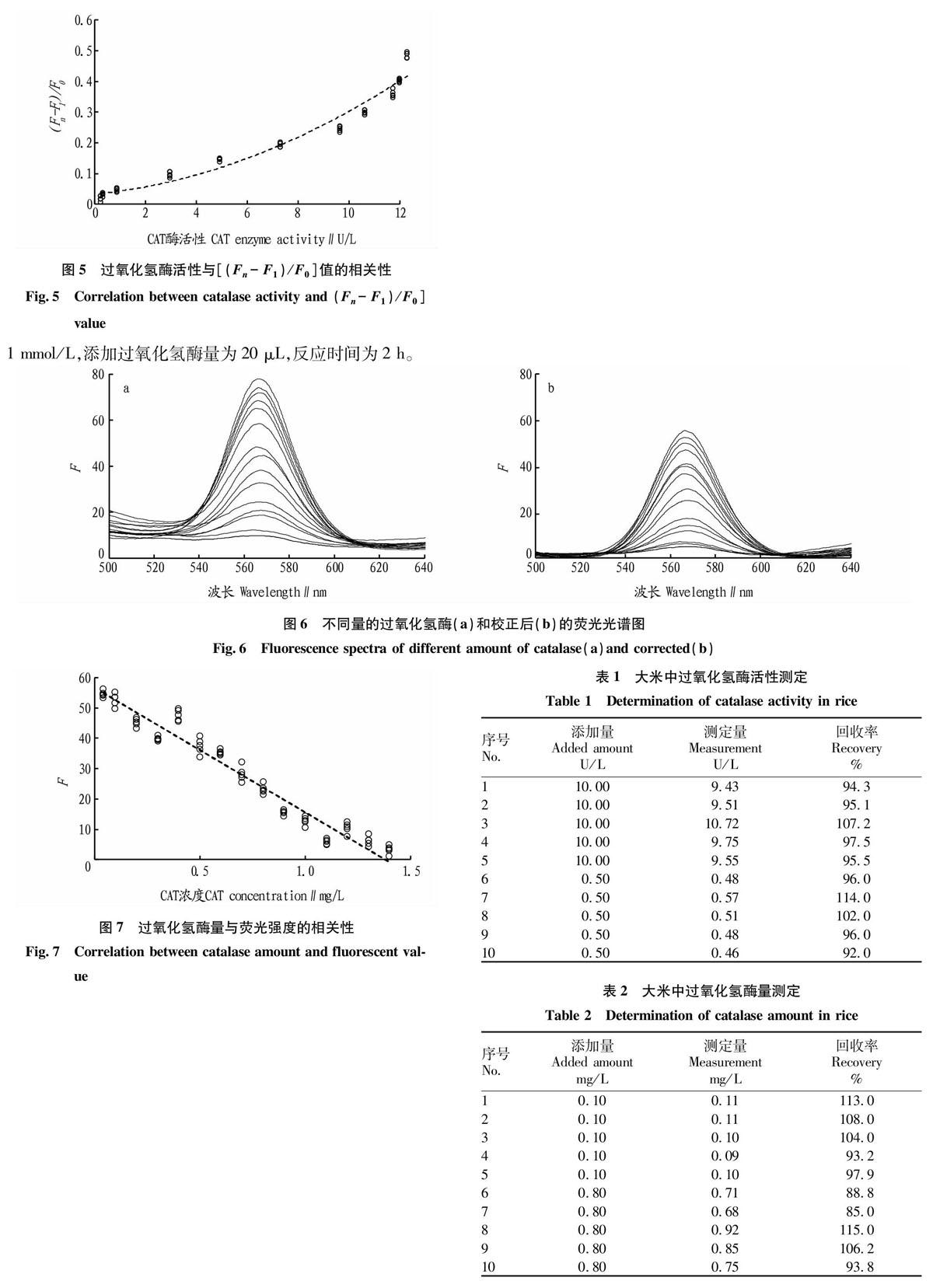
在优化的试验条件下,过氧化氢的加入使量子点荧光猝灭,当量子点与不同浓度的过氧化氢反应,猝灭值也有较大的差异。过氧化氢在过氧化氢酶的催化下,快速分解为水和氧气,相同时间下,过氧化氢溶液分别与不同活性的过氧化氢酶混合后,活性较高的酶催化分解的过氧化氢分子相对较多,将该混合溶液与量子点溶液反应,由于导致量子点荧光猝灭的过氧化氢分子较少,因此熒光的猝灭程度较低,反之,荧光的猝灭程度较高,如图4所示,酶活性在0.25~12.00 U/L,随着活性的增加,猝灭后的荧光值(Fn)越高,将过氧化氢与酶反应前(F1)后(Fn)的荧光值与荧光猝灭前(F0)的荧光值的比[(Fn - F1)/F0]与过氧化氢酶的活性进行相关性分析,得到决定系数R2为0.953(图5),说明可以采用该方法对过氧化氢酶活性进行快速、准确且灵敏的预测。
2.2 基于量子点免疫荧光的酶量检测
2.2.1 检测参数优化。
制备过氧化氢酶抗体-磁性粒子复合物时,抗体与磁珠的固化时间影响所制备的复合物数量,导致可结合的酶量相应减少,进而影响检测效果。固化时间分别设置为0.5、1.0、1.5、2.0、2.5、3.0 h,随着固化时间的增加,荧光强度逐渐增强,当固化时间大于2 h时,荧光强度趋于稳定,因此过氧化氢酶抗体与磁性粒子的最优固化时间为2 h。抗体的浓度也对检测结果有重要的影响,抗体过少导致该复合物制备数量减少,过多导致抗体浪费,经优化,抗体的浓度为125 μg/mL。
制备过氧化氢酶-量子点复合物时,缓冲溶液浓度、过氧化氢酶浓度及反应时间等参数关系该复合物制备效果,对以
上试验条件进行优化,最优条件如下:缓冲溶液浓度为1 mmol/L,添加过氧化氢酶量为20 μL,反应时间为2 h。
2.2.2 模型建立。
样品中的过氧化氢酶较多时,导致带有量子点的过氧化氢酶较少地与磁性粒子结合,荧光强度较弱,因此过氧化氢酶量与荧光强度呈负相关,如图6a所示,随着过氧化氢酶量的增加,荧光强度逐渐下降,由于磁纳米粒子的影响,荧光光谱基线漂移,导致直接定量困难,因此对光谱进行基线校准,校准结果见图6b,采用自适应迭代重加权惩罚最小二乘法(adaptive iteratively reweighted Penalized Least Squares,airPLS),可在保留有用光谱信息的基础上,对基线进行准确校准。对校准后的荧光光谱进行定量分析,随着酶量增加,荧光峰值逐渐下降,在0.04~1.40 mg/L酶量与荧光峰值呈线性关系,如图7建立预测模型,酶量与峰值具有较好的相关性(R2=0.964)。此结果说明该方法具有较高的准确度。
2.3 实际样品的检测
将灭活的大米打磨后分成均匀小份,分别加入不同量的过氧化氢酶,按照该研究开发的试验方法测得酶活性及酶量,结果见表1~2,酶活性检测加标回收率为92.0%~114.0%,酶量检测加标回收率为85.0%~115.0%,说明该方法检测实际样品具有可行性。
3 结论
该研究以谷胱甘肽(GSH)稳定的CdTe/CdS量子点为荧光探针,对过氧化氢酶活性及酶量进行定量分析,在最优条件下,基于荧光猝灭机理建立了酶活为0.25~12.00 U/L的预测操作简单、准确、灵敏,通过一次简单的样品前处理,得到酶活性及酶量检测的样品提取液,为食品中过氧化氢酶活性及酶量的快速、灵敏测定提供了一种新的思路。
