5种乳酸菌及其灭活态体外抗氧化能力的比较研究
2019-07-10陈漪汶方若楠朱剑锋胡文锋
陈漪汶,方若楠,朱剑锋,庞 旭,徐 健,胡文锋,*
(1.华南农业大学食品学院,广东广州 510642;2.生物源生物技术(深圳)股份有限公司,广东深圳 518118;3.广州无两生物科技有限公司,广东广州 510640;4.广州柏芳生物科技有限公司,广东广州 510640)
氧化应激是机体细胞内促氧化成分(如超氧化物、过氧化氢等)与抗氧化成分(超氧化物歧化酶、过氧化氢酶、谷胱甘肽等)之间平衡失调,体内氧自由基生成过多无法被清除,引起机体过度氧化,造成机体组织功能损害的一系列适应性的反应[1-2]。氧化应激及其介导的氧化损伤已成为机体不同系统疾病、老化发生与发展的一个基础病理代谢过程[3-4],研究表明,随着年龄的不断增大,氧化应激会逐渐增加。已有报道益生菌食品可抑制氧化应激,如氧化应激在糖尿病的发病机制和进展中起主要作用,益生菌酸奶的摄入改善了2型糖尿病患者的空腹血糖含量及抗氧化状态。而人类的衰老及一些疾病都与自由基的产生密切相关。机体衰老的自由基理论称,衰老是机体自由基不断积累的过程,自由基会使机体受到氧化损伤[5]。健康机体内,自由基会不断被清除,达到自由基产生和清除的平衡[6],因此,有效地清除体内的自由基,能一定程度上延缓衰老。
近年来,研究发现,某些乳酸菌菌株具有抗氧化[7-9]、抗衰老[10]、抗癌[11-14]等重要生物学功能,日本的 Kuda等[14]从aji-narezushi和kaburazushi中分离出的植物乳杆菌,加入到日本白萝卜汁和牛奶后,发现其可有效清除氧自由基。Marazza等[15]为了增强大豆饮料的生物活性,在豆浆发酵的过程加入鼠李糖乳杆菌CRL981作为β为葡糖苷酶的生产者,结果表明,加了鼠李糖乳杆菌发酵的豆浆较未发酵豆浆表现出较高的抗氧化活性(71.4%±4.0%)。Kullisaar等[16]研究发现,添加了发酵乳杆菌ME-3的山羊奶,具有抗动脉粥样硬化的作用。益生菌的免疫调节已经成为食品微生物学的热门话题,Liu等[17]试验发现,副干酪乳杆菌和植入乳杆菌产生的胞外多糖有潜在的抗氧化特性,可刺激细胞增殖,对巨噬细胞有轻度免疫调节的作用。Bernini等[18]试验发现,乳双歧杆菌HN019对健康和代谢综合征个体的炎症和氧化应激均有益,在健康个体中还有抗氧化作用。许多研究报道集中对单一菌株的抗氧化能力探究,而对复配菌株的抗氧化能力的研究未见文献报道,人进食多种乳酸菌后的抗氧化能力是否增强,在食品加工以及使用中有十分重要的参考价值。
本研究将对菊糖芽孢乳杆菌(Sporolactobacillusinulinus)、嗜酸乳杆菌(Lactobacillusacidophilus)、嗜热链球菌(Streptococcusthermophiles)、鼠李糖乳杆菌(LactobacillusrhamnosusGG)、唾液乳杆菌(Lactobacillussalivarius)5株乳酸菌灭活前后的发酵上清液(Cell free supernatant,CFS)、完整细胞悬液(Intact cells,IC)、胞内提取物(Cell-free extract,CFE)的抗氧化能力做系统的比较研究,并筛选出3株乳酸菌进行复配效果探究,单菌实验结果表明,完整细胞悬液(Intact cells,IC)、发酵上清液(Cell free supernatant,CFS)这两种活性成分的抗氧化能力效果最佳,因此复配时只研究这两种活性成分,此研究为乳酸菌功能性食品、微生态制剂、天然抗氧化剂的开发和生产,提供理论依据。
1 材料与方法
1.1 材料与仪器
邻二氮菲、抗坏血酸、铁氰化钾、硫酸亚铁、三氯乙酸、邻苯三酚、过氧化氢、氯化铁、Tris-HCl 均为国产,分析纯;总抗氧化能力(T-AOC)测定试剂盒、总超氧化物歧化酶(T-SOD)活力测定试剂盒 南京建成科技有限公司;MRS 培养基 广东环凯微生物科技有限公司;鼠李糖乳杆菌(LactobacillusrhamnosusGG)、嗜酸乳杆菌(Lactobacillusacidophilus)、菊糖芽孢乳杆菌(Sporolactobacillusinulinus)、唾液乳杆菌(Lactobacillussalivarius)、嗜热链球菌(Streptococcusthermophiles) 均由华南农业大学食品学院应用型微生物实验室保藏。
Centrifuge 5804R冷冻高速离心机 美国Eppendorf公司;PB-10型pH计 德国Sartorius公司;Evolution300型紫外-可见分光光度计 美国赛默飞世尔公司;VCX 800型细胞破碎仪 美国SONICS公司;超净工作台 苏州安泰空气技术有限公司;SX-500型全自动高压灭菌锅 日本TOMY公司;生化培养箱 上海博迅实业有限公司;数显恒温水浴锅 上海精宏实验设备有限公司;电子分析天平 梅特勒-托利多仪器(上海)有限公司。
1.2 实验方法
1.2.1 乳酸菌的培养 乳酸菌菌株于37 ℃在MRS培养基斜面上活化培养24 h,再以1%的接种量接种于MRS液体培养基,37 ℃静止培养12 h。
1.2.2 样品的制备
1.2.2.1 乳酸菌完整细胞菌悬液的制备 取培养12 h的发酵液,10000 r/min离心15 min,收集菌体,并用PBS缓冲液(pH7.4)洗涤后于10000 r/min离心15 min,以洗去培养基,重复3次。再将菌体重悬于PBS缓冲液,分别调整5株乳酸菌的菌数为109CFU/mL(OD600=1.1)完整细胞菌悬液。
1.2.2.2 乳酸菌发酵上清液的制备 取培养12 h的发酵液,收集发酵液,用双蒸水将乳酸菌的菌数调整到109cells/mL,在10000 r/min转速下离心15 min,收集上清液,经0.22 μm微孔滤膜过滤器过滤,即为发酵上清液。
1.2.2.3 乳酸菌胞内提取物的制备 取培养12 h的发酵液,发酵液于10000 r/min的转速下离心15 min,收集菌体,并用磷酸缓冲液(pH7.4)洗涤3次后,用无菌水调整乳酸菌为109cells/mL的菌悬液,在冰浴中超声破碎细胞(工作功率300 W、工作时间2 s、间隔3 s、工作次数900次),破碎液于4 ℃、10000 r/min离心20 min,收集上清,即为胞内提取物。
1.2.2.4 灭活乳酸菌完整细胞菌悬液的制备 取培养12 h的发酵液,于100 ℃水浴30 min,即得乳酸菌灭活发酵液。10000 r/min离心15 min,收集菌体,并用PBS缓冲液(pH7.4)洗涤后于10000 r/min离心15 min,以洗去培养基,重复3次。之后将菌体重悬于PBS缓冲液,调整乳酸菌的菌数调整到109CFU/mL,即为灭活完整细胞菌悬液。
同理可得灭活乳酸菌的发酵上清液、灭活乳酸菌的胞内提取物。
1.2.2.5 复合菌完整细胞的制备 选取抗氧化能力较强的菊糖芽孢乳杆菌、嗜酸乳杆菌和唾液乳杆菌菌株进行复配,将菌数为109CFU/mL的完整细胞分别按两两复配(1∶1)、三种菌复配(1∶1∶1)的比例充分混合,制备成复合菌完整细胞。
1.2.2.6 复合菌发酵上清液的制备 选取抗氧化能力较强的菊糖芽孢乳杆菌、嗜酸乳杆菌和唾液乳杆菌菌株进行复配,将其经0.22 μm微孔滤膜过滤器过滤后的发酵上清液分别按两两复配(1∶1)、三种菌复配(1∶1∶1)的比例充分混合,制备成复合菌发酵上清液。
1.2.3 乳酸菌抗氧化活性的测定 单一乳酸菌菌株发酵上清液、胞内提取物、完整细胞菌悬液的提取物于-20 ℃保存备用,对单一菌株三种提取物分别进行总抗氧化活性、清除羟自由基、超氧阴离子自由基清除率、总超氧化物歧化酶活力、还原活性实验。通过以上单菌实验,筛选出3种抗氧化能力较强的菌株进行两两复配、三种菌复配试验,以发酵上清液、完整细胞菌悬液为测定样品。
1.2.3.1 清除羟自由基实验 在1 mL 2.5 mmol/L邻二氮菲中加入磷酸盐缓冲液(PBS浓度为0.02 mol/L,pH=7.4)1 mL,样品1 mL,充分反应后,加入硫酸亚铁(FeSO4浓度为2.5 mmol/L)1 mL,摇匀,加过氧化氢(H2O2,质量分数为20 mmol/L)1 mL,37 ℃水浴1.5 h后在536 nm下测定其吸光度为As;用1 mL蒸馏水代替1 mL H2O2,1 mL蒸馏水代替1 mL样品为Ab;用1 mL蒸馏水代替1 mL样品为A0[19-20]。
羟自由基清除活性(%)=(As-A0)/(Ab-A0)×A基
1.2.3.2 超氧阴离子自由基清除率 于4.5 mL pH为8.0的Tris-HCl缓冲液加入0.1 mL样品,25 ℃水浴20 min后,加入0.4 mL 25 mmol/L的邻苯三酚,25 ℃水浴反应5 min后立刻加入2滴8 mol/L的HCl停止反应,在325 nm测吸光度即为A,用蒸馏水调零。空白组用0.1 mL H2O代替样品即为A0[21]。
超氧阴离子自由基清除率(%)=(A0-A)/(A0×A)×100
1.2.3.4 总抗氧化活性 在37 ℃时,每分钟每毫升样品,使反应体系的吸光度(OD)值,每增加0.01时,为一个总抗氧化能力单位(单位/毫升),用T-AOC测定试剂盒,按产品说明操作。
1.2.3.5 总超氧化物歧化酶活力 每毫克组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量为一个SOD活力单位(U)。用T-SOD测定试剂盒,按产品说明操作。
1.2.3.6 还原性 取0.5 mL乳酸菌的细胞生理盐水悬浮液,加入到0.5 PBS溶液(0.2 mol/L,pH6.6)中,并加入0.5(1%,m/v)铁氰化钾溶液,此混合液放置于50化钾温度下水浴保温20 min,于冰水中迅速冷却至室温,再向此混合液中加入1 mL的三氯乙酸(TCA,10%),充分混匀后,在4000 r/min转速下离心处理10 min去除蛋白等沉淀物质,取1 mL上清液,向其中加入1 mL生理盐水,同时加入1 mL FeCl3(0.1%,m/v),充分振荡使其混合均匀,静置孵育10 min后在波长700 nm下测定反应体系的吸光值。吸光度越大,待测样品的还原能力越强[22]。
1.3 数据处理
试验数据以3次重复的平均值标准误差表示,数据处理采用Graphpad Prism 7.0软件进行,差异显著性分析和相关性分析采用SPSS 17.0软件进行,显著水平p设为0.05,当p≤0.05时,表示差异显著。
2 结果与分析
2.1 单种乳酸菌抗氧化能力的对比
2.1.1 总抗氧化活性 由图1可知,从图1可以看出,5种乳酸菌的不同提取物均呈现不同的总抗氧化活性,说明这5种乳酸菌的胞内产物、发酵产物以及完整细胞菌悬液均具有一定的总抗氧化能力,在5株乳酸菌灭活、未灭活的发酵上清液、完整细胞悬液、胞内提取物三种液体中,发酵上清液的总抗氧化活性最好,胞内提取物次之,完整细胞菌悬液较弱。5个菌种间的总抗氧化活性无显著差异(p>0.05),同种菌的不同乳酸菌组分的总抗氧化活性差异显著(p<0.05),嗜酸乳杆菌(Lactobacillusacidophilus)的发酵上清液的总抗氧化活性最好。灭活后的乳酸菌不同提取物的总抗氧化活性较未灭活没有显著差异(p>0.05),灭活后的完整细胞菌悬液总抗氧化活性较未灭活有不同程度的提高。
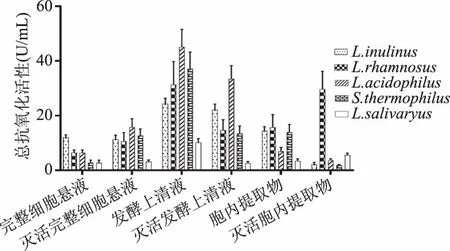
图1 五种乳酸菌总抗氧化活性
2.1.2 总超氧化物歧化酶(T-SOD)活力 由图2可知,五种乳酸菌发酵上清液、完整细胞菌悬液和胞内提取物均表现一定的SOD活性,发酵上清液、胞内提取物以及完整细胞菌悬液的SOD活性因不同菌株差异不是很明显(p>0.05),表明乳酸菌的SOD在胞内和胞外均有分布。不同的乳酸菌组分SOD差异显著(p<0.05),完整细胞菌悬液的SOD活力最好,胞内提取物的SOD活力最差,初步得出SOD为附着在细胞表面的胞外酶的结论。其中嗜热链球菌(Streptococcusthermophiles)的灭活完整细胞菌悬液的SOD活性最强。灭活前后乳酸菌各组分的SOD活性没有显著差异(p>0.05),经灭活的发酵上清液和胞内提取物的SOD活力较未灭活有不同程度的提高,可能原因是灭活温度不足以使相关酶失活,有关因子在高温中被激活导致酶活性增加。
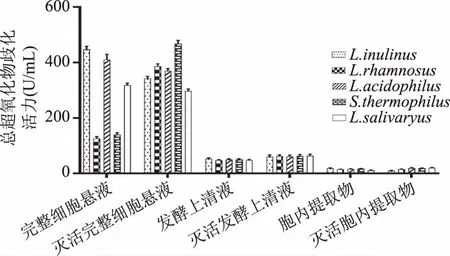
图2 五种乳酸菌总超氧化物歧化酶(T-SOD)活力
2.1.3 羟自由基(·OH)清除率 从图3可知,嗜热链球菌(Streptococcusthermophiles)完整细胞菌悬液的羟自由基清除率最强为79.26657%。试验菌株的完整细胞菌悬液的羟自由基清除率都强于乳酸菌其他组分,胞内提取物的羟自由基清除率能力较发酵上清液而言。结果表明,乳酸菌清除机体的羟自由基的活性物质主要存在菌体表面以及代谢产物中而非胞内。5种乳酸菌的羟自由基清除能力没有显著差异作用(p>0.05),乳酸菌的各种组分差异不显著(p>0.05),灭活后的发酵上清液、完整细胞菌悬液的较未灭活的羟自由基清除能力没有显著差异作用(p>0.05),但灭活后的胞内提取物的羟自由基清除率有显著差异(p<0.05),较未灭活的弱。

图3 五种乳酸菌羟自由基率
2.1.4 超氧阴离子清除率 由图4可知,5种乳酸菌的不同提取物均呈现一定的超氧阴离子自由基清除能力,说明乳酸菌的胞内和胞外产物以及完整细胞本身都可作为抗氧化剂去清除机体的超氧阴离子自由基。不同菌种的超氧阴离子自由基清除能力没有显著差异作用(p>0.05),提取物的不同也没有显著差异作用(p>0.05),灭活前后的乳酸菌清除超氧阴离子自由基也没有显著差异作用(p>0.05)。菊糖芽孢乳杆菌(Sporolactobacillusinulinus)的各种提取物的超氧阴离子自由基清除率均较高,其发酵上清液的超氧阴离子自由基清除率最强。经灭活后的乳酸菌提取物的超氧阴离子清除率较灭活前有变化,但总体区别不大。

图4 五种乳酸菌超氧阴离子自由基清除率
2.1.5 还原性 由图5可知,五种乳酸菌的不同提取物均具有一定的还原活性,完整细胞菌悬液及胞内提取物的还原活性较发酵上清液要低很多。不同菌株的还原活性没有显著差异作用(p>0.05),乳酸菌的不同组分存在较大差异(p<0.05),发酵上清液的还原活性差异显著,其中唾液乳杆菌(LactobacillusSalivarius)的灭活发酵上清液的还原活性最大。乳酸菌灭活前后的还原活性没有显著差异作用(p>0.05)。
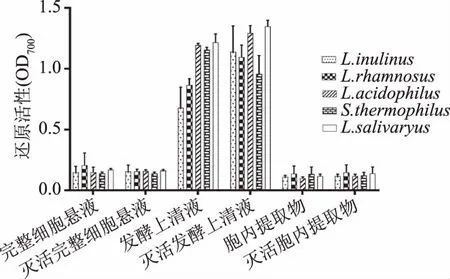
图5 五种乳酸菌的还原活性
2.1 复合乳酸菌的抗氧化能力
2.2.1 总抗氧化活性 从图6可知,灭活后的完整细胞菌悬液复合物较灭活前有明显差异大幅的提升。乳酸菌完整细胞菌悬液的复合状态对总抗氧化活性无显著差异(p>0.05)。未灭活的完整细胞菌悬液复合物总抗氧化活性与单种乳酸菌完整细胞菌悬液活性相当。与单种灭活乳酸菌相比,灭活唾液乳杆菌(InactivedLactobacillusSalivarius)与灭活嗜酸乳杆菌(InactivedLactobacillusacidophilus)的完整细胞菌悬液的复合物的总抗氧化能力最好。单菌发酵上清液总抗氧化活性较复合发酵上清液强,灭活后的发酵上清液复合物较灭活前也无明显变化。不同乳酸菌发酵上清液复合状态对总抗氧化活性无显著差异(p>0.05),总体上看发酵上清液复合物对抗氧化活性无影响。
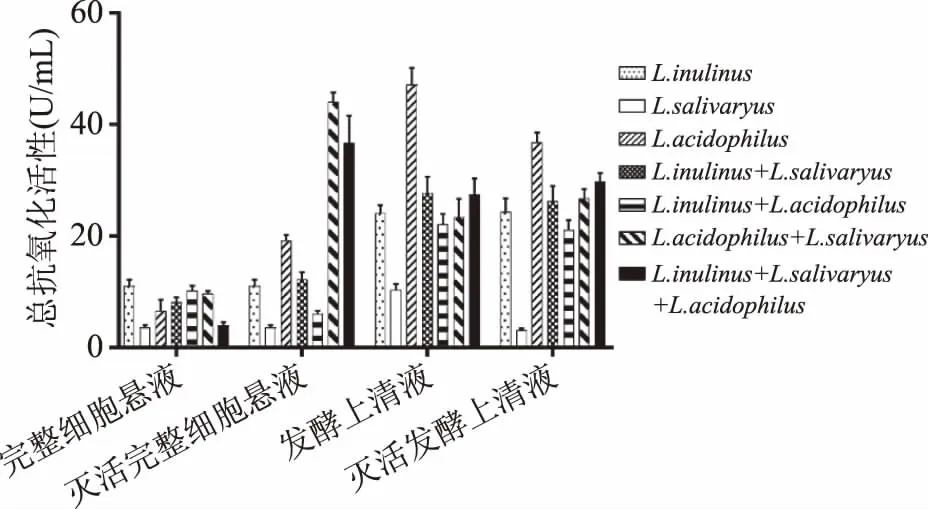
图6 乳酸菌复合物的总抗氧化活性
2.2.2 总超氧化物歧化酶(T-SOD)活力 从图7可知,完整细胞菌悬液复合物SOD活力较单种乳酸菌完整细胞菌悬液小,灭活后的完整细胞复合物较灭活前的SOD活力略微下降。方差分析结果表明,乳酸菌完整细胞菌悬液复合状态对SOD活力无显著影响(p>0.05)。可能的原因为乳酸菌完整细胞的抗氧化物质具有与其他乳酸菌抗氧化物质协同或拮抗的作用。灭活后的发酵上清液复合物较灭活前的SOD活力小幅度提高。方差分析结果表明,乳酸菌发酵上清液复合物对总SOD活力无显著影响(p>0.05)。复合后的发酵上清液较单种乳酸菌发酵上清液SOD活力无明显变化。

图7 乳酸菌复合物的SOD活力
2.2.3 羟自由基清除 从图8可以看出,未灭活的完整细胞菌悬液复合物羟自由基清除率与单酸菌完整细胞菌悬液活性相当。灭活后的完整细胞复合物较灭活前的羟自由基清除率变大。其中,菊糖芽孢乳杆菌(Sporolactobacillusinulinus)与嗜酸乳杆菌(Lactobacillusacidophilus)复配的灭活前后完整细胞复合物的羟自由基清除率最高,灭活完整细胞悬液的羟自由基清除率(OH-·)最强,为82.40%;方差分析结果表明,乳酸菌完整细胞复合状态对羟自由基清除率无显著影响(p>0.05)。可能是因为乳酸菌完整细胞清除羟自由基的抗氧化物质无与其他物质协同或拮抗的作用。灭活后的发酵上清液复合物较灭活前的羟自由基清除率小幅提高。方差分析结果表明,乳酸菌发酵上清液复合状态对羟自由基清除率无显著影响(p>0.05)。其中,唾液乳杆菌与嗜酸乳杆菌发酵上清液复合物较单个乳酸菌的羟自由基清除率有较大提高。
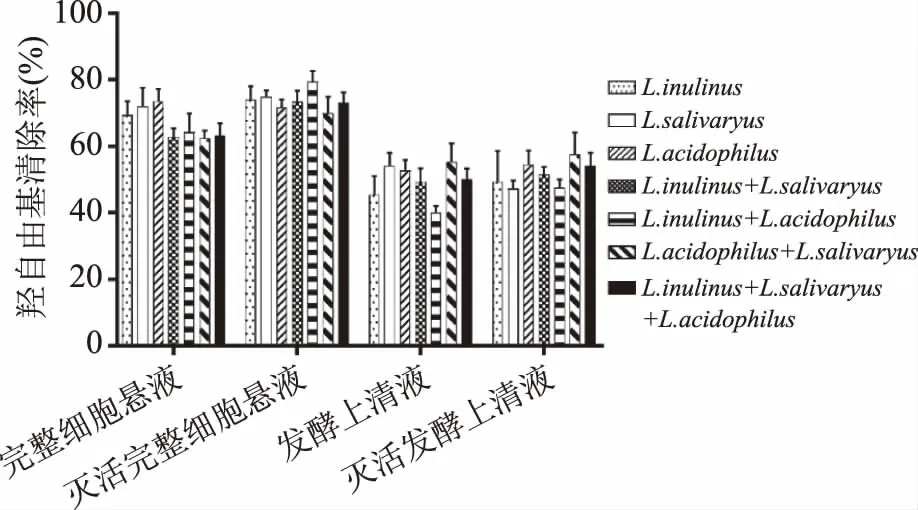
图8 乳酸菌复合物的羟自由基清除率
2.2.4 超氧阴离子清除率 从图9可以看出,乳酸菌完整细胞菌悬液复合物较单种乳酸菌有小幅提高,灭活后的完整细胞复合物较灭活前的超氧阴离子清除率变大。方差分析结果表明,乳酸菌完整细胞菌悬液复合状态对超氧阴离子清除率无很明显的作用(p>0.05)。灭活后的发酵上清液复合物较灭活前的超氧阴离子清除率无明显变化。乳酸菌发酵上清液复合状态对超氧阴离子清除率无显著影响(p>0.05)。
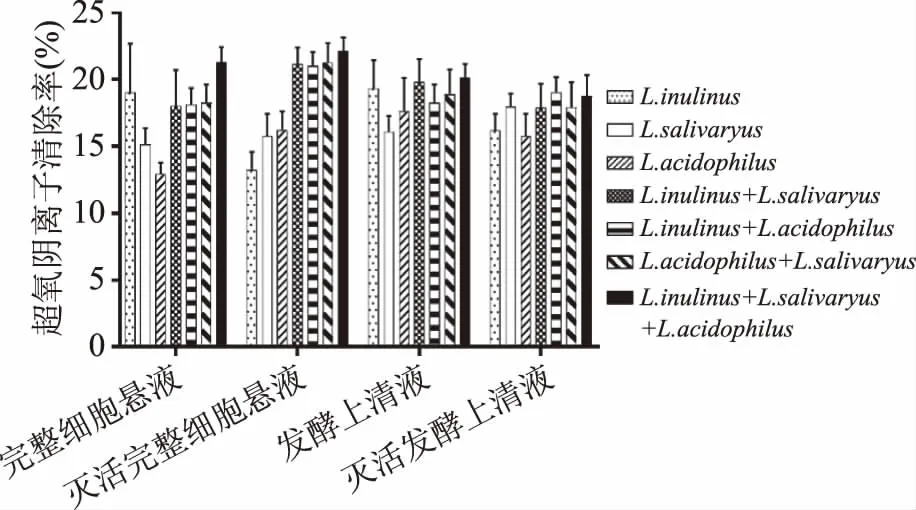
图9 乳酸菌复合物的超氧阴离子清除率
2.2.5 还原性 从图10可以看出,乳酸菌完整细胞菌悬液复合物较单种乳酸菌有小幅提高,灭活后的完整细胞复合物较灭活前的还原活性变大。方差分析结果表明,乳酸菌完整细胞菌悬液复合状态对还原活性无很明显的作用(p>0.05)。灭活后的发酵上清液复合物较灭活前的还原活性无明显变化,乳酸菌发酵上清液复合状态在还原活性上无显著影响(p>0.05)。

图10 乳酸菌复合物的还原性
3 结论

