3种杀菌处理对炭黑曲霉生长和赭曲霉毒素A产生量的影响
2019-07-10彭青枝杨冰洁王璐荣杨书珍朱晓玲
彭青枝,杨冰洁,王璐荣,杨书珍,朱晓玲
(1.湖北省食品质量安全监督检验研究院,湖北武汉 430070; 2.华中农业大学食品科技学院,湖北武汉 430070)
炭黑曲霉(Aspergilluscarbonarius)属于曲霉属黑色曲霉菌,能够侵染葡萄、谷物、咖啡、可可和花生等食品原料[1],其中从葡萄中分离得到的炭黑曲霉数量最多[2]。炭黑曲霉不仅是引起葡萄果实腐烂变质的腐败菌,同时也是葡萄中真菌毒素赭曲霉毒素A(ochratoxin A,OTA)的主要产生菌,广泛存在于许多国家和地区的葡萄及其制品中,是造成葡萄酒中OTA污染的主要来源。OTA是自然界中最常见、毒素最强的真菌毒素之一,对人类和动物有致畸[3]、致癌[4]、致突变[5]的风险,严重威胁了人类的健康,被国际癌症研究机构归为2B致癌物[6]。因此,寻找控制炭黑曲霉污染的有效措施对于新鲜果实原料及其制品的安全生产具有重要意义。
真菌生长及其毒素产生受物理、化学和生物等多方面因素的影响。目前果蔬采后生产中主要通过物理和化学途径来控制病原真菌的发生。温度处理、紫外处理和化学保鲜剂等方法对果蔬采后真菌病害具有良好的控制效果,被广泛应用于苹果、葡萄和杨梅等果蔬的采后杀菌保鲜[7-8]。适宜的温度处理能够有效控制采后病原微生物的生长和果蔬采后呼吸作用,延长果蔬采后寿命,被广泛应用于菠菜、杨梅等的采后保鲜[9]。紫外线照射通过穿透微生物的细胞膜,导致微生物繁殖力降低或死亡[10-11],被作为绿色、安全的果蔬保鲜杀菌技术广泛应用于苹果、樱桃、葡萄、柠檬等果实的采后杀菌保鲜[12]。化学杀菌处理由于操作方便、成本低廉、效果显著,被广泛应用于果蔬采后真菌病害的控制[13]。其中,多菌灵、抑霉唑和咪鲜胺对于采后病原真菌具有广谱的杀菌效果,在果蔬采后贮藏过程中广泛使用,但有关这些杀菌剂处理对采后病原真菌毒素产生的相关报道鲜见[14-15]。Medina等[16]研究发现中等浓度的多菌灵处理虽然能够显著抑制炭黑曲霉的生长,但却促进了OTA的大量产生;史祥鹏等[17]也发现温度处理对梨树腐烂病菌黑腐皮壳菌的生长和真菌毒素产生的影响并不一致。以上研究结果表明,如果采后杀菌处理使用不当,很有可能会刺激真菌毒素的大量产生,进而影响果蔬采后的安全贮藏与加工[18-19]。但目前有关采后杀菌处理对病原真菌产生毒素影响的报道鲜见。因此,本文拟果蔬采后常见产毒病原真菌炭黑曲霉为对象,研究常见的采后杀菌处理(温度处理、紫外照射处理、化学杀菌剂处理)对炭黑曲霉生长和真菌毒素OTA产生的影响,以期为果蔬采后贮藏和加工过程中真菌毒素的有效控制提供理论依据和参考。
1 材料与方法
1.1 材料与仪器
供试菌株炭黑曲霉(CICC 40296)从葡萄上分离 购自中国工业微生物菌种保藏中心,菌株用察氏培养基于25 ℃培养箱中培养,并在4 ℃条件下保存待用;硝酸钠、磷酸氢二钾、硫酸镁、氯化钾、硫酸亚铁、蔗糖、琼脂、乙腈、乙酸、无水硫酸镁、氯化钠、甲酸等 其中甲酸为色谱纯,其余均为分析纯,国药集团化学制剂有限公司。
EX20显微镜 宁波舜玉仪器有限公司;高压蒸汽灭菌锅YXQ-LS-18SI 上海博讯实业有限公司;高效液相色谱仪3000 赛默飞世尔科技;质谱仪Sciex Triple QuadTM6500 美国Abel公司;色谱柱Acquity UPLC BEH C18 Waters公司;氮吹仪DCY-12B 金昌公司;
1.2 试验方法
1.2.1 孢子菌悬液的制备 炭黑曲霉菌在察氏培养基平板上于25 ℃下培养6 d,待充分产孢后,用含吐温-80溶液10 mL轻轻洗下孢子,然后用3层无菌纱布过滤除掉菌丝,得到孢子菌悬液;然后再用无菌水调节菌悬液浓度为1×106个/mL备用。
1.2.2 孢子萌发试验 将察氏培养基涂布于已灭菌的载玻片上,待培养基充分凝固后,吸取40 μL孢子菌悬液接种在察氏培养基上,然后将载玻片放置在培养皿(底部铺一层吸水滤纸)中,置于25 ℃恒温培养箱中培养。每个处理设3次重复。培养7 h后观察孢子萌发情况,并按下列公式计算孢子萌发率和不同处理对孢子萌发的抑制率。


1.2.3 菌丝生长试验 将12 mL察氏固体培养基加入到直径7 cm培养皿中,待培养基充分凝固后,取4 μL菌悬液接种于培养基的正中央,然后置于25 ℃恒温培养箱中,培养5 d时,测量菌落直径。每个处理设3次重复。
1.2.4 炭黑曲霉 OTA的含量测定 将12 mL察氏固体培养基倒入至直径7 cm培养皿中,待充分凝固后,取50 μL菌悬液涂布在培养基上,然后放置于25 ℃恒温培养箱中培养7 d,取紧贴菌丝底部的培养基用于检测OTA含量;每个处理做3个重复,结果取平均值。OTA的含量测定采用超高效液相串联质谱(UPLC-MS)的方法进行,毒素提取和检测条件如下:
1.2.4.1 OTA的提取 准确称取培养7 d的察氏固体培养基5 g于具塞离心管中,加入10 mL 1%(v/v)乙酸的乙腈和10 ml超纯水,将所得溶液漩涡振荡提取30 min,加入4 g无水硫酸镁和1 g氯化钠,轻轻振荡1 min,在4000 r/min的转速下离心5 min,取上清液8 mL于40 ℃下氮吹至近干,残余物质用1 mL 70%(v/v)甲醇水复溶,过0.22 μm微孔滤膜,滤液经 UPLC-MS/MS测定。
1.2.4.2 OTA检测 超高效液相串联质谱条件:采用电喷雾离子源,正离子模式(ESI+),质谱扫描方式:多反应监测(MRM),电离电压3 kV,离子源温度120 ℃,脱溶剂温度380 ℃,脱溶剂气流量800 L/h,碰撞气流量0.18 L/min,锥孔反吹气流量50 L/h,离子对404.2/239,锥孔电压70 V,碰撞电压32 V。
1.2.5 采后杀菌处理条件
1.2.5.1 紫外杀菌 分别将接种炭黑曲霉菌悬液的察氏培养基平板,放置在光强为60 Lux的紫外光下照射0、15、30、45、60和75 min;以未照光处理为对照。然后按本文1.2.2,1.2.3,1.2.4中的方法进行孢子萌发、菌丝生长和OTA产生的评价。
1.2.5.2 温度处理 将接种了炭黑曲霉菌悬液的察氏培养基平板分别放置在4、15、20、25、30、35 ℃温度下培养,以25 ℃下培养为对照。然后按本文1.2.2,1.2.3,1.2.4中的方法进行孢子萌发、菌丝生长和OTA产生的评价。
1.2.5.3 化学杀菌剂处理 分别将抑霉唑、多菌灵和抑霉唑加入察氏培养基中,采用对倍稀释法稀释,使抑霉唑浓度0、0.03、0.06、0.12、0.24、0.48 μg/mL,咪鲜胺浓度为0、0.06、0.12、0.24、0.48、0.96 μg/mL,多菌灵浓度0、0.24、0.48、0.96、1.92、2.84 μg/mL,以不加药的察氏培养基作为对照。然后按本文1.2.2,1.2.3,1.2.4中的方法进行孢子萌发、菌丝生长和OTA产生的评价。
1.3 数据处理
采用Excel 2010软件对实验数据进行整理绘图,用SPSS 17.0软件对数据进行方差分析,数据结果以平均值±标准差表示。
2 结果与分析
2.1 紫外处理对炭黑曲霉生长及OTA产生量的影响
本试验研究了不同紫外照射时间对炭黑曲霉生长和真菌毒素OTA产生的影响。由图1可知,紫外照射处理可以抑制炭黑曲霉的生长,且抑菌效果随紫外照射时间延长而提高,照射75 min时,孢子萌发率和菌落生长直径分别为35.39%和1.7 cm,显著低于未经紫外照射处理的真菌孢子萌发率和菌落直径(91.32%和5.2 cm)。表明紫外照射能够抑制炭黑曲霉的生长。有研究证明紫外照射能够抑制黄曲霉菌的生长,且随着照射时间的延长抑制率增加[20-21]。紫外线能够抑制真菌生长主要是由于破坏了微生物的DNA的结构,引发突变,使细胞的遗传活性丧失,从而真菌生长受到抑制[22]。但本试验研究发现,紫外照射后炭黑曲霉的产毒规律与生长规律并不一致。当紫外照射时间为45 min时,OTA的产生量最多,达到14.48 ng/g,是对照组的3.18倍,之后OTA的产生量随着照射时间的延长而下降。Ribeiro等[23]也发现,一定强度的γ射线处理刺激了黄曲霉和赭曲霉产生大量的真菌毒素,推测可能与γ射线处理使真菌处于一定的胁迫条件有关。因此,在本试验中,中等时间的紫外处理可能使炭黑曲霉处于胁迫状态,进而刺激了炭黑曲霉产生大量包括OTA在内的次生代谢物质,以增强机体的防御能力。但长时间的紫外处理会抑制甚至杀死炭黑曲霉,降低了炭黑曲霉的代谢活性,从而使OTA的产生量下降。
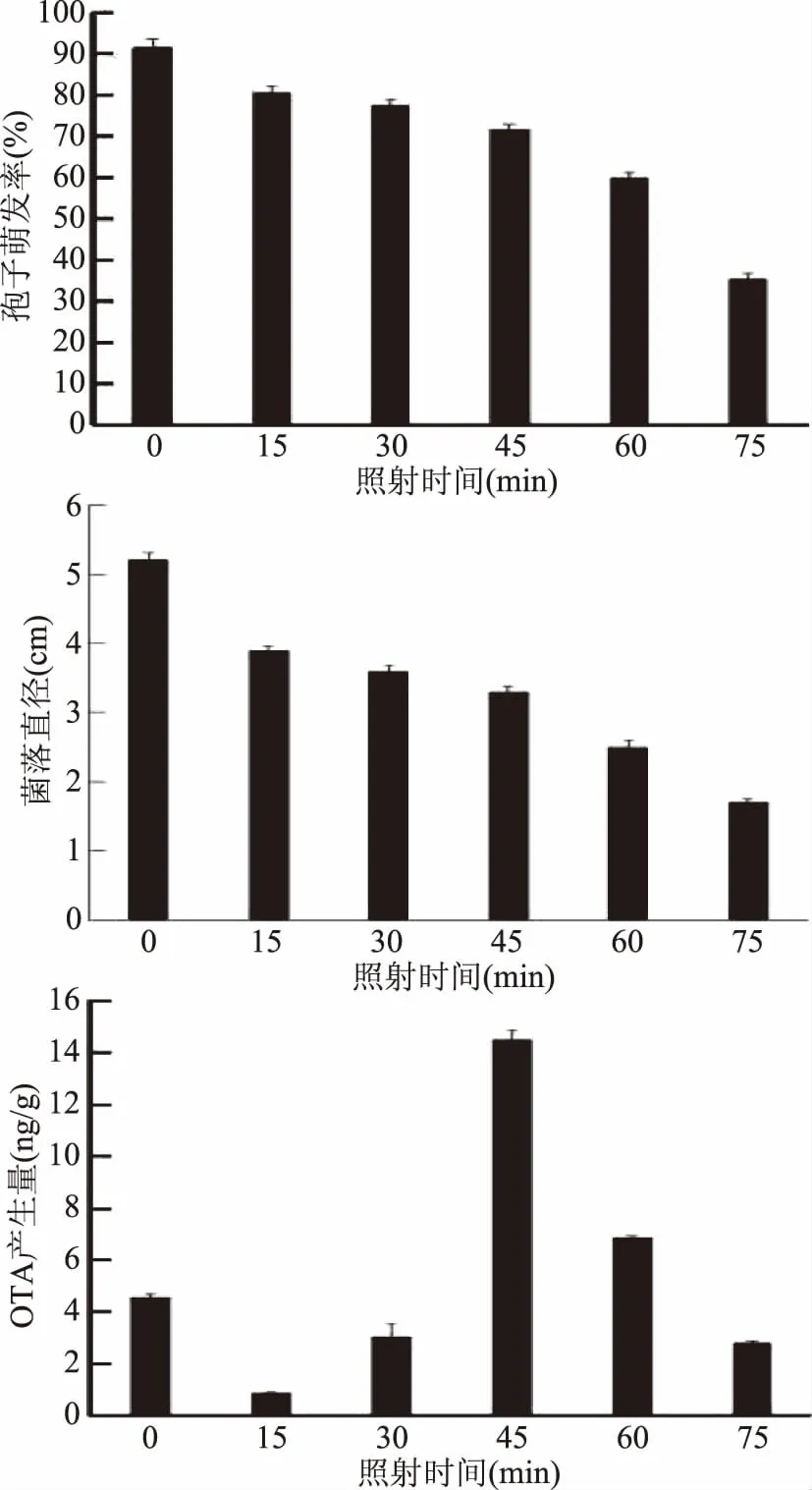
图1 紫外照射对炭黑曲霉生长和毒素产生的影响Fig.1 Effects of ultraviolet light irradiation on grow and toxins of A. carbonarius
2.2 温度处理对炭黑曲霉生长及毒素产生量的影响
本试验研究了不同培养温度对炭黑曲霉的生长和OTA产生的影响。从图2中看出,培养温度对炭黑曲霉的孢子萌发和菌落直径生长有明显的影响。4 ℃时,炭黑曲霉的生长被完全抑制;在4~25 ℃的范围内,随着温度的升高,孢子萌发和菌落直径都呈现上升趋势,在25 ℃的条件下炭黑曲霉的孢子萌发率和菌落直径达最大,分别为89.80%和5.51 cm。之后随着温度升高菌落生长和孢子萌发会受到抑制,尤其在35 ℃下真菌生长受到强烈抑制,孢子萌发率和菌落生长直径分别下降至69.12%和4.45 cm。
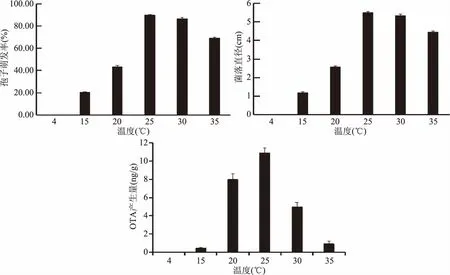
图2 温度处理对炭黑曲霉生长和OTA产生的影响Fig.2 Effects of culture temperature on grow and toxins of A. carbonarius
温度对炭黑曲霉产生OTA的影响与其对菌体生长的影响相似。4 ℃时,培养基中未检出OTA;在4~25 ℃的范围内,随着温度的升高,OTA产生量也增加,25 ℃时OTA产生量最高,达到10.91 ng/g。当温度高于30 ℃时,随着炭黑曲霉的生长受到抑制,OTA产生量也大幅度下降。Oviedo等[24-25]在研究温度对大豆中链格孢菌生长与真菌毒素产生的影响时,也发现温度对链格孢菌生长的影响规律与对毒素产生的影响规律相一致,低温和高温均不利于链格孢菌的生长和毒素的产生。Pose等[26]发现低温(6 ℃)和高温(35 ℃)均能显著抑制链格孢菌在番茄合成培养基中的生长和链格孢毒素的产生,并认为低温有利于番茄制品的安全贮藏。因此,低温贮藏和高温处理是抑制炭黑曲霉生长和降低OTA产生的有效措施。
2.3 采后化学杀菌剂处理对炭黑曲霉生长和OTA产生的影响
化学杀菌剂通过抑制生物合成途径中的酶活性,阻碍麦角甾醇的合成,导致真菌细胞膜结构破坏和细胞死亡[27]。本试验中研究了抑霉唑、多菌灵、咪鲜胺3种常用化学杀菌剂对炭黑曲霉生长和OTA产生的影响。由图3可以看出,所测试的多菌灵、抑霉唑、咪鲜胺对炭黑曲霉的菌落生长和孢子萌发均表现出较强的抑制作用,并呈浓度效应。多菌灵、抑霉唑、咪鲜胺分别在0.48、0.48和 0.96 μg/mL时,能够完全抑制炭黑曲霉的孢子萌发和菌丝体生长。而3种杀菌剂处理在低于最低抑菌浓度的条件下对OTA的产生具有显著的促进作用,并且随着杀菌剂处理浓度的增加,OTA的产生量出现先增加后下降的趋势。多菌灵的浓度为0.12 μg/mL时OTA的产生量最大,达到12.24 ng/g,是对照的6.31倍,抑霉唑和咪鲜胺在0.06 μg/mL时的产生量最大,OTA的产生量达到10.62 ng/g和18.14 ng/g,是对照组的23.7倍和6.17倍。以上结果表明常见采后杀菌剂多菌灵、抑霉唑、咪鲜胺虽然在低浓度和中等浓度下能够抑制炭黑曲霉的生长,但却刺激了真菌毒素OTA的大量产生。张艳军等[27]在研究嘧菌酯或多菌灵对禾谷镰孢菌的影响时,也发现了类似的现象。有些化学杀菌剂对病原真菌毒素的产生确实存在低浓度促进、高浓度抑制的现象。这些现象可能与化学杀菌剂的长期使用强化了病原真菌的防御系统,通过分泌真菌毒素增强机体的抗药性有关[28-29]。Terra等[30]发现大多数普遍使用的化学杀菌剂只有在生产商推荐的药剂使用剂量和条件下才能达到效果;杀菌剂的种类、剂量和环境温度是影响杀菌剂抑制病原菌生长和OTA产生的关键因素。因此,果蔬采后进行化学杀菌处理时,准确评价化学杀菌剂的安全抑菌浓度对于减少真菌毒素的积累具有重要意义。
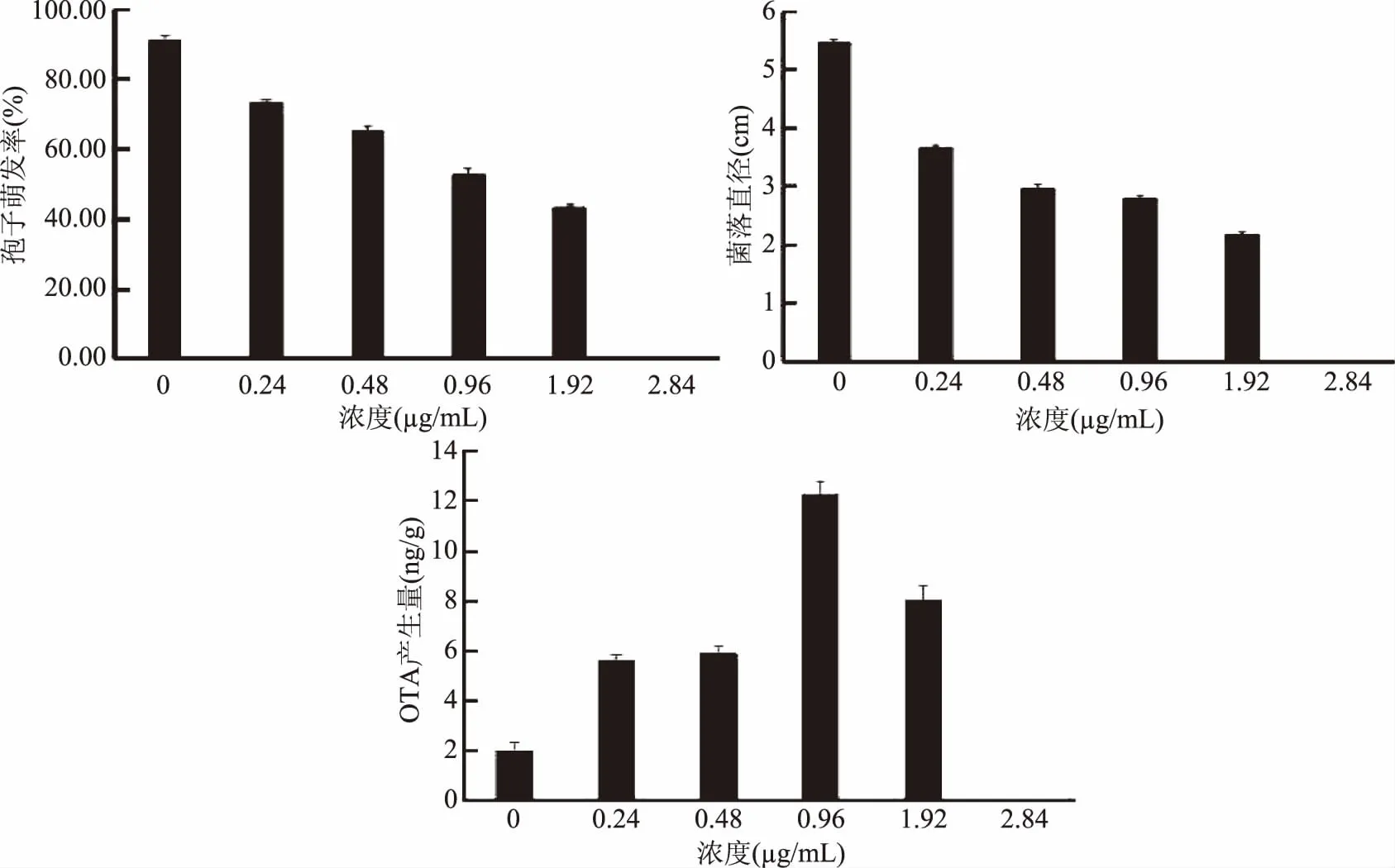
图3 多菌灵处理对炭黑曲霉孢子萌发、菌丝生长和OTA产生的影响Fig.3 Effect of carbendazim treatment on spore germination,mycelial growth and OTA production
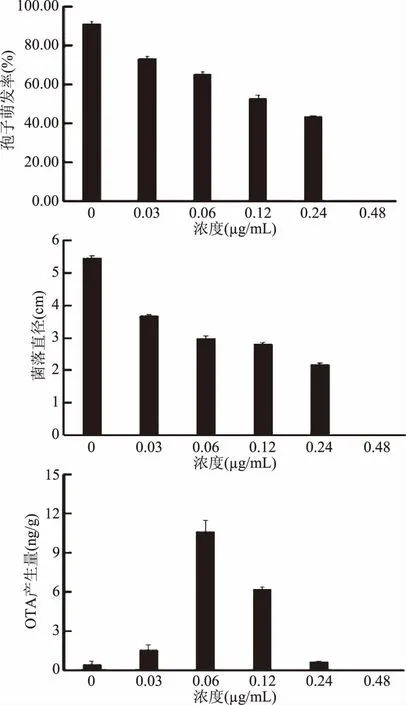
图4 抑霉唑处理对炭黑曲霉孢子萌发、菌丝生长和OTA产生的影响Fig.4 Effect of imazalil treatment on spore germination,mycelial growth and OTA production
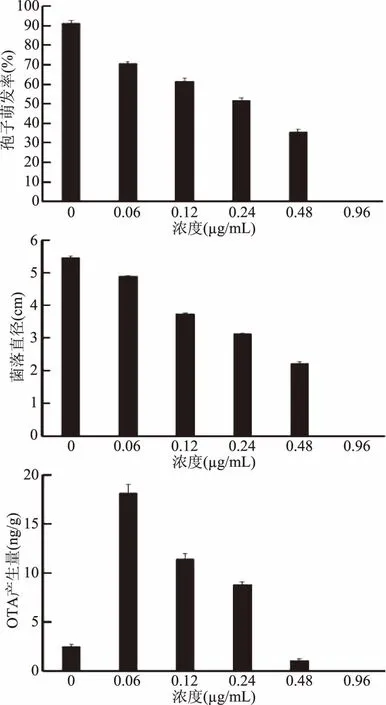
图5 咪鲜胺处理对炭黑曲霉孢子萌发、菌丝生长和OTA产生的影响Fig.5 Effect of prochloraz treatment on spore germination,mycelial growth and OTA production
3 结论
采后杀菌处理如紫外处理、温度处理(0~35 ℃)和化学杀菌剂多菌灵、抑霉唑和咪鲜胺处理对炭黑曲霉的生长均表现强烈的抑制作用,但对于OTA产生却表现出不同的影响。较短时间的紫外照射处理(紫外强度60 Lux,处理时间为45 min)或中等剂量的化学杀菌剂处理(多菌灵,0.96 μg/mL;抑霉唑和咪鲜胺,0.06 μg/mL)会刺激OTA的大量产生。而炭黑曲霉的最适生长温度与OTA最适产生温度相一致。因此,合理的贮藏温度和杀菌处理条件对于采后果蔬的安全生产具有十分重要的作用。
