CG5844基因沉默、过表达果蝇S2胚胎细胞中的剪接体组分表达观察
2019-07-10颜一丹栾晓瑾陈霞谢冰郑倩雯王敏陈万银乔晨于骏方杰
颜一丹,栾晓瑾,陈霞,谢冰,郑倩雯,王敏,陈万银,乔晨,于骏,方杰
(1江苏大学附属医院, 江苏镇江212001; 2江苏大学附属医院 )
果蝇(Drosophila melanogaster)的生殖系统简单、生命周期短、繁殖快、遗传背景清楚,已被作为经典模型用于研究生殖事件中复杂的遗传背景和相关分子机制[1~4]。精子的产生过程主要由生殖干细胞微环境(stem cell niche)调控。生殖干细胞(germline stem cells ,GSCs)是成体干细胞(Adult Stem Cells,ASCs)的一种类型,具有自我更新及分化潜能。而干细胞稳态维持需要生殖干细胞微环境的调控[5,6]。果蝇与哺乳动物精子的发生是一个高度保守的过程[1,6]。在果蝇睾丸的顶端,GSCs和包囊干细胞围绕着中心细胞,GSC非对称分裂产生两个子代细胞,其中一个因靠近niche继续维持干细胞的特性,另一个因远离niche而发育成为精原母细胞(gonialblast,GB),经过有丝分裂、减数分裂,最终发育成精子[7]。UAS-Gal4系统是果蝇遗传学中一种常用的异位表达系统, 通过UAS-Gal4系统可调控基因表达水平的改变。有研究[4]表明,通过UAS-Gal4系统可以在果蝇睾丸及卵巢中进行大规模的基因筛选,揭示GSCs的自我更新和分化中存在调控网络,并且筛选鉴定出多个影响GSCs维持、分化或涉及精子、卵子发生的其他过程的基因,并进一步对这些基因进行功能注释及解析[4,8]。在果蝇睾丸的筛选中,鉴定到一批与蛋白合成和降解相关且参与生殖干细胞微环境的调控因子[2],其中一个调控因子是CG5844。CG5844基因为果蝇睾丸GSC调节因子。研究[2]表明,参与mRNA剪接和翻译—蛋白质合成的一组基因有助于GSCs自我更新维持和早期生殖细胞分化。真核细胞mRNA剪接由一个巨大的、动态的复合物—剪切体完成,剪接体组分(U2A)可编码U2小核糖核蛋白颗粒(snRNP)的组成蛋白,它作为一种主要的剪接体亚基,与前体mRNA上的其他snRNP结合以组装剪接体。目前有研究显示,果蝇睾丸生殖细胞中U2A的缺乏将导致精原细胞无法分化为精母细胞和成熟的精子,最终影响雄性果蝇的生育能力[3]。目前关于CG5844基因在果蝇S2胚胎细胞中的功能及作用机制尚未被阐明。2017年12月~2018年12月,我们观察了沉默、过表达CG5844基因的果蝇S2胚胎细胞中的U2A表达变化,旨在探索CG5844基因在S2细胞中调控剪接体功能的机理,为果蝇生殖干细胞发生的潜在机制提供新的思路。
1 材料与方法
1.1 细胞、试剂及仪器 S2细胞购自于果蝇基因组学资源中心。携带有FAM荧光标记的小干扰RNA(FAM-siRNA)由苏州吉玛基因公司设计和合成。质粒CG5844、载体pUAS-attB、大肠杆菌DH5α均由本实验室保存。限制性内切酶、反转录酶、Taq 酶、TRIzol试剂、逆转录试剂盒均购自日本Takara公司;DNA凝胶回收试剂盒和质粒小抽试剂盒均购于美国Axygen公司。Lip2000脂质体、Hoechst 33342购于美国Invitrogen公司;免疫荧光一抗:兔抗U2A抗体由南京医科大学生殖医学国家重点实验室赠予,鸡抗GFP 抗体购于英国Abcam公司;免疫荧光二抗:Cy3标记驴抗兔IgG抗体、Alex Fluor 488标记驴抗鸡 IgG抗体购于美国Jackson公司。Effectene 转染试剂盒购于德国Qiagen公司;DMSO购于日本SIGMA公司;DMEM培养基、Opti-MEM培养液购于美国Gibco公司;胎牛血清购于以色列Bioind公司;引物合成于上海生物工程公司。
1.2 沉默CG5844表达的S2细胞CG5844基因及U2A表达观察
1.2.1 CG5844 siRNA敲减效率验证 2个CG5844 siRNA片段(siCG5844-1、siCG5844-2,均可沉默CG5844表达),取S2细胞分为A、B组,分别转染siCG5844-1、siCG5844-2,转染48 h后qRT-PCR法测算两组细胞CG5844基因相对表达量,进一步计算敲减率,A、B组敲减率分别为72.12%±3.68%、52.39 %±4.82%,二者比较,P<0.001。因此本实验选用siCG5844-1进行后续实验。
1.2.2 S2细胞分组及 CG5844 siRNA转染 取S2细胞分为观察A、对照A组,复苏细胞后,用完全培养基(DMEM+10%胎牛血清)进行培养,培养环境为28 ℃恒温培养箱,根据细胞生长速度和状态,及时进行细胞换液和细胞传代,并以适当密度重新接种至新的培养瓶中继续培养[9]。待细胞生长至适当密度(80%~90%)后,可进行转染。观察A、对照A组分别转染siCG5844-1、空白质粒。转染步骤如下:使用Effectene 转染试剂盒,每孔用共计0.8 μg质粒转染S2细胞,用缓冲液EC将质粒稀释至100 μL,涡旋后在室温下放置5 min。再加入20 μL Effectene转染试剂室温放置5 min,之后加入600 μL opti-MEM并混匀,此混合物为最终培养基。当进行敲减实验时,使用Lipo2000脂质体转染S2细胞。 首先用250 μL Opti-MEM稀释15 μL的Lipo2000,轻混匀后室温放置5 min,在250 μL opti-MEM中加入15 μL的siRNA,将两管混合物充分混匀后,室温放置20 min,使siRNA终浓度为150 nmol/L,4~6 h后更换成完全培养基继续培养至48 h。siCG5844-1携带FAM荧光标记,脂质体转染48 h时免疫荧光镜下可见绿色荧光细胞,表明转染成功。
1.2.3 A组 S2细胞CG5844基因检测 采用qRT-PCR法。 细胞总RNA的提取及逆转录反应按照说明书进行,荧光定量PCR反应体系在反应管中充分混匀,短暂离心,置入安捷伦Mx3000P荧光定量PCR仪中进行反应。GAPDH上游引物5′-GTGGTGAACGGCCAGAAGAT-3′;下游引物5′-GCCTTGTCAATGGTGGTGAA-3′。CG5844上游引物5′-TTAGCACCGACGAGAAGGAGGAG-3′;下游引物5′-AGTAGCCATTGATGCCGCACAC-3′。反应条件为: 95 ℃预变性10 min,95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸10 s,40个循环,检测荧光信号; 溶解曲线分析: 95 ℃ 15 s,60 ℃1 min,95 ℃ 30 s,60 ℃ 15 s。以GAPDH为内参,以2-ΔΔCt代表CG5844基因的相对表达量。实验重复3次,取平均值。
1.2.4 A组 S2细胞U2A检测 采用免疫荧光法。转染24 h时取两组细胞种板,再孵育24 h在培养皿中进行免疫染色,具体步骤如下:加入4%多聚甲醛200 μL固定30 min。在含有0.1%Triton X-100(PBST)的1x PBS中洗涤3次,并在5%牛血清白蛋白(BSA)中封闭30 min后,将样品与一抗在室温孵育1 h。之后0.1%PBST中洗涤3次,每次10 min。然后将样品在室温下与二抗一起孵育1 h,之后在0.1%PBST中洗涤3次。最后在封片前用Hoechst 33342染色10 min。在奥林巴斯BX51荧光正置显微镜上捕获图像并使用Adobe Photoshop CS5软件处理。具体抗体信息如下:一抗:兔抗U2A抗体(1∶1 000稀释);鸡抗GFP 抗体(1∶1 000稀释)。二抗:Cy3标记驴抗兔IgG抗体(1∶1 000稀释);Alex Fluor 488标记驴抗鸡 IgG抗体(1∶1 000稀释)。使用Image J软件对两组细胞的免疫荧光强度进行分析,测算U2A的相对表达量。实验重复3次,取平均值。
1.3 CG5844过表达的S2细胞CG5844基因及U2A表达观察
1.3.1 pUAS-attB-CG5844重组表达载体构建 利用Vector NT1软件设计引物并送生物公司合成,引物序列如下:CG5844上游引物5′-ATAAGAATGCGGCCGCGATGCTTCGCAAATTTGGAGGTC-3′, 下游引物 5′-GCTCTAGACTACTTTTCGTTTGGCTTATCCTTGG-3′。PCR扩增CG5844的CDS片段,并对PCR产物进行琼脂糖电泳,在紫外分析仪中切取含有目的片段的凝胶,并用DNA凝胶回收试剂盒纯化PCR产物。之后用限制性内切酶对纯化产物和pUAS-attB空载体进行双酶切(37 ℃,3 h),通过T4连接酶对以上酶切产物进行连接(16 ℃,1 h),使用感受态细胞(DH5α)对连接产物进行转化并涂布至带有氨苄抗性的LB平板上倒置培养(37 ℃,12~16 h)。挑取单克隆后进行扩大培养(37 ℃,250 rpm,16 h),并用质粒抽提试剂盒对菌液进行抽提,之后进行双酶切鉴定。结果显示,质粒被酶切成两条带,与DNA Marker比对发现,一条大于2 000 bp,另一条带位于1 000 和2 000 bp之间,而pUAS-attB载体和CG5844片段的大小均分别位于这两个区间,后续测序结果显示与已知序列一致,表明本研究已正确构建pUAS-attB-CG5844质粒(可过表达CG5844)。
1.3.2 S2细胞分组及pUAS-attB-CG5844转染 取S2细胞分为观察B、对照B组,待细胞生长至适当密度(80%~90%)后,可进行转染。观察B、对照B组分别转染pUAS-attB-CG5844、载体pUAS-attB。转染步骤同“1.2.2”。转染4~6 h后更换完全培养基继续培养至48 h。为了验证重组质粒转染效率,转染时通过Ub-Gal4驱动pUAS-attB-CG5844的同时,驱动pUAS-attB-GFP作为荧光标记,免疫荧光镜下可见观察B组GFP信号明显多于对照B组说明转染成功。
1.3.3 B组细胞CG5844基因检测 采用qRT-PCR法。 所有操作均同“1.3.3”。以GAPDH为内参,以2-ΔΔCt代表CG5844基因的相对表达量。实验重复3次,取平均值。
1.3.4 B组细胞U2A检测 采用免疫荧光法。所有操作均同“1.3.4”。使用Image J软件对两组细胞的免疫荧光强度进行分析,测算U2A的相对表达量。 实验重复3次,取平均值。

2 结果
2.1 沉默CG5844表达的S2细胞CG5844基因、U2A相对表达量比较 观察A、对照A组CG5844基因相对表达量分别为0.29±0.04、1.0± 0,二者比较,P<0.05。观察A、对照A组U2A相对表达量分别为11.34±0. 58、1.65±0.23,二者比较,P<0.05。见图1。
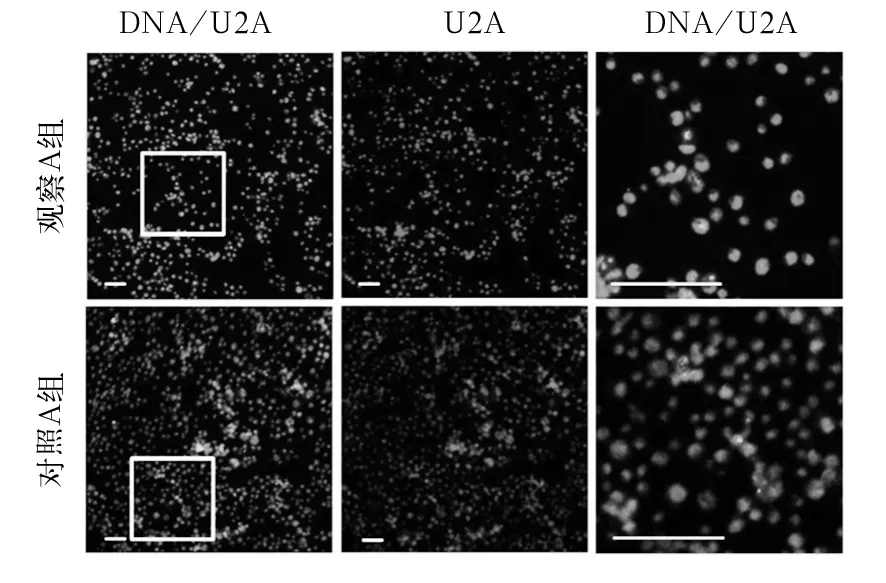
图1 观察A组、对照A组U2A表达情况观察(比例尺:30 μm)
2.2 CG5844过表达的S2细胞CG5844基因及U2A相对表达量比较 观察B、对照B组CG5844基因相对表达量分别为18.87±2.44、1.0±0,二者比较,P<0.05。观察B、对照B组U2A相对表达量分别为1.30±0.07、2.17±0.06 ,二者比较,P<0.05。见图2。

图2 观察B组、对照B组U2A表达情况观察(比例尺:30 μm)
3 讨论
根据flybase数据库(http://flybase.org/)结果显示,CG5844基因在果蝇睾丸中优势表达,并且被发现为果蝇睾丸GSC调节因子。目前,关于CG5844基因的相关报道较少,且在果蝇中的生物学功能和调控机制尚不清楚,因此具有较高的创新性。已有的研究[10]显示,CG5844基因可影响线粒体功能,从而参与果蝇S2胚胎细胞中缺氧诱导的蛋白翻译的抑制。翻译的调控在干细胞生物学的调节中具有重要作用。目前已有研究[11]报道了翻译调节在小鼠胚胎干细胞中的重要性,其在分化期间显示出mRNA水平和翻译的显著增加。
应用RNA干扰技术特异性地敲减靶基因,已成为目前使用最为活跃及常规的分子生物学方法。而通过过表达使基因表达改变,是反向遗传学基因功能研究的重要方法之一[12]。本实验分别应用RNA干扰技术和Ub-Gal4系统介导CG5844基因在S2细胞中的敲减及过表达,研究了CG5844基因在S2细胞中的表达及其可能调控作用,发现CG5844影响U2A的表达水平,提示CG5844可能通过影响剪接体,从而调控S2细胞的命运。
剪接体成分复杂,构象高度动态,其由五个小核糖核蛋白(snRNP)复合物(U1,U2,U4,U5和U6)和大约150种蛋白组成[13]。mRNA加工所需的主要剪接体对于真核生物基因的表达必不可少,并且在疾病的发生发展中具有重要意义[14]。RNA剪接过程中剪接体组分的功能作用和逐步装配途径已经得到很好的研究,RNA剪接过程由snRNP和其他剪接因子逐步相互作用催化,随后形成剪接体复合物,称为E,A,B,Bact和C复合物。在剪接因子SF3b1与U2辅助因子(U2AF)相互作用后,SART1预组装tri-snRNP U4-U6 / U5被募集到A复合体,从而形成具有催化活性的剪接体。基于微阵列分析的研究显示,SNRPA1被鉴定为关键的剪接体成分,其在调节人类干细胞多能性的获得和维持中起关键作用[15]。Pre-mRNA募集U2 snRNP是剪接体装配中的关键步骤,而U2A是U2 snRNP特异性蛋白之一,它作为一种主要的剪接体亚基,对雄性生育力至关重要。研究[3,16]显示,U2A的人类同源基因SNRPA1在果蝇中的点突变也将导致精原细胞分化障碍,生殖细胞将无法发育成为成熟的精子。Sm蛋白是剪接体小核糖核蛋白的共同核心的重要组分, 学者Anne等[17]在对果蝇卵子发生过程中SmB分布的分析表明,精氨酸甲基化在指导SmB的亚细胞定位中有关键作用,并且该修饰特异性地促进了生殖细胞的形成和发育。精原母细胞在进行减数分裂形成精母细胞进而分化为成熟精子之前,将进行4次有丝分裂生成16个精原母细胞,此过程称为转换扩增分裂过程(Trans-Amplication,TA)。Mei-P26蛋白主要在GSC和精母细胞中高表达,一系列研究报道[11]显示Mei-P26的表达由Bam、CCR4、Tut等共同作用调控,而它的表达与否决定了GSC是否从TA增殖阶段进入分化阶段, Mei-P26在生殖细胞形成和成熟过程中调控不同的发育程序,且发挥关键性作用。研究[18]表明,在果蝇精子形成过程中,polo基因突变体将导致严重的胞质分裂缺陷,且Aurora A作为重要的细胞周期调节蛋白在此过程中也发挥不可或缺的作用。另外,果蝇boule基因突变可以导致生殖细胞发育阻滞和无精子症,提示果蝇精子发生过程中细胞的分化需要众多基因产物的协调作用[19]。目前已有研究[20~22]报道显示,蛋白质合成的调节对于果蝇睾丸和卵巢中GSC的自我更新至关重要。在RNAi转基因果蝇筛选中,发现有9种核糖体蛋白、4种剪接体相关蛋白以及3种eIF3复合蛋白有助于GSC的干性维持和早期生殖细胞分化[2]。本实验通过免疫荧光实验结果分析,敲减CG5844时U2A蛋白表达水平上调。反之,在S2细胞实现CG5844过表达时,U2A蛋白表达水平下调,剪接体的表达受到抑制,提示CG5844与剪接体之间存在竞争性关系。
综上所述,在S2胚胎细胞中CG5844基因可能通过调控剪接体关键蛋白U2A的表达,从而影响剪接体的功能,最终影响S2细胞的发育。研究CG5844基因对S2细胞的具体调控机制为男性不育的致病机制提供新的见解。
