尼古丁诱导人肠道上皮细胞自噬水平的研究
2019-07-10高茜杨斌管莹毕品端黄海涛曾婉俐向海英刘欣米其利李雪梅
高茜,杨斌,管莹,毕品端,黄海涛,曾婉俐,向海英,刘欣,米其利,李雪梅*
1 云南中烟工业有限责任公司,云南省昆明市高新区科医路41号,650024;
2 昆明医科大学第一附属医院,云南省昆明市西昌路295号,650032
炎症性肠病(Inflammatory bowel disease,IBD)是一类慢性、易复发的消化系统疾病,主要包括溃疡性结肠炎(Ulcerative Colitis,UC)和克罗恩病(Crohn's disease,CD)[1]。由于饮食结构的变化,IBD在我国的发病率呈现不断升高趋势[2]。目前,IBD尚无有效的根治手段,但多数患者可通过药物治疗使病情得到有效缓解。烟碱,俗名尼古丁,是一种从茄科植物(茄属)中提取出的三级胺生物碱,也是烟草的重要成分[3],已被用作溃疡性结肠炎患者的治疗剂[4]。咀嚼尼古丁口香糖可有效控制轻度至中度结肠炎的临床病症[5]。尽管如此,尼古丁的作用机制尚不清楚。
自噬是一种特殊的细胞内吞噬现象,能够主动吞噬细胞内的受损细胞器、蛋白质等内容物,降解成氨基酸、核糖等代谢物重新用于生物合成和供能,进而维持细胞稳态[6]。在消化系统疾病最常发生的内质网应激(Endoplasmic reticulum stress,ERS)中,自噬通过消化蛋白聚集物和错误折叠蛋白维护内质网功能,限制ERS诱导的细胞凋亡,从而保护消化道细胞[7]。研究证实自噬是消化道炎症反应的一个重要调节靶点。一项GWAS分析显示自噬基因ATG16L1的多态性位点与IBD的发病率存在相关性[8]。这些证据说明自噬在消化系统疾病中扮演重要角色。本研究的主要目的是观测尼古丁对上皮细胞自噬的诱导作用及分子机制,了解该机制将有助于为IBD的治疗和预防带来新的策略。
1 材料和方法
1.1 主要试剂和仪器
DMEM培养基、PBS、胎牛血清、0.25%胰蛋白酶、青霉素和链霉素、lipofectamine 2000均购自美国Thermo公司;Cell Counting Kit-8(CCK-8)试剂盒(Dojindo,日本);预染蛋白Marker(Thermo公司,美国),兔抗人LC3、Beclin1、p62、β-actin抗体(SantaCruz公司,美国);BCA蛋白浓度检测试剂盒(Thermo公司,美国),十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)(碧云天公司,江苏)
酶标仪(Tecan,Mannedorf,Switzerland),电泳及转移系统(Bio-Rad公司,美国),Odyssey扫描仪(LiCor公司,美国),分光光度计(Jenway公司,英国),荧光显微镜(Olympus公司,日本)。
1.2 实验方法和条件
1.2.1 人肠道上皮细胞培养及处理
人肠道上皮细胞(Hunman intestinal epithelial cells,hIECs)来源于中国科学院昆明动物研究所。使用含10%胎牛血清的DMEM,置于37℃下5%CO2细胞培养箱中培养,每3天常规换液,待细胞增殖至板底面积90%时胰酶消化传代,第4代hIECs用于后续实验,培养基为含10%胎牛血清的DMEM。
1.2.2 CCK8检测细胞增殖情况
使用CCK8试剂盒并根据使用说明测定细胞活力。将hIECs在96孔板中培养以达到所需的汇合。将细胞与不同浓度的尼古丁(0、2.5、5和10 μM)一起孵育。在尼古丁处理24小时后,向每个孔中加入10 μlCCK-8溶液。再将细胞在37℃下孵育2小时。使用酶标仪(Tecan,Mannedorf,Switzerland)在450nm处读取吸光度。
1.2.3 Western-blot检测自噬标志蛋白和mTOR通路相关蛋白的表达
取生长状态良好的hIECs,以每孔2×105个细胞的密度接种于六孔板中,待细胞生长至80%后分别给予0、2.5、5和10 μM的尼古丁作用24 h,PBS洗涤后每孔加入120 μL含1 mM蛋白酶抑制剂的细胞裂解液(ridio-immunoprecipition assay,RIPA),在冰上充分裂解后刮取细胞。将细胞裂解混合物移至EP管中,4 ℃、12 000 r离心15 min。收集上清,采用BCA 法测定蛋白质浓度。每孔进样总蛋白30 μg,进行SDS-PAGE蛋白电泳。电泳分离蛋白后,采用恒流200 mA的湿转法将蛋白转移至PVDF膜上。5% 脱脂牛奶室温封闭1 h后,孵育一抗(LC3B,1:300稀释;Beclin1,1:500稀释;p62,1:500稀释;β-actin,1:1000稀释),4 ℃过夜。室温孵育二抗2 h后,进行化学发光检测。以β-actin为内参,计算LC3BII、Beclin1、p62与内参的灰度值的比值,得出各个蛋白的相对表达量。
1.2.4 透射电子显微镜(transmission electron microscope,TEM)观察hIECs内自噬体的形成情况
取生长状态良好的hIECs,制备成密度为2×105个/mL细胞悬液,取2 mL接种于25 cm2培养瓶中,待细胞生长至80%后,实验组给予0、2.5、5和10 μM的尼古丁作用24 h,胰蛋白酶消化后制成密度为1×106个/mL细胞悬液,4℃、1 200 r离心5 min后弃上清,加入1 mL预冷2.5%戊二醛固定,4℃过夜,根据文献[13]的操作步骤进行后续实验操作。
1.2.5 GFP-LC3自噬斑点检测
取生长状态良好的hIECs,以每孔2×105个细胞的密度接种于6孔板,待细胞生长至80%时,使用lipofectamine 2000将GFP-LC3质粒转染细胞。转染24 h后,再给予0、2.5、5和10 μM的尼古丁作用24 h。使用倒置荧光显微镜(Olympus FV1000,Tokyo,Japan)进行图像采集。
1.2.6 统计学分析
使用SPSS 19.0软件对数据进行分析,采用单因素方差分析检验组间差异,检验水准为双侧α=0.05。
2 结果
2.1 尼古丁对细胞形态的影响
人肠道上皮细胞hIECs在常规细胞培养条件下,呈现出不规则的形态,并且单层细胞为贴壁生长的,细胞核较大,而细胞质相对较少。2.5 μM尼古丁处理的细胞的形态更倾向于正常细胞形态,仅有少部分细胞出现形态变化。而10 μM尼古丁作用细胞后,细胞核固缩,细胞体积变小、形状变圆,脱壁细胞越来越多,但是它的细胞膜突起反而变少(图1)。

图1 不同浓度尼古丁对于结肠上皮细胞形态的影响Fig.1 The effect of different concentrations of nicotine on hIEC morphology
2.2 尼古丁对细胞增殖的影响
进一步采用CCK8法检测尼古丁对细胞增殖的影响。结果发现,随着尼古丁浓度的增加,人肠道上皮细胞的增殖明显受到抑制。2.5 μM尼古丁对细胞增殖抑制程度较低;而5 μM和10 μM尼古丁显著抑制细胞增殖(图2)。
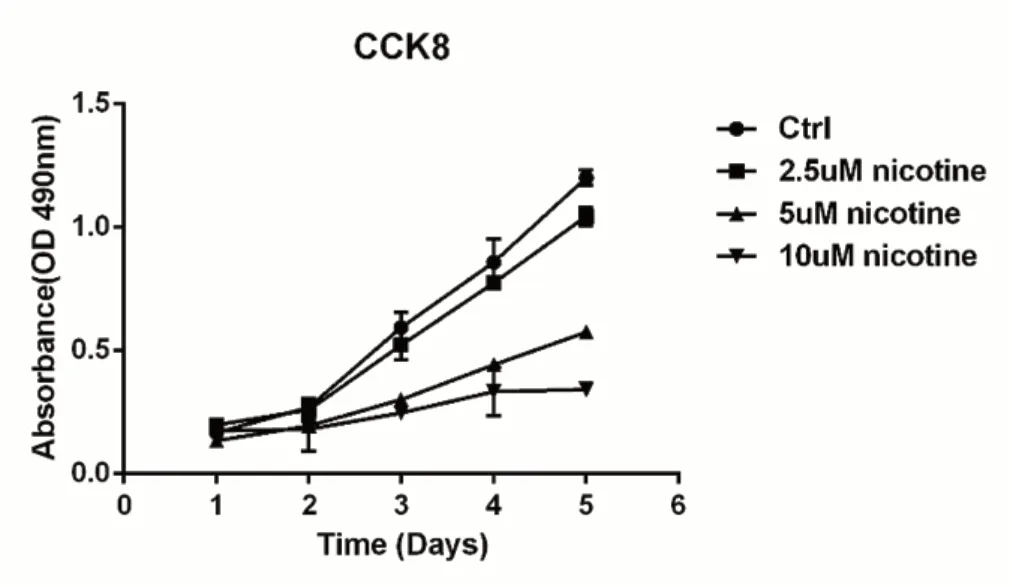
图2 不同浓度尼古丁对于结肠上皮细胞增殖的影响Fig.2 The effect of difference concentrations of nicotine on hIEC proliferation
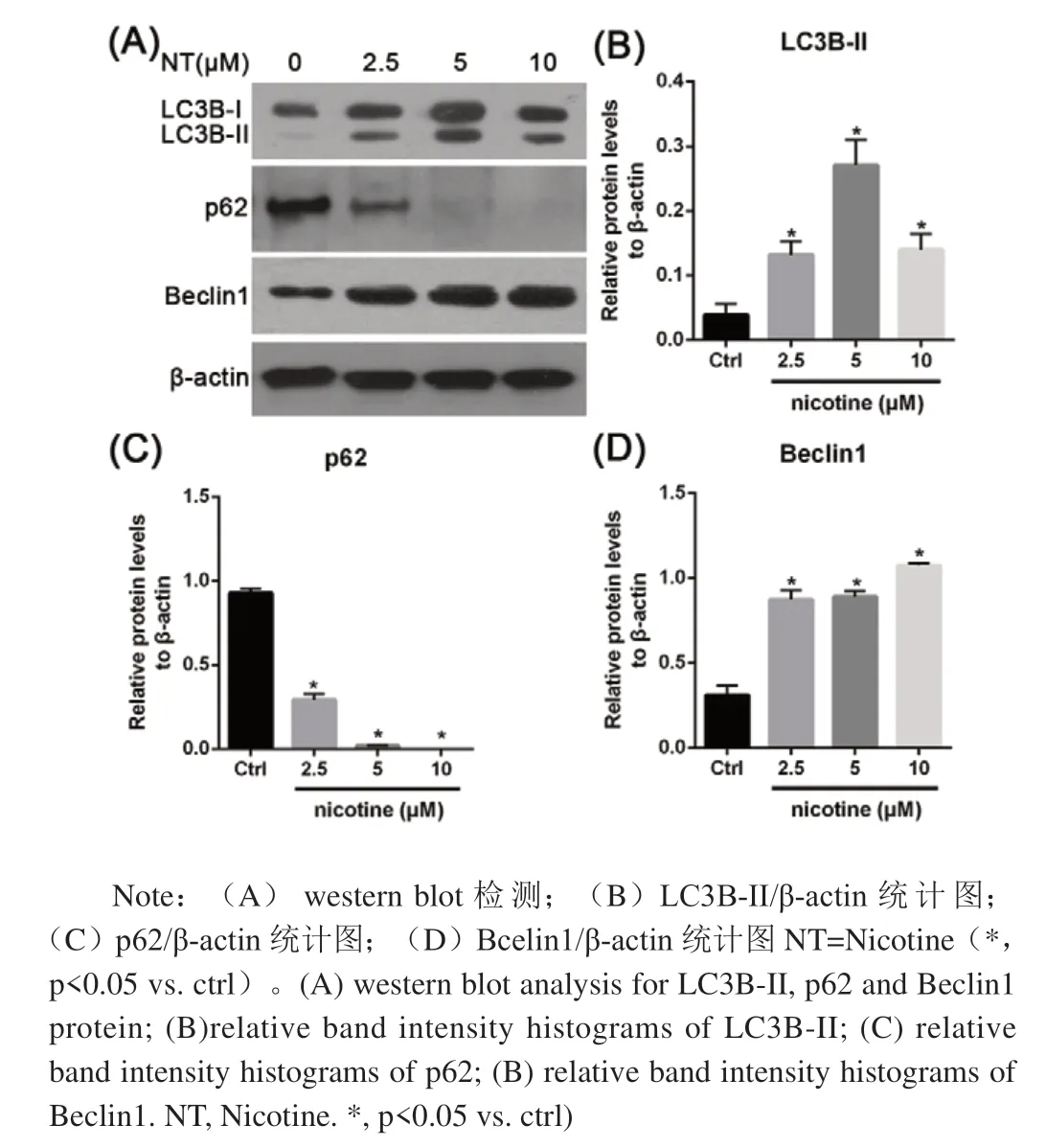
图3 尼古丁对自噬标志物表达水平的影响Fig.3 The expression of LC3B-II,p62 and Beclin1 protein in hIEC treated with nicotine
2.3 尼古丁对细胞中自噬标志物的影响
Western blot结果如图3A所示:尼古丁作用24h后,与空白对照组相比,Beclin1和LC3B-II表达水平明显升高,差异有统计学意义(P<0.05),且这一升高趋势呈现浓度依赖(图3B和图3D)。p62在正常细胞中高表达,不同浓度的尼古丁处理后,其表达水平显著降低(P<0.05)(图3C)。这说明尼古丁能够引起自噬标志性蛋白表达水平的改变。
2.4 尼古丁作用后细胞内自噬小体的形成以及数量变化
不同浓度的尼古丁作用细胞24 h后行TEM观察。与未处理组相比,尼古丁处理后细胞出现多个双层的自噬泡,并形成自噬小体(黑色箭头示)。统计学结果显示,尼古丁处理后细胞内自噬小体的数量明显增高,但不同浓度之间无统计学差异(图4)。
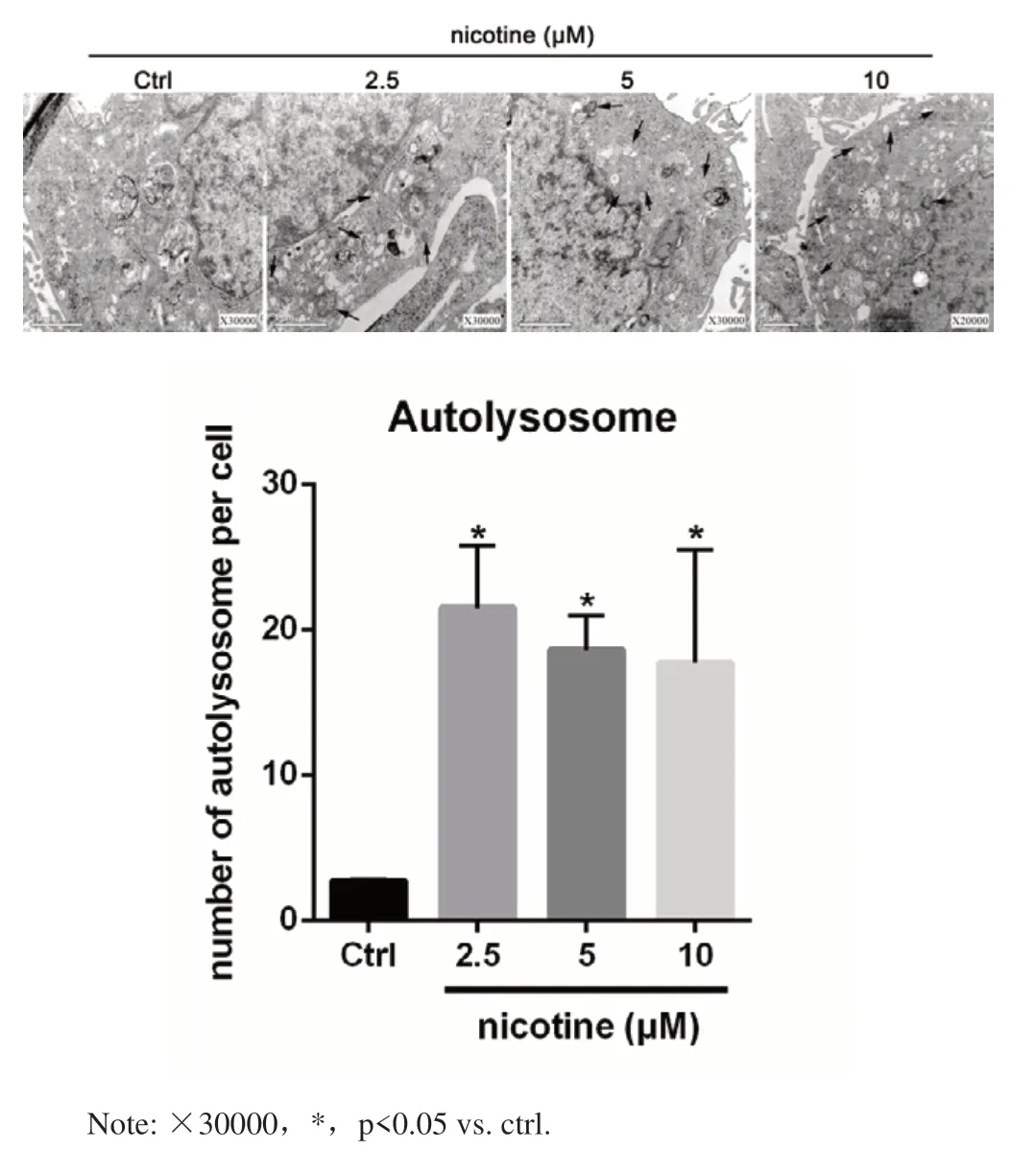
图4 尼古丁诱导的电镜下自噬小体的数量变化Fig.4 The change of number of autophagosomes in hIECs treated with nicotine by TEM
2.5 尼古丁对GFP-LC3转染细胞中自噬斑点的影响
将GFP-LC3转染至待测细胞,并通过荧光显微镜或激光共聚焦显微镜观测、定量GFP-LC3的荧光亮点,是目前应用较为广泛的哺乳动物细胞自噬检测技术。本研究利用该技术手段对尼古丁诱导的自噬进行检测,结果发现未处理的细胞中绿色,荧光亮点数量均很低,而随着尼古丁处理浓度的增加,细胞中绿色荧光亮点数量显著增加,但不同浓度之间无统计学差异(图5)。

图5 尼古丁诱导的GFP-LC3自噬斑点的数量变化Fig.5 The change of number of nicotine-induced spots of LC3 in hIECs by GFP-LC3 assay
2.6 尼古丁诱导自噬的分子机制
已有的文献推测尼古丁诱导自噬的分子机制,一方面可能与内质网应激相关,另一方面可能与mTOR信号通路相关。采用western blot方法,对这两条信号通路上的关键因子进行检测。结果如图6所示,尼古丁可以增加ERS关键因子GRP78,以及下游信号通路中ATF/IRE1的表达水平。同时,尼古丁能够激活AMPK蛋白的磷酸化,并抑制Akt和mTOR蛋白的磷酸化水平,诱导自噬。
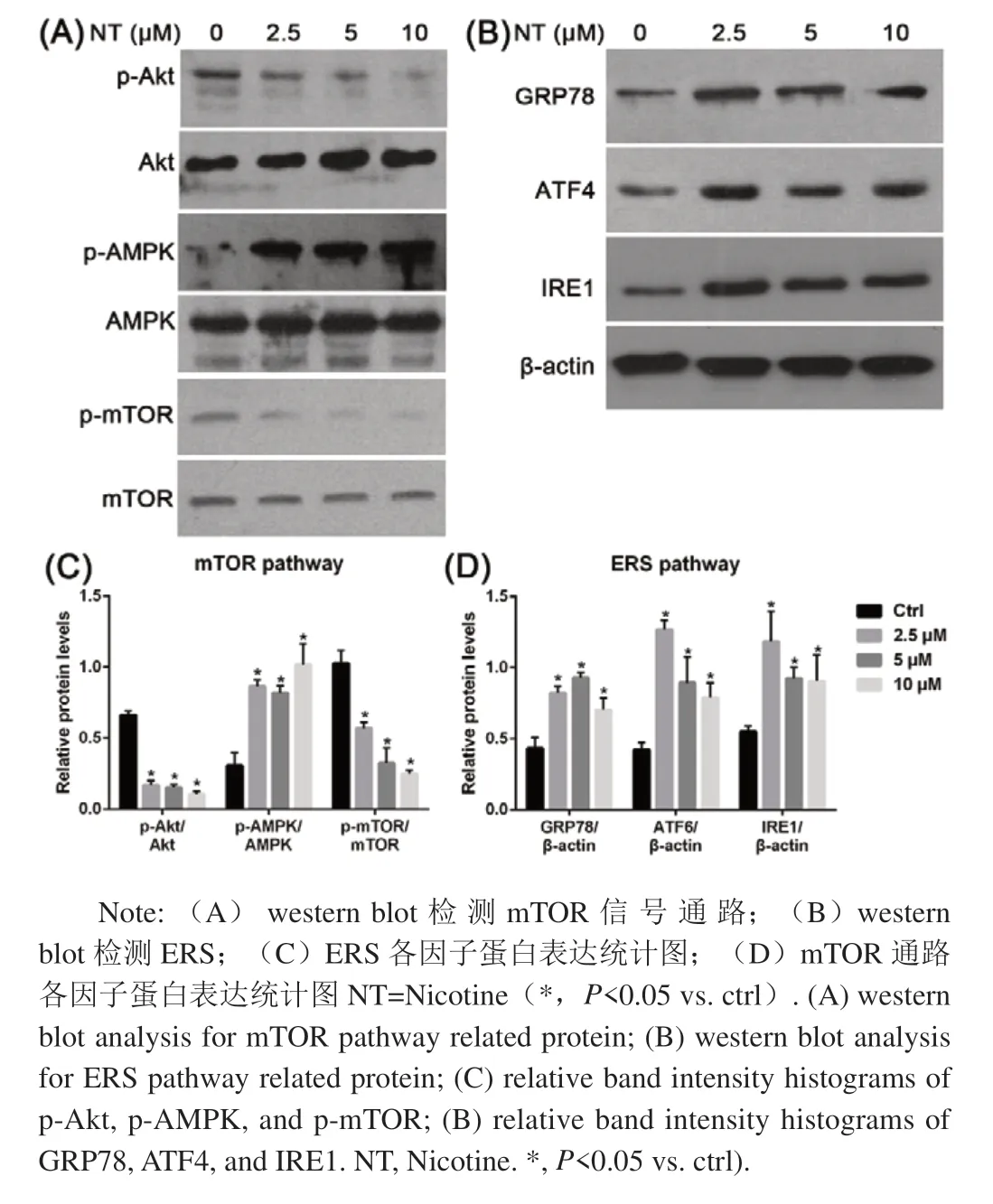
图6 尼古丁诱导自噬的分子机制:激活 ERS和抑制mTOR信号通路Fig.6 Molecular mechanisms of nicotine-induced autophagy:activation of ERS and inhibition of mTOR signaling pathways
3 讨论
炎症性肠病(IBD)是由易感基因,环境和免疫系统之间一系列复杂的相互作用所导致的[9]。功能失调的自噬被认为是许多慢性炎性疾病的发病因素,包括炎症性肠病(IBD)。自噬在IBD发病机制中起多重作用。实验研究发现采用2.5 μM的尼古丁处理细胞,能够成功诱导细胞发生自噬。Marjolaine等[10]的研究中,他们采用100 nM的尼古丁诱导2 h同样成功诱导自噬,但并未诱导细胞发生较高水平凋亡,这暗示低浓度的尼古丁对细胞的保护作用很可能是通过自噬来调控。在本研究中,低浓度剂量(2.5 μM)的尼古丁对于细胞的增殖无明显的抑制作用;而当剂量达到或超过5 μM时,会产生细胞毒性。因此,实验采用低剂量(2.5 μM)尼古丁刺激细胞,成功诱导细胞自噬反应。在2.5 μM尼古丁的作用下,hIECs的细胞自噬标志物Beclin1和LC3B-II蛋白表达显著升高,p62明显受到抑制。Beclin1存在于反面高尔基网上面,它是酵母Atg6基因在哺乳动物中的同源类似物,与自噬前体结合后启动自噬体的形成,因此为开启自噬所必须[11]。LC3B存在两种形式,LC3B-I和他的水解衍生物LC3B-II。其分别位于细胞质和自噬体的胞膜。当细胞发生自噬时,LC3B-I就会被水解为LC3B-II。因此,LC3B-II常被用作自噬评估的公认指标。p62与LC3偶联在一起,可以当作调节因子的一种,作用于自噬体的形成,但是它在自噬过程的中、晚期的时候被降解,也常作为追踪自噬的指标[12]。因此,通过了解上述自噬标志物的表达水平,可对细胞的自吞噬活性进行动态监测和判断。此外,本研究还通过TEM从组织学水平证实细胞质内自噬体的形态及数量变化同样受尼古丁作用的影响。这些结果均为本研究中低浓度尼古丁诱导自噬提供了证据。
目前,临床上广泛使用的IBD治疗剂与自噬均密切相关,包括类固醇、5-氨基水杨酸、硫锉嘌呤等[7],均能诱导细胞自噬的发生。而本研究在人肠道上皮细胞中同样证实尼古丁同自噬密切相关。这同目前UC临床上对尼古丁的使用相一致。研究普遍认为吸烟可以提供对UC患者的保护[13]。一项荟萃分析证实,与非吸烟的人群相比,吸烟人群患UC的风险显着降低[OR 0.58(0.45-0.75)][14]。此外,吸烟的UC患者的住院率、复发率和结肠切除手术率较非吸烟的UC患者均显著降低[15]。虽然吸烟的影响与尼古丁的影响不尽相同,但有临床证据表明,尼古丁和/或其代谢产物(如可替宁)是活动性UC患者从吸烟中获益的主要原因。尼古丁在人体内的半衰期约为2小时,而可替宁是尼古丁代谢的副产物,可在血液中存留48小时。尼古丁起效快,代谢产物存留时间长,且血浆蛋白结合率小于5%,合并用药对于药代动力学影响甚微[16]。因此,充分了解尼古丁在UC中的机制将为IBD的治疗和预防带来新的策略。
本实验研究进一步检测尼古丁诱导自噬的分子机制。肠道上皮细胞极易受到ERS影响,其结果是自噬的激活以及自噬通量的增加[17,18]。已有的研究证实尼古丁与ERS密切相关。Wong等[19]发现尼古丁能直接诱导ERS,上调ERS标志物PERK、eif2a等表达或磷酸化修饰。本研究也显示尼古丁上调GRP78/BIP的表达水平,启动ERS,这可能是尼古丁诱导自噬的一个机制。mTOR激酶是诱导自噬的重要调节分子,mTOR信号通路能够同体内微环境协同调节细胞生长和存活[20]。多项研究表明,mTOR介导的自噬在IBD过程中扮演重要角色[20-22]。一方面,上游Akt和 MAPK信号通路能够激活 mTOR抑制自噬;另一方面,AMPK和 p53信号通路能够负性调节mTOR促进自噬[23]。对AMPK、Akt介导的mTOR信号通路进行的检测结果显示尼古丁能够增加AMPK的磷酸化水平,降低Akt的磷酸化水平,最终导致mTOR受到抑制,进而诱导自噬。此外,Akt/mTOR也是细胞凋亡的重要通路[24]。这可能与高浓度尼古丁促进细胞凋亡,抑制细胞增殖相关。因此,尼古丁在UC的治疗作用很可能取决于使用浓度。
综上所述,自噬在UC的治疗中起着重要作用,自噬调节类药物作为IBD的潜在治疗靶点会受到越来越多的关注。低浓度尼古丁能够诱导自噬,与ERS和mTOR信号通路密切相关,进一步对该分子机制进行研究,有助于开发调节自噬治疗UC的新治疗靶点。
