三明野生黄精无菌体系的建立
2019-07-09吕煜梦徐小萍张舒婷郭志鹏王锦锋林玉玲王天池赖钟雄
吕煜梦 徐小萍 张舒婷 郭志鹏 王锦锋 林玉玲 王天池 赖钟雄


摘 要 通过优化消毒和不定芽诱导条件等,建立了三明野生黄精根状茎的组培体系。结果表明:将野生黄精外植体依次在清水下用软毛刷刷洗去野生黄精根状茎表面的泥土,在加洗衣粉的自来水中冲洗16 h,在3%多菌灵浸泡2 d(期间时常振荡摇晃),用清水洗去表面残留的多菌灵后置于滤纸上晾放5 h,再用75%酒精处理30 s,加0.2%氯化汞浸泡15 min消毒处理之后,野生黄精外植体的污染率低至20.2%。春季3—4月的野生黄精外植体的不定芽萌发能力和长势均明显优于11—12月。三明野生黄精的最佳不定芽诱导培养基为:MS+6-BA 4.0 mg/L +NAA 0.2 mg/L,在其上培养时诱导出芽率高达88.0%。
关键词 野生多花黄精;无菌体系;组织培养;不定芽诱导
中图分类号 S961.6 文献标识码 A
Abstract An aseptic tissue culture procedure was established for wild Polygonatum cyrtonema Hua in Samming by optimizing the disinfection and the adventitious bud induction procedures, in which the tubers from wild-growing plants were used as the explants. The best sterilization procedure for the explants was as follows: brushed soils off the tubers in clear water with a soft toothbrush; cleaned within diluted detergent for 16 hours; soaked in 3% carbendazim for 2 days (shaked intermittently) and washed in water to remove the residual carbendazim from the surface; dried on filter paper for 5 h; dipped first in 75% alcohol for 30 s and then in 0.2% mercuric chloride for 15 min, which resulted in a contamination rate of only 20.2%. Comparatively, the explants from March to April were significantly better than those from November to December in both the growth and the induction of adventitious buds. The optimal medium for the adventitious bud induction of the wild P. cyrtonema Hua explants was: MS+6-BA 4.0 mg/L +NAA 0.2 mg/L, and the budding rate on the medium was as high as 88.0%.
Keywords wild Polygonatum cyrtonema Hua; sterile system; tissue culture; adventitious bud induction
DOI 10.3969/j.issn.1000-2561.2019.08.015
三明野生黃精(Polygonatum cyrtonema Hua)为百合科(Liliaceae)黄精属(Polygonatum Mill.)多年生药用草本植物,集药用、食用、美容和观赏价值于一身,具有广阔的开发利用前景[1]。黄精根状茎主要含多糖[2]、黄酮、蒽醌、甾体皂苷[3]、木脂素等化合物及多种对人体有用的氨基酸等多种物质,性平、味甘,为滋补上品,具有滋阴润燥、降血脂、降血糖、降血压、提高人体免疫力、补中益气、平补气血的作用和功效[4-8]。但由于黄精生长周期长,种子繁殖需要5 a以上,根状茎繁殖也至少需要3 a,传统的无性繁育技术不仅使黄精优良性状难以保存,而且繁殖效率较低,极大地限制了黄精的规模化扩繁。近年来随着人们对黄精的需求量与日俱增,野生资源已远远不能满足生产的需要,工厂化生产势在必行[9]。植物组织培养技术不仅可以很好地保存黄精的优良性状,而且还可以消除季节等外在因素的影响,从而在可控的环境下显著提高增殖系数。因此,建立高效的无菌培养体系是目前黄精快速繁殖的重要途径。
目前,关于黄精的组培快繁的研究已有不少报道[10-13],刘红美等[14]对黄精无菌体系的建立到种苗进行了系统研究;徐忠传等[15]就杀菌剂对黄精根状茎的影响进行了研究,徐忠传等[16]、徐红梅等[17]先后研究了黄精的离体快繁体系,并建立了从外植体选择、愈伤组织诱导、不定芽的诱导、生根壮苗培养到炼苗移栽的较为完整的黄精离体再生体系。目前,对于三明野生黄精的离体组织培养还未有详细的研究,所以本文从外植体预处理、外植体消毒、启动培养及不定芽的诱导等方面对三明野生黄精的离体培养体系的建立进行了初步研究,以期为我国野生黄精离体培养及工厂化生产提供参考与借鉴。
1 材料与方法
1.1 材料
取三明地区野生黄精根状茎为外植体,选表面浅黄色至黄褐色、生活力较强的地下根状茎为外植体。消毒试剂为多菌灵溶液、次氯酸钠和氯化汞。
1.2 方法
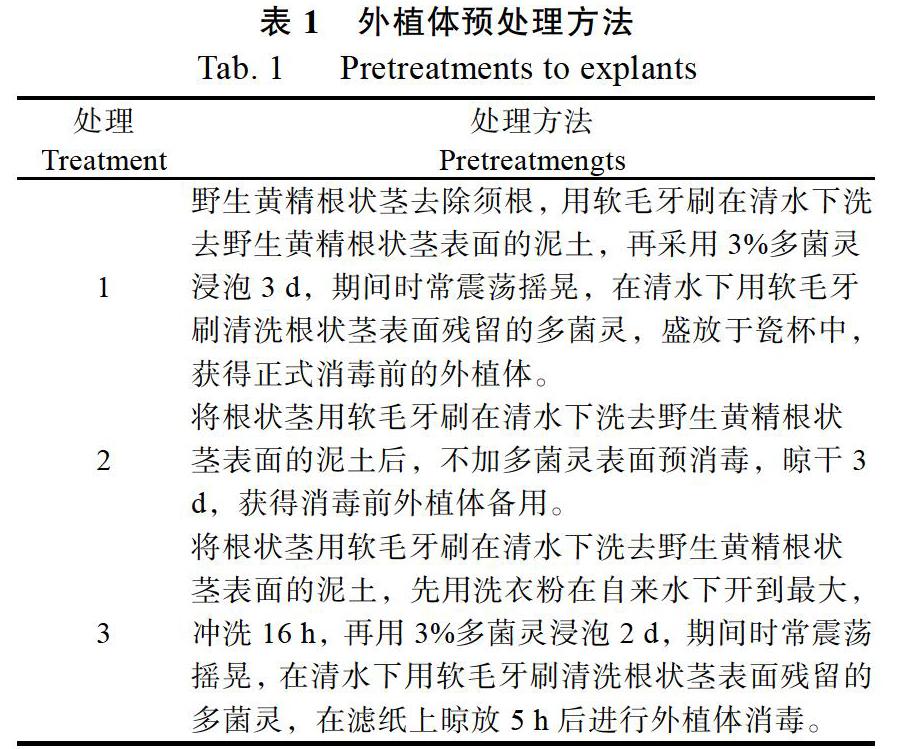
1.2.1 外植体预处理 取放晴3 d以上春季3—4月的三明野生黄精,野生黄精根状茎去除须根,选色泽鲜黄,生活力较强的地下根状茎为外植体。采用表1中的3种方法进行外植体预处理。
1 野生黄精根状茎去除须根,用软毛牙刷在清水下洗去野生黄精根状茎表面的泥土,再采用3%多菌灵浸泡3 d,期间时常震荡摇晃,在清水下用软毛牙刷清洗根状茎表面残留的多菌灵,盛放于瓷杯中,获得正式消毒前的外植体。
2 将根状茎用软毛牙刷在清水下洗去野生黄精根状茎表面的泥土后,不加多菌灵表面预消毒,晾干3 d,获得消毒前外植体备用。
3 将根状茎用软毛牙刷在清水下洗去野生黄精根状茎表面的泥土,先用洗衣粉在自来水下开到最大,冲洗16 h,再用3%多菌灵浸泡2 d,期间时常震荡摇晃,在清水下用软毛牙刷清洗根状茎表面残留的多菌灵,在滤纸上晾放5 h后进行外植体消毒。
1.2.2 外植体消毒 选择1.2.1中最佳外植体预处理方法处理野生黄精根状茎后,分别使用以下2种方法对外植体进行消毒:(1)先用酒精(75%)消毒30 s,再使用氯化汞(0.2%)浸泡消毒(10、15、20 min),消毒后的野生黄精根状茎用无菌水冲洗3~4次;(2)先用酒精(75%)消毒30 s、再使用次氯酸钠(2%)浸泡消毒(20、30、40 min),消毒后再用无菌水冲洗3~4次。每个处理3组,每组20瓶,每瓶接1个外植体,接种后15 d统计外植体污染率、褐化率和出芽率。
将预消毒处理后获得的野生黄精外植体分装于瓷杯中,置于经紫外消毒的超净工作台上,先用无菌水清洗3次,根据根状茎节间大小切成小块;再使用75%酒精浸泡30 s;然后使用0.2% HgCl2浸泡15 min,同时滴一滴吐温20;最后使用无菌水清洗4~5遍至干净;将消毒好的根状茎置于滤纸上,晾干;接种于MS培养基(MS+6-BA 4 mg/L +NAA 0.2 mg/L+30 g/L蔗糖+7 g/L琼脂,pH 5.8),每个处理3组,每组20瓶。
1.2.3 培养条件 外植体消毒后接种于经高压(121 ℃/20 min)灭菌的MS培养基中,培养温度为(25±2)℃,12 h/d光照培养,光照强度为22~ 25 μmol/(m2s),培养15 d后统计污染率、褐化率及成活率。
1.2.4 取材时间对野生黄精不定芽诱导的影响 分别在3—4月和11—12月对三明野生黄精进行取材,接种于表2中的2号培养基中,比较不同季节取材对外植体不定芽诱导的影响,每瓶接入一个外植体,每个处理3组,每组20瓶,15 d后统计污染率和出芽率。
1.2.5 三明野生黄精不定芽诱导 三明野生黄精不定芽诱导培养基为:采用1.2.1和1.2.2中对比实验后的最佳处理组合筛选出来的无污染健康的外植体接入到MS+NAA 0.2 mg/L+30 g/L蔗糖+7 g/L琼脂的固体培养基(pH为5.8),同时添加不同浓度(2.0、4.0、6.0、10.0 mg/L)的6-BA(6-苄氨基嘌呤)(表2),接种15 d后观察根状茎的存活情况与出芽情况。每瓶接种1块根状茎,每个处理3组,每组20瓶。
1.3 数据统计
采用Excel 2003软件进行数据统计、图表制作及相关分析。
2 结果与分析
2.1 外植体预处理对无菌体系建立的影响
由表3可知,外植体污染率的大小为2>1>3,污染率分别为89.1%、53.8%、34.6%。由實验结果可知,未经多菌灵溶液浸泡的外植体(处理2)的污染率高达89.1%,说明多菌灵溶液对于野生黄精外植体的消毒效果有明显影响,加入多菌灵溶液浸泡后的外植体污染率远远低于未加多菌灵浸泡的。此外,外植体的污染率与洗衣粉水冲洗植株的时间也有关联,未经过洗衣粉水冲洗而直接浸泡在多菌灵中的外植体的污染率比经过洗衣粉水的冲洗后再浸泡于多菌灵溶液中高出19.2%,这可能是因为野生黄精根状茎生长于泥土中,表面带有大量微生物,将其置于洗衣粉水下冲洗一定的时长,洗衣粉水也具有一定的杀菌能力,再采用一定浓度的酒精和氯化汞消毒外植体,便可以有效的降低污染率。
2.2 乙醇与次氯酸钠不同时间配合处理对外植体的影响
为研究次氯酸钠对野生黄精外植体消毒效果的影响,本实验使用2%的次氯酸钠对外植体进行消毒。实验结果表明,2%次氯酸钠处理不同时间后,野生黄精外植体均大量污染,污染率高达89.7%,褐化率高达47.1%(表4)。且大部分为细菌污染,有部分块茎甚至腐烂。因此,采用2%次氯酸钠消毒的方法显然不适合于野生黄精外植体的消毒灭菌,不利于野生黄精无菌体系的建立。
2.3 乙醇与氯化汞不同时间配合处理对外植体的影响
由表5可知,乙醇与氯化汞结合进行消毒对外植体污染有一定的控制作用,野生黄精的根状茎的污染率随着消毒液浸泡时间的增加而降低,且消毒灭菌时间为15 min时污染率与褐死率之和最低,成活率最高。但使用氯化汞消毒液浸泡时间为20、25 min时,其污染率继续下降,但褐化率均明显升高,推测长时间的氯化汞消毒处理在杀死微生物的同时对外植体也产生了毒害作用。因此,采用处理1的75%乙醇30 s+0.2%氯化汞处
2.4 不同取材时间对不定芽诱导的影响
对不同季节的三明野生黄精根状茎进行取材,接入表2中的2号培养基中,15 d后统计污染率和出芽率。由表6可以看出在3—4月份春季取材的外植体接种后污染率较低,且出芽率高达65.8%,而在冬季11—12月取得的外植体出芽率约等于0%,推测不同时间采集的外植体因其生理状态和内源激素含量存在差异, 导致其萌发效率存在差异。根据周新华等[18]的研究结果,3—4月取材的外植体其腋芽的萌发能力和长势均明显优于其他时间段。
2.5 不同培养基对不定芽诱导的影响
将灭菌消毒好的外植体,分别接种于表2的四种培养基内,培养15 d。由表7可知,不同6-BA浓度对野生黄精外植体不定芽的诱导影响显著,其污染率为1>4>3>2,存活率为2>3>1>4,出芽率为2>1>3>4,即2号培养基的污染率最低,且存活率和出芽率最高,说明6-BA浓度为4.0 mg/L(2号培养基)是诱导野生黄精不定芽的最佳浓度,此时野生黄精出芽率和存活率最高(图1)。随着6-BA浓度升高,其出芽率反而下降,推测6-BA浓度过高可能会抑制不定芽的生长。
3 讨论
3.1 外植体预处理及消毒方法的筛选有利于三明野生黄精无菌体系建立
野生黄精根状茎长期生长于泥土当中,根茎表面通常附着很多微生物,因此对于野生黄精根状茎的彻底消毒是野生黄精无菌体系建立至关重要的一步。目前还未有文献探讨过关于野生黄精根状茎作为外植体预处理的消毒方法对外植体消毒情况的影响,所以本研究采用3种不同方法对三明野生黄精根状茎进行外植体的预处理消毒,发现野生黄精根状茎离开土壤后,用软毛牙刷在清水下洗去野生黄精根状茎表面的泥土,在加洗衣粉的自来水中冲洗16 h,再用3%多菌灵浸泡2 d,是外植体预处理的最佳方法,外植体污染率仅为34.6%。外植体在消毒剂(0.2%氯化汞或者2.0%次氯酸钠溶液)中浸泡时间的长短对野生黄精的根状茎的褐化率、污染率呈一定的规律性:三明野生黄精根状茎的的褐化率随着消毒剂浸泡时间的增加而増加,而污染率随着消毒剂浸泡时间的増加而降低。
徐忠传等[16]、鲍锦库[19]研究了多花黄精根状茎的灭菌方法,但未说明灭菌效果,刘红美等[14]采用了75%的酒精充分擦洗根茎表面,再使用2.5%次氯酸钠灭菌3次、每次5 min的多次短时灭菌法消毒效果较好,但并未说明消毒灭菌后的污染率等具体的情况。周新华等[10]采用了75%的酒精表面灭菌30 s,再用0.1%的氯化汞深层灭菌10 min,灭菌效果较好,外植体材料无菌保存率可达73.2%。戚华沙等[20]对蓝药睡莲的根状茎以不同浓度的次氯酸钠和氯化汞配合使用对其进行灭菌消毒,结果表明0.1% HgCl2 20 min+5.0% NaClO 5 min是蓝药睡莲根状茎较适宜的消毒方法。宁慧等[21]对与黄精同属百合科的玉竹的外植体进行了相似的外植体预处理及消毒(75%乙醇消毒15~20 s+0.2%氯化汞消毒9~11 min),发现乙醇和氯化汞配合使用对于地下根茎的消毒效果较好。本实验通过使用0.2%氯化汞对野生黄精外植体进行不同时间的消毒灭菌后,结果表明,选择75%酒精处理30 s,0.2%氯化汞溶液消毒15 min是野生黄精最合适的消毒方式。
本研究使用2%次氯酸钠对野生黄精外植体进行不同时间的消毒灭菌后,结果发现2%的次氯酸钠对野生黄精的外植体消毒效果不是很明显,与刘红美等[14]对多花黄精所消毒后的结果相差较大,推测可能是由于品种的差异或者取材时间不同引起的消毒效果的差异。此外,本研究采用相同浓度的氯化汞对野生黄精外植体进行处理,发现随着处理时间的延长,外植体的污染率不断下降,但褐化程度越来越严重,且氯化汞处理25 min污染率最低,褐化率却最高,推测氯化汞在灭杀微生物的同时对野生黄精外植体也产生一定的毒害,氯化汞处理的时间越长对外植体损伤越严重,无菌外植体就越脆弱。因此,本研究认为75%酒精处理30 s,0.2%氯化汞浸泡15 min处理外植体是比较适宜的,其外植体的存活率和出芽率均较高。用次氯酸钠消毒灭菌处理比氯化汞处理的污染率和褐化率明显高很多,说明利用氯化汞消毒灭菌的方法更适宜。而通过提高次氯酸钠的浓度对野生黄精外植体进行消毒灭菌,是否能提高其消毒效果,有待进一步研究。
3.2 一定浓度的6-BA能促进三明野生黄精不定芽的誘导
植物组织离体培养过程中,外植体不定芽的诱导不仅仅和植物生长调节剂的种类和浓度有关,还和植物品种、外植体生长环境、取材时间等因素的不同有关。在黄精组织离体培养过程中,细胞分裂素和生长素对不定芽的诱导起着至关重要作用,而6-BA具有高效、稳定、廉价和易于使用等特点,因此被广泛采用,是植物组织培养中最常见的细胞分裂素[22]。6-BA能诱导不定芽的产生,促进侧芽生长,促进细胞分裂,大多数材料都可以在细胞分裂素和生长素配合使用的情况下诱导形成不定芽。此外,研究表明不同植物生长调节剂组合诱导多花黄精的效果不同[23-25],本研究采用MS培养基,通过添加固定浓度的NAA浓度,同时单一改变6-BA浓度来研究诱导野生黄精不定芽的产生,发现当6-BA浓度为2.0~ 10.0 mg/L时均能诱导出不定芽。而前人还采用其他种类的激素来对黄精的不定芽进行诱导,如李莺等[26]从黄精的愈伤组织中也能诱导出不定芽,且在培养基MS +6-BA 3.0 mg/L+IAA 1.0 mg/L中诱导率最高;刘红美等[14]在MS培养基中添加0.2 mg/L 2,4-D+2.0 mg/L 6-BA诱导出不定芽,且与本研究6-BA的浓度相同;牟小翎等[27]对泰山野生黄精进行了不定芽的诱导,结果为MS+6-BA 4.0 mg/L,说明6-BA浓度为4.0 mg/L是较适宜黄精诱导出不定芽的,且单一使用细胞分裂素也可能诱导出不定芽,这可能与植物体本身含有的内源激素有关;李莺等[28]诱导鸡头黄精丛生芽激素组合是MS+6-BA 4.0 mg/L+IAA 0.5mg/L,增殖倍数达2.40;孙俊威等[29]在MS培养基中添加ZT 1.0 mg/L+NAA 0.2 mg/L诱多花黄精根状茎不定芽效果最好,诱导率为87.9%。此外,徐忠传等[16]都是使用了MS+6-BA 4.0 mg/L+NAA 0.2 mg/L诱导出黄精的不定芽,这与本研究的结果一致。
后续我们还将深入进行野生黄精不定芽增殖、生根壮苗最适培养基筛选等研究,以完善野生黄精不定芽再生途径组织离体培养体系。
参考文献
孙隆儒, 王素贤. 中药黄精中的新生物碱[J]. 中国药物化学杂志, 1997(2): 129-129.
李 丽, 田丽娜, 任振兴, 等. 黄精多糖的结构分析及功能活性研究进展[J]. 中国实验方剂学杂志, 2015(15): 231-234.
张 洁, 马百平, 杨 云, 等. 黄精属植物甾体皂苷类成分及药理活性研究进展[J]. 中国药学杂志, 2006, 41(5): 14-16.
陶弘景. 名医别录(辑校本)[M]. 北京: 人民卫生出版社, 1986.
李时珍. 本草纲目(上册)[M]. 长春: 时代文艺出版社, 2005.
国家药典委员会. 中华人民共和国药典(2005年版)[M]. 北京: 化学工业出版社, 2005.
中国科学院中国植物志委员会. 中国植物志:第十五卷[M]. 北京: 科学出版社, 1978.
庞玉新, 赵 致, 袁 媛, 等. 黄精的化学成分及药理作用[J]. 山地农业生物学报, 2003, 22(6): 547-550.
周 繇. 长白山区黄精属植物的种质资源及其开发利用[J]. 中国野生植物资源, 2002, 21(2): 34-35.
周新华, 曾满生, 肖智勇, 等. 多花黄精嫩茎与根茎芽离体培养技术[J]. 经济林研究, 2014, 32(4): 68-72.
万学锋, 陈菁瑛. 多花黄精组培快繁技术初探[J]. 中国现代中药, 2013, 15(10): 850-852.
李文金, 毕研文, 陈建生, 等. 泰山多花黄精试管苗生根技术研究[J]. 中国现代中药, 2010, 12(1): 19-20.
周新华, 肖智勇, 王丽云, 等. 基于均匀设计对黄精不定芽增殖培养的研究[J]. 安徽农业科学, 2014(31): 10909-10911.
刘红美, 方小波, 夏开德, 等. 多花黄精组织培养快繁技术的研究[J]. 种子, 2010, 29(12): 13-17.
徐忠传, 何俊蓉, 周静亚, 等. 多菌灵在黄精根茎无菌培养中的应用[J]. 生物技术通报, 2006(S1): 400-402.
徐忠传, 何俊蓉, 郁 达, 等. 多花黄精的组织培养与快速繁殖[J]. 植物生理学报, 2006, 42(1): 84.
徐红梅, 赵东利. 植物生长调节剂对多花黄精芽体外发生过程中性状的影响[J]. 中草药, 2003, 34(9): 855-858.
周新华, 厉月桥, 王丽云, 等. 多花黄精根茎芽高效组培增殖和生根体系研究[J]. 经济林研究, 2016, 34(1): 51-56.
鲍锦库. 囊丝黄精(Polygonatum cyrtonema Hua.)离体再生体系的建立和活性成分分析、黄精凝集素Ⅱ基团特异性化学修饰与生物学活性及其基因的克隆与表达研究[D]. 成都: 四川大学, 2003.
戚华沙, 潘 梅, 符瑞侃, 等. 蓝药睡莲组织培养外植体消毒方法的研究[J]. 中国园艺文摘, 2016, 32(2): 38-39.
宁 慧, 楊培君. 玉竹的组织培养与快速繁殖[J]. 西北植物学报, 2009, 29(11): 2339-2344.
朱伍凤. 药用植物黄精繁育技术研究[D]. 杨凌: 西北农林科技大学, 2013.
周建金, 罗晓锋, 叶 炜, 等. 多花黄精组培快繁技术研究[J]. 福建农业科技, 2012(9): 59-61.
周建金, 罗晓锋, 叶 炜, 等. 多花黄精组织培养技术[J]. 三明农业科技, 2012(3): 27-30.
周建金, 雷伏贵, 曹奕鸯, 等. 碳源和6-BA 对多花黄精不定芽生长及多糖累积的影响[J]. 福建农业学报, 2015(2): 125-130.
李 莺, 罗明志, 罗 雯, 等. 黄精的组织培养与植株再生[J]. 西北农业学报, 2011, 20(8): 159-162.
牟小翎, 张利民, 杨圣祥, 等. 泰山野生黄精的组培快繁技术研究[J]. 山东农业科学, 2010(1): 12-13.
李 莺, 王 虹, 王晓臣, 等. 鸡头黄精的组织培养与快速繁殖[J]. 陕西农业科学, 2011, 57(5): 104-108.
孙骏威, 赵 进, 周荣鑫. 不同植物生长调节剂对多花黄精组织培养的效果[J]. 贵州农业科学, 2017, 45(3): 97-100.
