肝移植治疗肝脏转移性胃肠道间质瘤(附二例报告)
2019-07-08王文静朱晓峰胡安斌陈庆
王文静,朱晓峰,胡安斌,陈庆
(1.华中科技大学同济医学院附属同济医院小儿外科,湖北 武汉 430030;2.中山大学附属第一医院器官移植科,广东 广州 510080;3.华中科技大学同济医学院附属协和医院肝胆外科,湖北 武汉 430022)
胃肠道间质瘤(gastrointestinal stromal tumors,GIST)是位于胃肠道和肠系膜上最常见的间充质肿瘤,治疗主要以手术切除为主,但术后复发转移率可高达80%[1-2]。肝脏是GIST最常见的转移部位,发生率约为15.9%,占远处器官(肝、肺、骨、腹膜等)转移的55%~72%[3-5],手术切除联合口服酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)是治疗GIST肝转移最有效的方法,可明显延长病人生存时间,提高生存质量[6-7]。对于TKI耐药无法切除的肝脏转移性GIST,一直以来缺乏有效的治疗措施[8-9],文献中关于肝移植是否能延长这类病人生存期的报道很少[10-13]。我们通过回顾性分析中山大学附属第一医院2例GIST术后肝转移病例行肝移植手术的临床资料,探讨肝移植对此类病人的疗效,并结合文献探讨其综合治疗策略。
资料与方法
例1:63岁的女性病人,因上腹部不适2月余于2015年12月入院。既往病史:13年前因十二指肠间质瘤行胰十二指肠切除术(pancreaticoduodenectomy,PD)。13年前术前CT检查发现十二指肠降部Vater壶腹附近一5 cm实体瘤,不均匀增强(图1A、B)。此次入院前CT扫描显示双侧肝叶有直径在1~15 cm之间的多发性不均匀肿块(图1C、D)。
例2:46岁女性病人,因上腹胀、纳差、消瘦3月余于2016年8月入院。既往病史:5年前因小肠间质瘤行小肠部分切除(资料遗失)。此次入院前CT扫描显示双侧肝叶有直径在2~13 cm之间的多发性不均匀肿块。
2例病人肿瘤标志物检测包括癌胚抗原、甲胎蛋白和癌抗原19-9等均阴性,胃镜及结肠镜检查未发现胃肠道肿瘤。心肺肝肾功能基本正常。肝脏活检显示不典型梭形细胞,免疫组化检测CD117和DOC-1阳性表达,结合既往原发性十二指肠及小肠间质瘤病史,诊断肝脏转移性GIST。考虑肝脏转移瘤无法切除,口服甲磺酸伊马替尼(IM,格列卫,诺华制药公司)治疗,每天600 mg。随访3个月,肿瘤体积逐渐增大。治疗调整为口服苹果酸舒尼替尼(SM,索坦,辉瑞制药公司)50 mg,每天一次,同时联合每月一次经导管动脉化疗栓塞术(TACE)治疗。后续随访6~8个月,2例病人均出现明显消化道症状及消瘦,复查腹部CT扫描显示肿瘤大小和数目明显增加(图2A、B),例1病人复查正电子发射断层扫描/计算机断层扫描(18F-FDG-PET/CT)显示除肝脏多发高代谢病灶及肝胃间隙有一5 cm周边强化的含气肿块外,未发现肿瘤复发或转移(图2C、D)。
2例均经过多学科讨论,考虑TKI疗效不佳,肝脏转移瘤无法切除,无肝外转移,病人经济条件允许和肝源充足的情况下,肝移植是唯一可能改善预后的措施。2例停用TKI后,经过2~3周的支持治疗,营养状况和一般情况得到改善,分别于2016年1月和2016年8月进行脑死亡供肝肝移植手术,术中探查未见胃肠道复发肿瘤,未见肝外转移病灶,病肝连同下腔静脉整块切除,采用经典原位肝移植术式置入供肝,术中均未采用体外静脉转流术,手术时间分别为495 min、372 min,无肝期分别为89 min、42 min,出血量分别为900 ml、750 ml,术中分别输注红细胞6 U及4 U。2例病人分别于术后6 d及7 d肝功能恢复正常,除机械通气时间相对较长(分别3 d和5 d)外,无严重并发症发生。病人均接受他克莫司(FK506)治疗,分别于移植术后16 d及13 d出院。术后病理检查提示两侧肝叶多发性肿瘤,主要由梭形细胞与明显核异形的细胞组成(图3A),核分裂数为13~62 个/50 HPF,可见明显出血坏死。免疫组化结果显示c-kit(CD117)和DOG-1呈弥漫性阳性表达,平滑肌肌动蛋白(SMA)呈弱阳性表达,CD34和S100呈阴性表达(图3B~D)。尽管缺乏前次手术的病理资料,结合既往原发十二指肠和小肠GIST的病史,病理诊断肝脏转移性GIST[14]。病例1进一步的基因检测显示N822K基因17外显子发生突变,移植术后1个月给予口服瑞格非尼(Stivarga,Bayer,德国),160 mg/d。病例2的基因检测显示c-kit基因9外显子突变,移植术后1个月给予口服苹果酸舒尼替尼,50 mg,每天一次。
结 果
至2018年8月2例病人分别随访31个月及24个月,2例病人一直口服他克莫司及TKI治疗,FK506浓度稳定,无严重的副作用。PET/CT未发现肿瘤转移(图4A、B)。

图1 病例1初诊及PD术后肝转移CT图像 A~B.2003年CT扫描显示十二指肠降部一5 cm的实体瘤,位于Vater壶腹附近,不均匀强化; C~D.2014年CT显示双侧肝叶多发不均质肿块,直径1~15 cm 图2 病例1肝转移综合治疗后CT及PET/CT图像 A~B.经TKI和TACE治疗后,2016年CT显示肿瘤大小和数目明显增加,直径2~18 cm,肝胃间隙内有一个大的含气肿块(5 cm),周围环形强化;C~D.PET/CT显示肝脏多发高代谢病灶,无肝外转移 图3 病例1肝移植术后病理结果 A.苏木精-伊红(HE)染色(×200)显示两侧肝叶多灶性肿瘤,主要由梭形细胞和明显核异形的细胞组成,核分裂数为 13~62 个/50HPF;B~D.免疫组织化学染色(×200)显示c-kit(CD 117)(B)和DOG-1(C)呈弥漫阳性表达,CD34呈阴性表达(D)
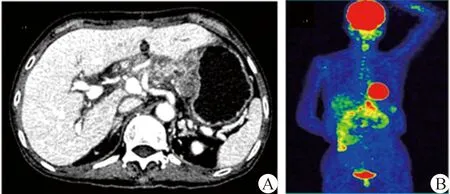
图4 病例1肝移植术后2年复查PET/CT图像(A、B)无肿瘤转移
讨 论
GIST是最常见的胃肠道间叶源性肿瘤,40~65岁多发,在胃肠道肿瘤中占0.1%~3%,其起源于前体细胞或Cajal间质细胞(ICC),由突变的c-kit或血小板源性生长因子受体α(platelet-derived growth factor receptor-alpha,PDGFRA)基因驱动,胃肠道的任何地方均可发病,最常见来源于胃(50%~60%),其次是小肠(20%~30%),十二指肠仅占4%~5%,占十二指肠肿瘤的5%以下[15-16]。
随着对 GIST 生物特性的进一步认识,根据其恶性潜能分为3级:低度、中度、高度危险组,目前普遍观点认为GIST无绝对良恶性之分,高危GIST的术后复发率非常高,分化好的低度危险组GIST,术后即使经过一个较长时间的缓解期也有远期转移的风险[3-4]。由于 GIST 发病是因为前体细胞出现了c-kit或PDGFRA突变,从而导致酪氨酸激酶持续活化和细胞增殖分化失控,酪氨酸激酶抑制剂伊马替尼的问世,彻底改变了GIST的外科治疗及综合治疗理念。对于复发和(或)转移性GIST,伊马替尼被推荐为一线治疗药物,2年无进展生存率为77%,但肿瘤缩小率只有4.5%,而且随着伊马替尼治疗时间的延长,耐药比例也不断提高,达到完全缓解的病人不超过5%,有报道伊马替尼耐药的总发生率约为56%,且一般继发耐药出现在伊马替尼治疗后2年左右[8],并通常出现在KIT外显子11突变的病人。由于靶向治疗最终都可能会发生耐药,单纯药物治疗不能使进展期及晚期GIST病人长期获益。因此,靶向治疗控制期间,及时采取外科治疗将有助于改善病人的生存期及预后。
目前已有多项研究显示对于可切除的转移性GIST病人,与单纯采用手术治疗或靶向治疗相比,靶向治疗联合手术切除能够明显提高病人的总生存率,延长无病生存期[3,8]。Chen等[17]报道了完全切除GIST肝转移病人的生存时间明显延长,中位存活期为53个月。DeMatteo等[18]报道了56例肉瘤肝转移病人,其中61%为GIST,半数病例进行完全切除后5年生存率为30%,而未切除者仅为4%。目前国内外诊治指南均推荐GIST需联合脏器切除的病人先接受靶向治疗,以降低手术风险,改善预后[5]。对于不能切除的转移性GIST病人,伊马替尼也是一线治疗药物[9],肿瘤降期后仍可以进行手术。
目前治疗的难点在对TKI耐药、不可切除的肝脏转移性GIST的病例,考虑到这类病人放化疗、消融和TACE等姑息性治疗效果不佳,肝移植或许是唯一一种可能改善预后的治疗措施[19]。文献中关于肝移植治疗肝转移性GIST的报道较少。Husted等[10]报告了一项对13例转移性肉瘤病人的研究,其中有8例为高危险性肝脏转移性GIST,他们发现移植后肿瘤复发早、中位生存期短(仅10.8个月)。Cameron等[12]报告了2例转移性GIST行肝移植的病人,其术后无病生存率分别为48个月和69个月。由Bompas等[20]报道的病例在肝移植术后获得了24个月的无病生存。而由Frilling等[21]的报道更令人鼓舞,其转移性肝胃肠道外间质瘤(原发性肿瘤切除术后17年)病人在活体肝移植术后随访中,虽然有2 cm稳定的直肠周围转移瘤,一直无症状的带瘤存活10年。
本研究中报告的第一例病人GIST肝转移起源于十二指肠,其独特之处不仅在于临床罕见,缓解间隔长达13年,而且还因为既往的PD和肠瘘引起的腹腔脓肿造成移植手术的困难。我们经过多学科小组的讨论决定对这位病人进行肝移植手术是基于详尽的术前评估和严格的选择标准:①影像学评估肝脏转移瘤不可切除;②靶向治疗和其他姑息性治疗无反应或者不能耐受;③无原发肿瘤复发及肝外转移肿瘤的表现;④原发肿瘤切除到肝转移的缓解间隔时间较长(超过2年);⑤支持治疗后整体健康状况良好,能耐受肝移植手术;⑥对免疫抑制剂和分子靶向药物长期治疗的依从性好。严格选择肝移植病例是保证术后生存的关键。在上述所有标准中,许多选择标准也是由Frilling等[21]推荐的。多因素分析研究发现[18,20]从原发肿瘤到肝转移发生超过2年的时间间隔已被确定为包括GIST在内的肝脏转移性肉瘤完全切除后存活的唯一预测指标,因此,Frilling等[21]强调对肝转移瘤的治疗时间应大于2年,这对等待肝移植病人也适用。考虑到供体器官的短缺,在我们的两个案例中,均采用的是边缘供肝进行肝移植手术。
在第一例肝移植手术中,由于先前的PD及腹腔脓肿造成肝十二指肠韧带有严重的血管性粘连和瘢痕形成,常规方式的肝门游离非常困难,我们采用了肝门整体离断技术。此技术由Starzl等人于1976年首次报道,后被Pararas等[22]建议将其作为一种困难的肝移植手术中解剖第一肝门的简单有效技术,在他们的临床研究中所有困难的病例均采用这种技术成功完成肝移植手术,无一例死亡或移植物丢失。在我们的研究中,肝十二指肠韧带有严重的致密粘连,经典的分离肝门三管技术极为困难,强行解剖可造成难以控制的大出血和不可挽回的副损伤,我们先游离除了第一肝门外的肝周韧带后,再整体游离、阻断、横断第一肝门后,不仅可以在无血视野下解剖游离肝门“三管”结构,还可以确切处理曲张血管的出血,大大简化了操作。本例虽然无肝期较长(89 min),但术后未出现严重的凝血病、内脏淤血或肝动脉损伤。对于第一肝门有重度血管性粘连、瘢痕或肝门部静脉曲张(门静脉海绵样变)的病例,肝门整体离断是一种安全、简单、有效的解剖肝门技术。
原发性和转移性GIST术后的高复发率意味着GIST是一种全身性疾病,围手术期辅助治疗非常重要。对于肝移植术后开始辅助TKI治疗的时机和持续时间目前难以确定。一般来说,TKI治疗可在病人从手术中恢复后立即开始,并应继续治疗2年,特别是高危病例[23-24]。基因突变的检测可使其治疗更为个体化,突变多发生在KIT外显子11(70%)、KIT外显子9(10%)和PDGFRA外显子18(5%)上[25-26]。甲磺酸伊马替尼对 c-kit基因第 11外显子突变者疗效显著,对c-kit 基因第9外显子突变以及c-kit/PDGFRA 野生型者疗效不佳,PDGFRA的842V突变可能对甲磺酸伊马替尼原发耐药[27]。有研究显示,有c-kit基因第11外显子缺失的中度复发风险病人,其无复发存活率与高度复发风险组相似[28]。因此针对c-kit11外显子突变病人应首选伊马替尼400 mg/d治疗作为术前、术后辅助治疗或是不能手术切除病人的补救治疗药物,对于外显子9突变的病人,推荐优先增量为600 mg/d或二线舒尼替尼治疗。瑞格非尼是一种多酪氨酸激酶抑制剂,在一项Ⅲ期试验中已被证明对甲磺酸伊马替尼耐药病人和试剂盒N822K基因突变具有活性[29]。我们的研究中病例1病人的基因检测显示N822K基因17外显子突变,移植术后1个月给予口服瑞格非尼;病例2的基因检测显示c-kit基因9外显子突变,移植术后口服苹果酸舒尼替尼。2例均耐受良好,未出现明显毒副反应。值得注意的是,这些药物与免疫抑制剂均主要通过肝脏细胞色素P450代谢,移植术后同时使用这两类药物,其相互作用可使药物浓度呈反比增加或降低。因此,术后对肝功能的监测和免疫抑制剂浓度的监测非常重要。遗憾的是,因不具备检测TKI药物浓度和进行药代动力学分析的条件,不能详细研究这两种药物的相互作用。
本研究中的2例病人肝移植手术后分别随访31个月和24个月,至今均无瘤存活。我们的初步经验表明肝移植对于不可切除的转移性肝脏GIST的病例是安全可靠的,可延长生存时间,改善生活质量,但本研究的病例较少,随访时间不长,目前还需多中心大样本的研究来进一步评估肝移植对这类病人治疗的价值。
