海洋沉积物中邻苯二甲酸酯类环境激素的测定及其生态风险评估
2019-07-08胡红美李铁军张露郝青孙秀梅金衍健应忠真郭远明
胡红美,李铁军,张露,郝青,孙秀梅,金衍健,应忠真,郭远明
(浙江省海洋水产研究所,浙江省海洋渔业资源可持续利用技术研究重点实验室,浙江 舟山 316021)
邻苯二甲酸酯(phthalic acid esters,PAEs)作为一类重要的环境激素,广泛分布在大气、水体、土壤、底泥、食品、动植物体及人体等各种介质中,具有类雌激素效应,可干扰人体和动物体的内分泌系统,导致生殖、发育和行为异常[1-2]。PAEs主要作为增塑剂应用于食品包装材料、纺织品、儿童玩具等产品中,也可作为农药、化妆品、润滑剂等化工产品的生产原料,已被世界多个国家列入“优先污染物名单”。
PAEs在环境中性质稳定,可持久存在。据报道,我国自然水体中邻苯二甲酸二丁酯(di-n-butyl phthalate,DBP)、邻苯二甲酸二-2-乙基己酯[di(2-ethylhexyl)phthalate,DEHP]含量整体高于国外,很多河流和湖泊中PAEs含量均高于我国《地表水环境质量标准》(GB 3838—2002)(DBP≤3 μg/L、DEHP≤8 μg/L)[3]。由于具有较强的疏水性,水体中的PAEs通常易于分布到沉积相中。邻苯二甲酸二甲酯(dimethyl phthalate,DMP)、邻苯二甲酸二乙酯(diethyl phthalate,DEP)、邻苯二甲酸丁苄酯(butyl benzyl phthalate,BBP)、DBP、DEHP为我国河流及湖泊沉积物中主要的PAEs污染物[4-5],其中,DEHP含量通常最大,在我国使用最广泛,其吸附力强且难以被降解[6-7],因此DEHP含量通常用来作为沉积物中PAEs污染的标志物[7]。总体上,我国沉积物中DEHP污染水平与国外相当。海洋沉积物是PAEs在环境中迁移和转化的重要载体、归宿地和集聚区,因此,研究海洋沉积物中PAEs的污染状况及其生态风险显得尤为重要。
现今,对海洋沉积物中PAEs最常用的检测技术主要有气相色谱-氢火焰离子化检测法、气相色谱-质谱法、气相色谱串联质谱法、高效液相色谱法等,而样品前处理通常采用索氏提取(Soxhlet’s extraction,SE)[8-10]、振荡萃取[11-12]、微波辅助提取(microwave-assisted extraction,MAE)[13]、QuEChERS(quick,easy,cheap,effective,rugged,safe)[14]、加速溶剂萃取(accelerated solvent extraction,ASE)[15-16]、超声波萃取(ultrasonic extraction,USE)[17-21]、基质固相分散萃取[22]等技术,结合层析柱净化[8,10-11,17,20]、固相萃取(solid phase extraction,SPE)[9,11,15,18-19,21-23]、浓硫酸净化[17]、分散式固相萃取(dispersive solid phase extraction,DSPE)[13]、分散液液微萃取(dispersive liquid-liquid microextraction,DLLME)[24]等1种或2种净化方法。但在这些方法中,采用层析柱或固相萃取小柱法,虽净化效果较好,但操作复杂,需进行萃取柱活化、上样、淋洗、洗脱等过程,耗时较长,不适合批量样品处理;采用浓硫酸净化法回收率较低;分散液液微萃取法主要适用于简单液体基质样品,对于复杂固体基质需要将其转化为液体基质,且易产生基质效应。
近年来,DSPE法在罐头、鸡肉、海产品等食品检测过程中的样品前处理净化方面具有显著的优势[23,25-27]。而对于基质较为复杂的海洋沉积物,要想PAEs萃取完全,且排除杂质干扰,选择合适的萃取及净化技术是关键。基于本课题组前期将DSPE法应用于海产品净化方面的工作[23],本研究进一步建立了一种适合海洋沉积物中PAEs检测的分散固相萃取净化方法,并将建立的方法应用于台州三门湾海域、温州南麂岛海域沉积物样品检测,同时对其生态风险进行评估,以期为PAEs海洋地球化学研究、环境污染控制和风险管理提供技术手段和科学依据。
1 材料与方法
1.1 仪器与试剂
7890B/5977A气相色谱质谱仪(安捷伦科技公司,美国),冷冻干燥机(Labconco公司,美国),KQ-500B超声波萃取仪、MS3D型涡旋振荡器(IKA集团,德国),5810高速离心机(Eppendorf公司,德国),R-215旋转蒸发仪(Büchi公司,瑞士)。
所有固相吸附剂均购自上海安谱科学仪器有限公司,分别为石墨化炭黑吸附剂[graphitized carbon black(GCB),粒径120~400目],N-丙基乙二胺吸附剂[primary secondary amine(PSA),粒径40~63 μm],弗罗里硅土吸附剂(florisil,粒径60~100目),硅胶吸附剂(Si,粒径40~46 μm),C18吸附剂(粒径40~63 μm)。
16种PAEs标准品(表1)均购自德国Dr.Ehrenstorfer公司。以正己烷为溶剂配置成1 000 mg/L的混合标准储备液,再通过正己烷逐级稀释,配制成1 000 μg/L混合标准溶液,4℃保存。乙酸乙酯、甲醇、二氯甲烷、正己烷、丙酮等有机溶剂均为色谱纯。

表1 16种PAEs的保留时间、定量离子和定性离子Table 1 Retention time,quantitative ions and qualitative ions of 16 PAEs
1.2 色谱和质谱工作条件
1)色谱条件。HP-35MS毛细管气相色谱柱(30 m×0.25 mm,0.25 μm);进样口温度260 ℃,不分流进样,进样量1 μL;色谱柱初始温度100℃,按10℃/min升温至290℃(保持5.0 min);载气为高纯氦气,流量1.0 mL/min;传输线温度260℃。
2)质谱条件。电子轰击型(EI)离子源,电离能量70 eV,离子源温度230℃;四级杆温度150℃;溶剂延迟3 min;SIM模式监测;特征离子见表1。混合标准溶液总离子流色谱图如图1所示。
各峰号对应的化合物见表1。Please see the Table 1 for the corresponding compound of each peak No.
1.3 样品采集和前处理
1.3.1 样品采集
分别用锚式采泥器采集台州三门湾海域、温州南麂岛海域的沉积物样品,样品贮存条件和预处理过程根据本实验室报道的方法[28]。用洁净的铝箔将采集的样品包装并密封于聚乙烯袋中,然后用便携式冷藏箱运回实验室。将待测样品置于冻干机中干燥24 h后,研磨,过100目不锈钢筛,置于干燥器内,待测。
1.3.2 样品前处理
称取2.00 g待测样品,置于50 mL玻璃离心管中,加入V(正己烷)∶V(乙酸乙酯)=1∶1溶液15 mL,涡旋1 min,超声提取15 min,根据需要加入铜粉1~3 g用于超声除硫,以3 000 r/min离心2 min,萃取液过无水硫酸钠柱,再向样品中加入V(正己烷)∶V(二氯甲烷)=1∶1溶液15 mL,重复上述步骤,合并萃取液,38℃旋转蒸发至干,加入2 mL正己烷溶解,转移至含200 mg GCB的具塞玻璃离心管中,涡旋60 s,以3 000 r/min离心1 min,取上清液至另一玻璃离心管中,再依次加入2 mL丙酮、2 mL二氯甲烷、2 mL甲醇,重复上述涡旋、离心步骤,并合并上清液,氮吹至干,用正己烷定容至1 mL,进行气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)分析。
1.4 生态风险评估
1.4.1 质量基准法评价
目前,针对沉积物中的PAEs,由于国际上尚无统一的环境质量标准,我国也尚未制定相关标准,因此,本文采用环境风险限值(environmental risk limits,ERLs)进行海洋沉积物中PAEs生态风险评估。VAN WEZEL等[29]通过体内外毒性实验,建议DBP、DEHP的ERLs分别为0.7和1.0 μg/g,若测定的环境浓度(CME)<ERLs时,则认为不存在PAEs内分泌干扰效应和生态毒性风险。对于其他种类PAEs,使用美国华盛顿州设立的警戒限值,各化合物均为 0.610 μg/g[30]。
1.4.2 商值法评价
商值法主要针对选定的生态受体进行化合物的风险商值(risk quotient,QR)计算,公式为:QR=CME/CPNE。式中:CME为测定的环境浓度,CPNE为预测无影响浓度。当QR<0.1,为低风险;0.1≤QR<1,为中等风险;QR≥1,为高风险[31]。沉积物中污染物的正辛醇/水分配系数lgKow影响风险判定:对于3<lgKow<5的物质,QR与1比较;而lgKow>5的物质,QR与10比较。这是由于lgKow>5的物质易被沉积物所吸附,对生物的危害性下降,其评价标准可适当放宽。而当物质的lgKow<3时,则不易被沉积物吸附,此时风险可忽略[32]。沉积物中PAEs的CPNE数据可通过美国国家环境保护局数据库中PAEs对相应敏感生物的毒性数据计算得到,结果见表2。
2 结果与讨论
2.1 萃取剂的选择
对不同萃取剂的萃取效果比较(图2)表明:用二氯甲烷重复萃取2次时,DMP、DMEP、DEEP的回收率较低(64%~68%);选用V(正己烷)∶V(二氯甲烷)=1∶1萃取时,DMP回收率略低(70%),DMEP、DEEP、DBEP则相对较高(92%~114%);选用V(正己烷)∶V(乙酸乙酯)=1∶1萃取时,DMP、DEP、DIBP、DBP、DCHP、DNOP的回收率均相对较高(89%~118%);联合选用V(正己烷)∶V(二氯甲烷)=1∶1和V(正己烷)∶V(乙酸乙酯)=1∶1萃取时,所有PAEs回收率为86%~115%,整体萃取效果最好,为本实验优选。
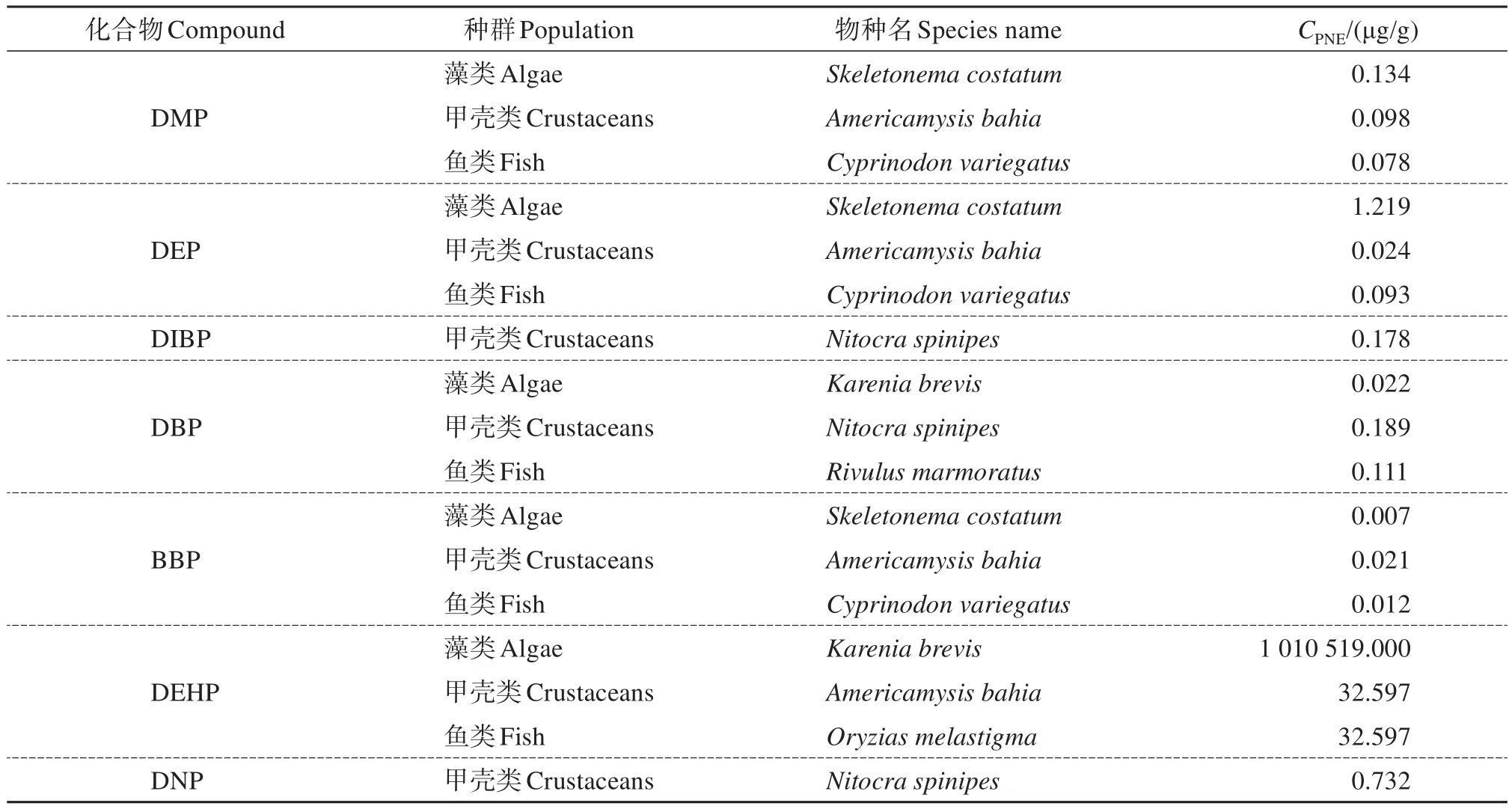
表2 海洋沉积物中PAEs的预测无影响浓度Table 2 Predicted no-effect concentration(CPNE)of PAEs in marine sediments
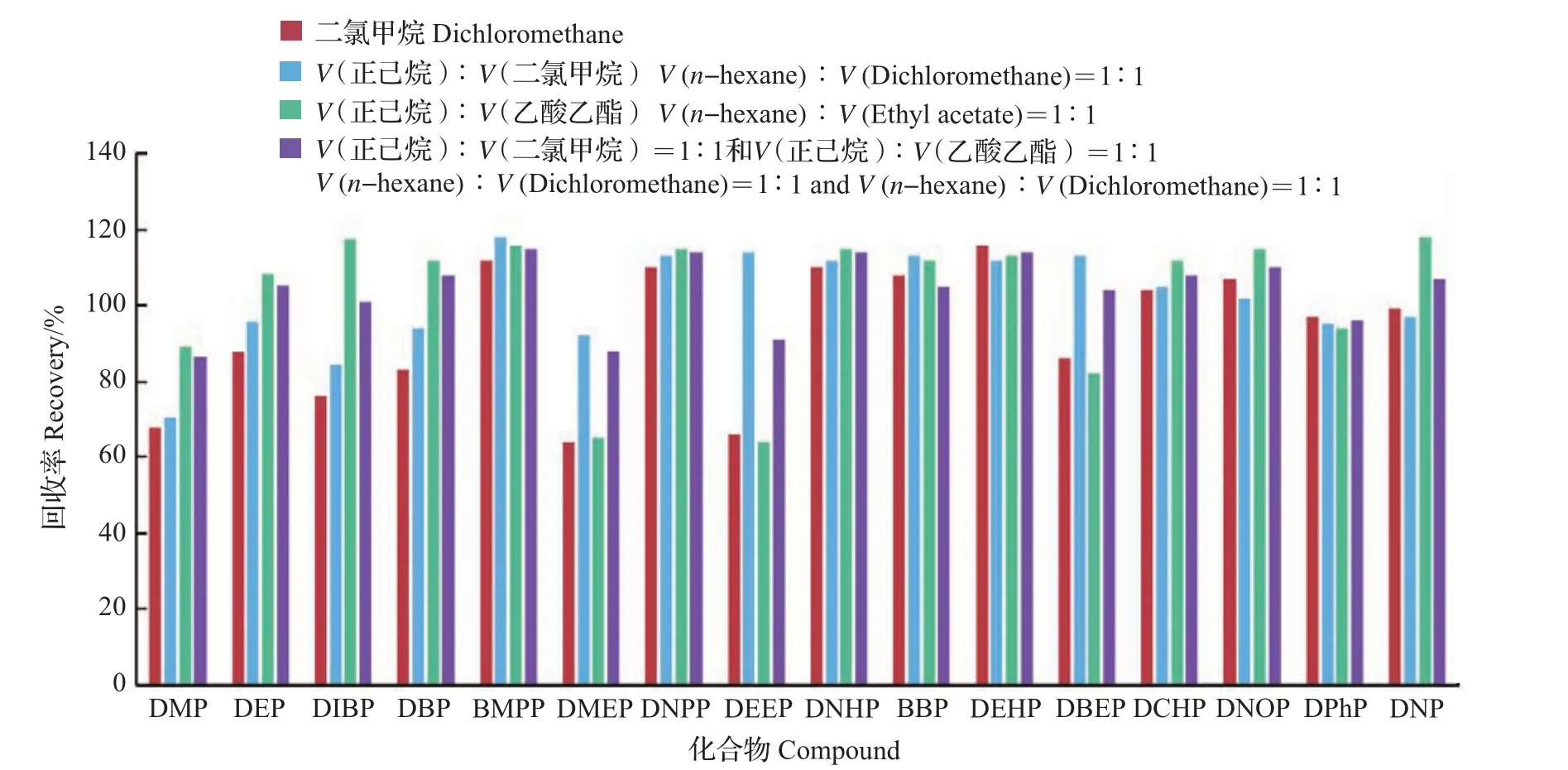
图2 不同萃取剂对PAEs的萃取效果比较Fig.2 Comparison of extract efficiency for PAEs by different extractants
2.2 固相吸附剂及分散剂的选择
由于PAEs不耐酸碱,所以大多数文献采用层析柱或商品化SPE小柱净化。此外,采用浓硫酸净化、分散式固相萃取、分散液液微萃取也有少量报道。张渝等[13]采用微波辅助萃取、C18吸附剂分散固相萃取净化和GC-MS法测定土壤中的邻苯二甲酸酯的结果表明,该方法前处理需要在土样中加入弗罗里硅土,基质效应明显,且吸附剂仅分散在丙酮溶液中;进一步研究发现,丙酮中C18对DMP、DEP的吸附性较强。由于邻苯二甲酸酯种类众多,性质差异较大,因此,寻找一种合适的分散固相吸附剂,且不会带来基质效应,同时选择合适的分散剂以保证所有待分析的邻苯二甲酸酯的回收率,是突破现有方法瓶颈的关键所在。
本研究分别考察了200 mg PSA、C18、GCB、Si、弗罗里硅土等吸附剂的除杂效果。结果(图3和图4)表明:经过GCB吸附,分散液基本呈无色透明,除色效果最好,所有PAEs的回收率相对较高(78.5%~115%)。而其他吸附剂或多或少对PAEs略有吸附,如:PSA 对 DMP、DPhP、DNP有所吸附 ;C18对DMP、DMEP、DEEP、DBEP 有所吸附,且对干扰DNPP检测的杂质不起作用;Si对DNP有所吸附;弗罗里硅土对DMEP、DEEP有所吸附。因此,本实验选择200 mg GCB作为DSPE吸附剂。
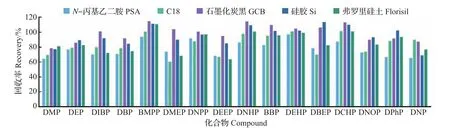
图3 不同吸附剂对PAEs的净化效果比较Fig.3 Comparison of purifying effect for PAEs by different adsorbents
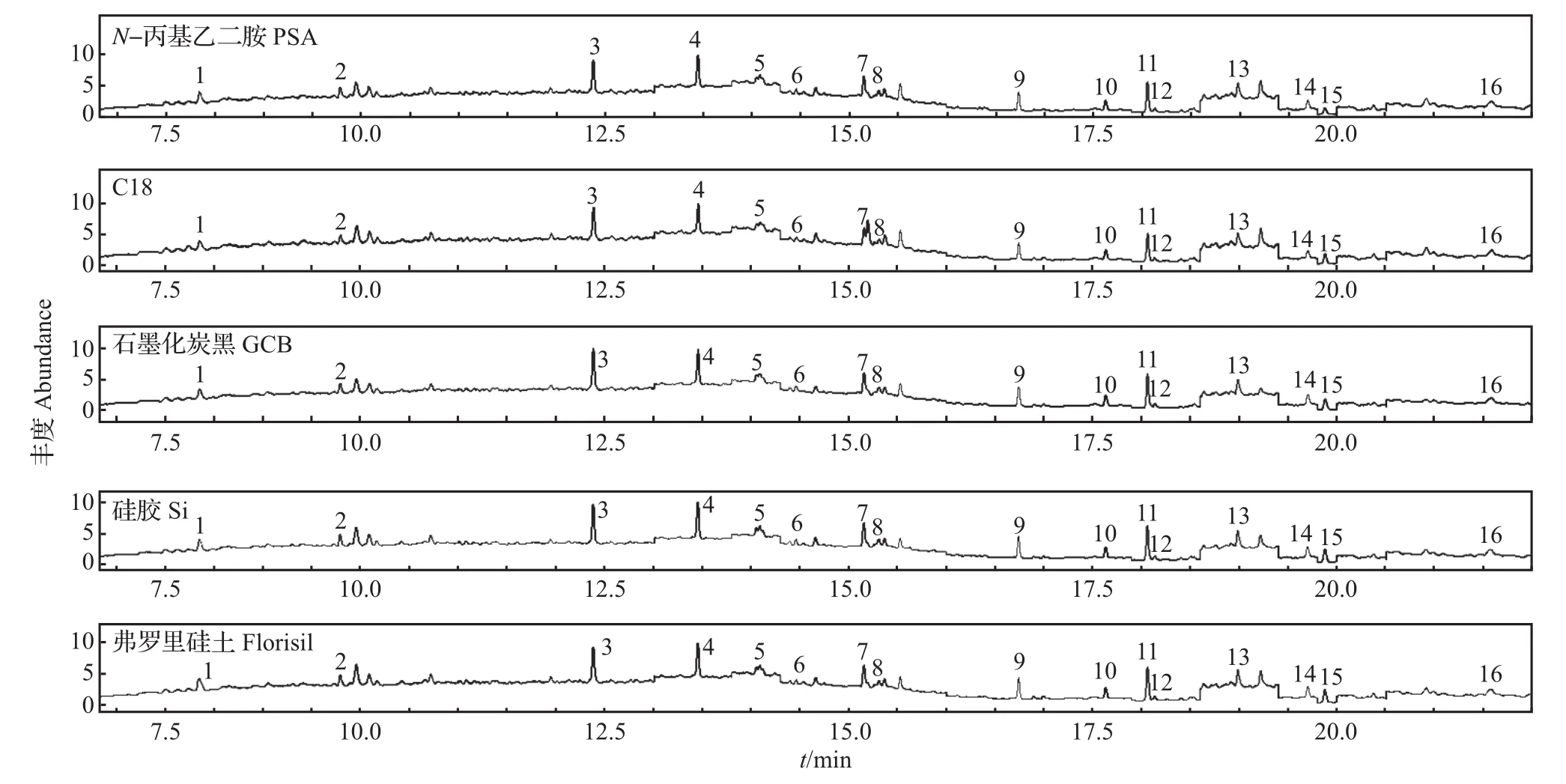
图4 不同固相吸附剂净化时PAEs的总离子流色谱图Fig.4 Total ion current chromatograms of PAEs purified by different adsorbents
结合已有文献,采用DSPE净化土壤[13]或生物样[33]中PAEs时,使用1种分散剂的回收率较差,而本课题组前期通过DSPE净化海产品中PAEs时,使用GCB吸附剂结合多种分散剂,达到了满意效果[23]。因此,针对本研究中的沉积物,选用2 mL正己烷、2 mL丙酮、2 mL二氯甲烷、2 mL甲醇作为分散剂。
2.3 标准曲线和检出限
配制质量浓度为1~1 000 μg/L的混合标准系列溶液,按设定的仪器工作条件测定,结果(表3)表明,16种PAEs的线性关系良好,相关系数均大于0.999,以3倍信噪比计算的各化合物的检出限为0.10~0.25 μg/kg。
2.4 方法的精密度和回收试验
在温州南麂岛海域采集的沉积物样品中分别添加3个质量浓度水平的混合标准溶液,平行测定5次,加标回收率为75%~116%,相对标准偏差为3.1%~7.2%,结果的准确度和精密度满足分析方法要求(表4)。
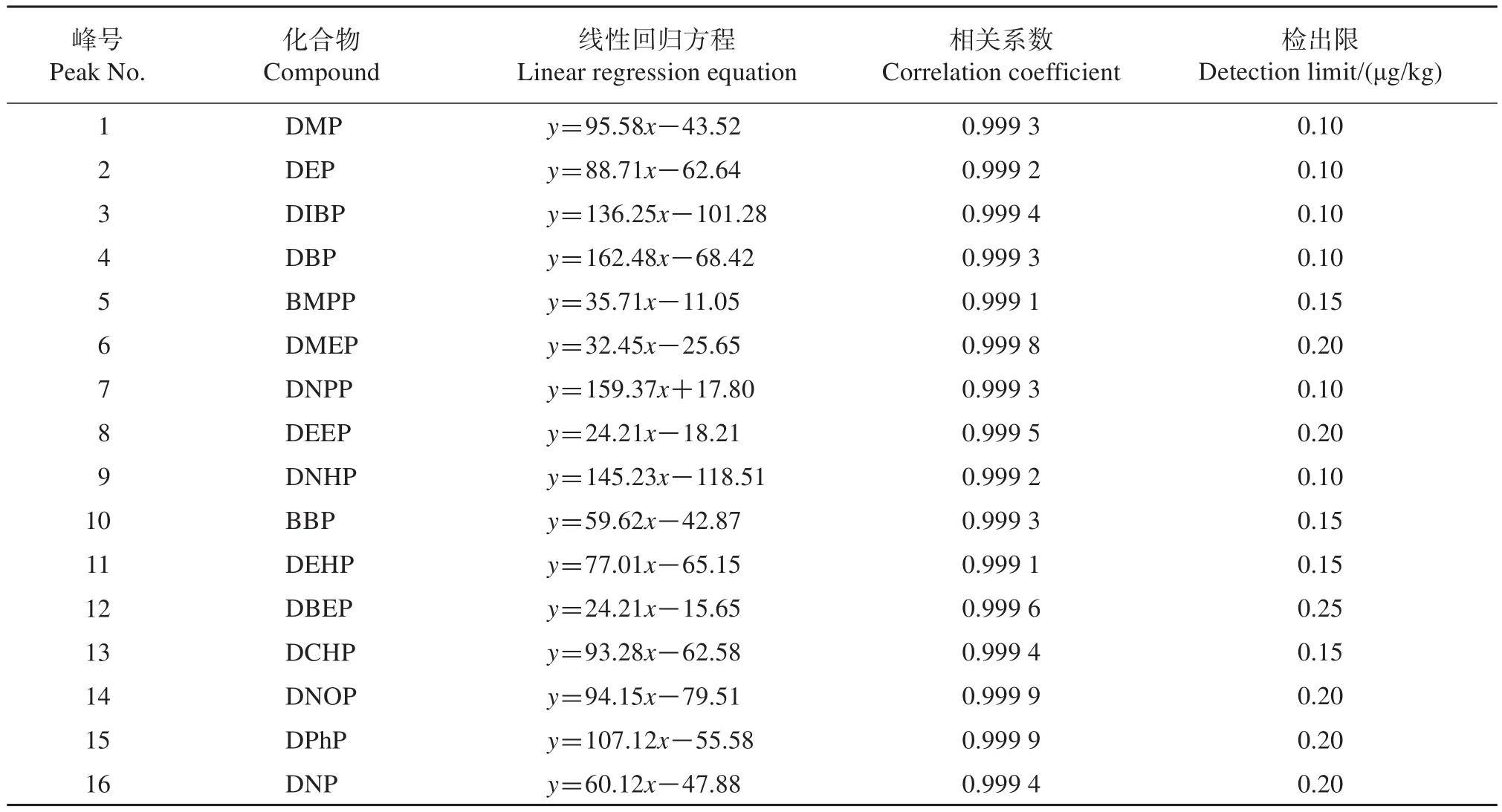
表3 16种PAEs的线性回归方程、相关系数和检出限Table 3 Linear regression equation,correlation coefficient and detection limit of 16 PAEs
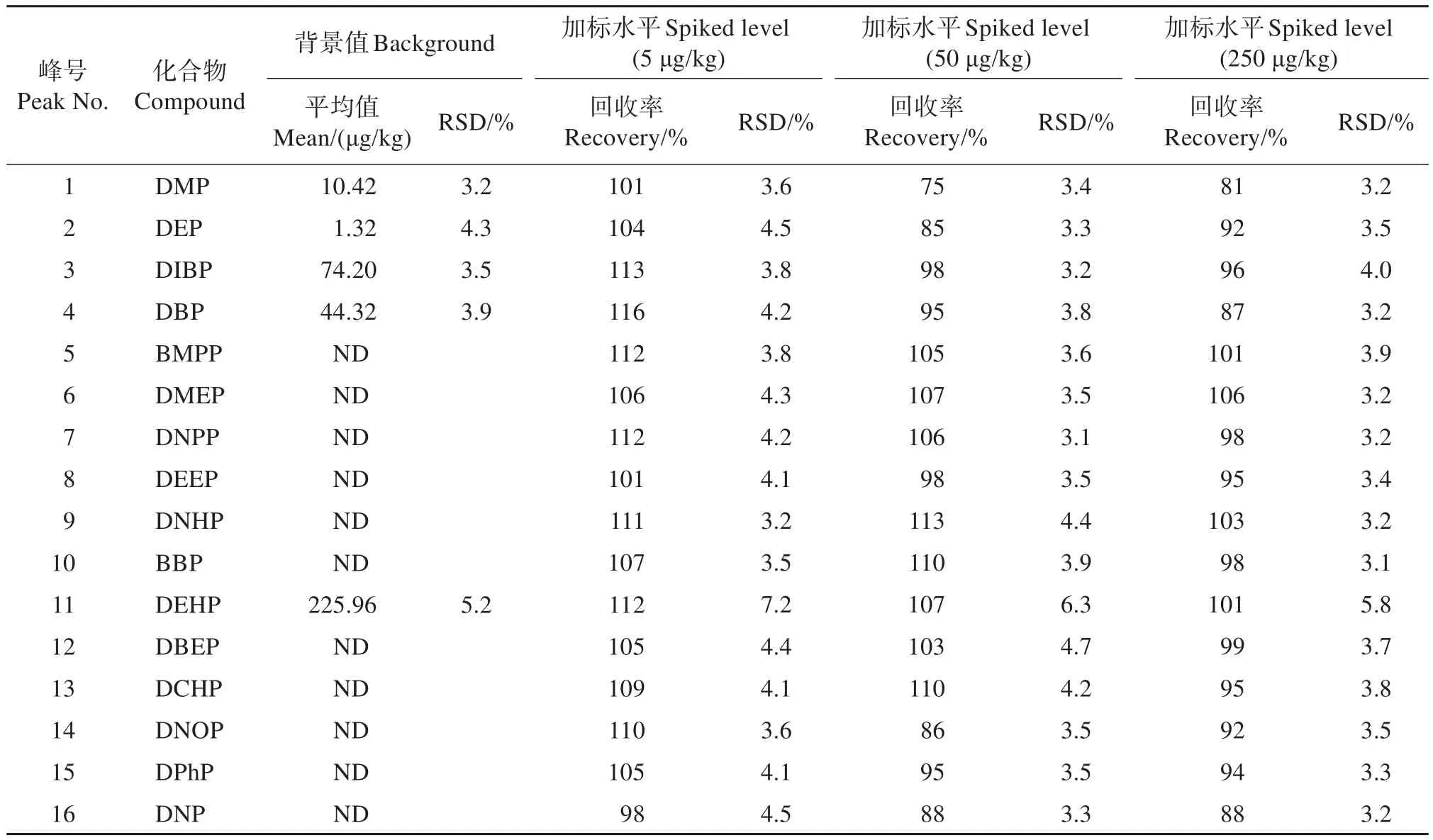
表4 精密度和回收试验结果Table 4 Results of test for precision and recovery
2.5 样品分析及生态风险评估
按照试验方法分别测定台州三门湾海域、温州南麂岛海域采集的沉积物样品,结果(表5)表明:在所有样品中,DMP、DEP、DIBP、DBP、DEHP均有检出,质量分数为1.32~277.98 μg/kg,占PAEs总量的98.7%~100%;此外,在部分样品中也有DNP被检出;16 种 PAEs的总量为 297.43~550.25 μg/kg。在不同采样点采集的海洋沉积物中PAEs组分特征如图5所示,在台州三门湾海域、温州南麂岛海域采集的海洋沉积物中DIBP、DBP、DEHP所占比例均最高,分别占PAEs总量的88.7%~92.7%和94.1%~96.7%。
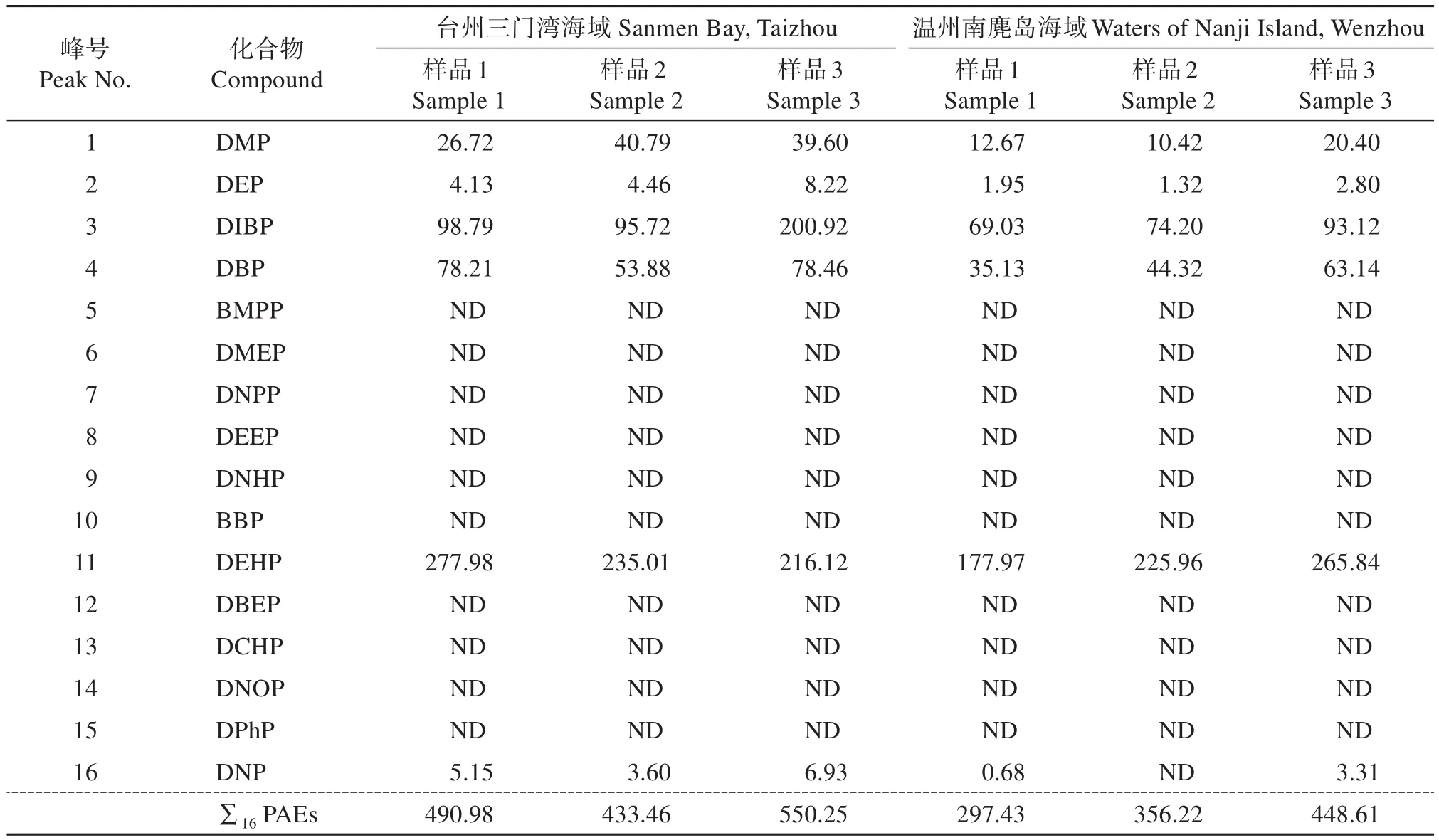
表5 样品分析结果Table 5 Analysis results of the samples μg/kg
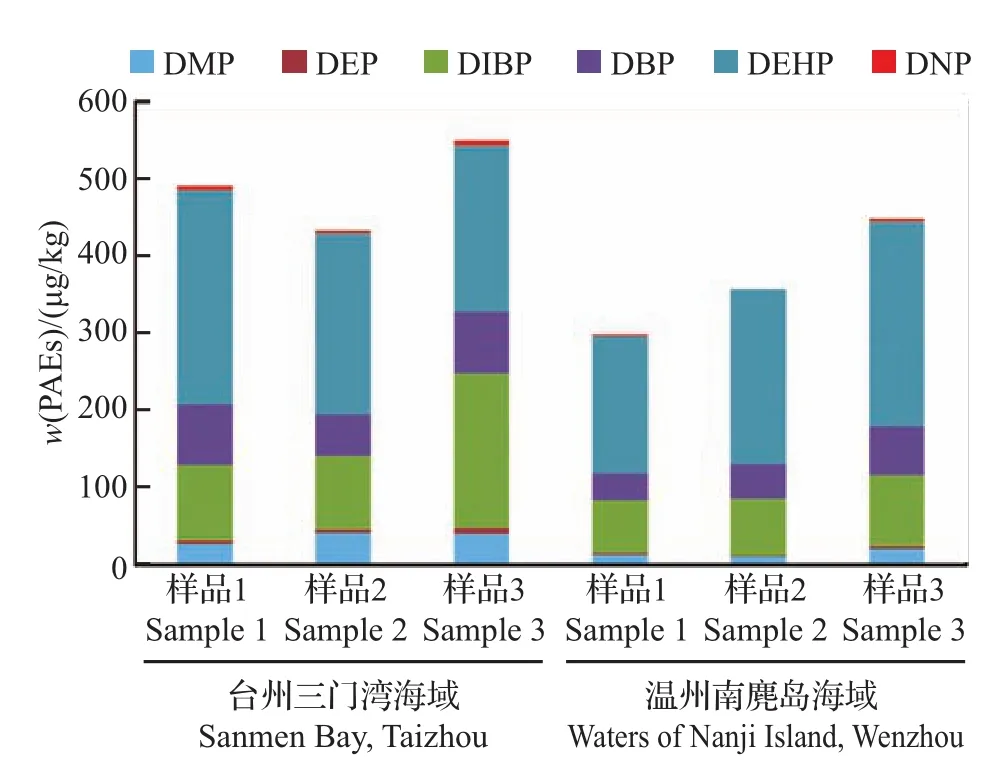
图5 不同采样点采集的海洋沉积物中PAEs组分特征Fig.5 Composition of PAEs in marine sediments collected at different sampling points
根据质量基准法评价,各采样点沉积物中的PAEs含量(CME值)均小于相应的环境风险限值(ERLs),其中台州三门湾海域CME/ERLs范围为0~0.28,温州南麂岛海域CME/ERLs范围为0~0.27,因此,生态风险较低。
根据商值法评价,在海洋沉积物中各PAEs对藻类、甲壳类和鱼类的风险商值见表6。由于DIBP和DBP的lgKow值分别为4.11和4.45,因此其QR值与1进行比较;DEHP的lgKow为7.50>5,因此其QR值与10进行比较;DMP和DEP的lgKow值分别为1.61和2.38,均小于3,因此其对水生生物的风险可忽略。由表6可知,在台州三门湾海域海洋沉积物中5种PAEs对水生生物的风险商值为2.1×10-7~3.57,温州南麂岛海域为1.8×10-7~2.87。DEHP的QR值均远小于0.1,说明DEHP对水生生物为低风险;DIBP对台州三门湾海域甲壳类的QR值为0.54~1.13,均值为0.74,对温州南麂岛海域为0.39~0.52,均值为0.44,为中等风险;DBP对台州三门湾海域藻类的QR值为2.45~3.57,均值为3.19,对温州南麂岛海域为1.60~2.87,均值为2.16,呈高风险;DBP对甲壳类和鱼类均为中等风险。总体上,在海洋沉积物中PAEs对藻类、甲壳类、鱼类的风险大小顺序为DBP>DIBP>DEHP。

表6 海洋沉积物中5种PAEs的风险商值(QR)Table 6 Risk quotient(QR)of five PAEs in marine sediments
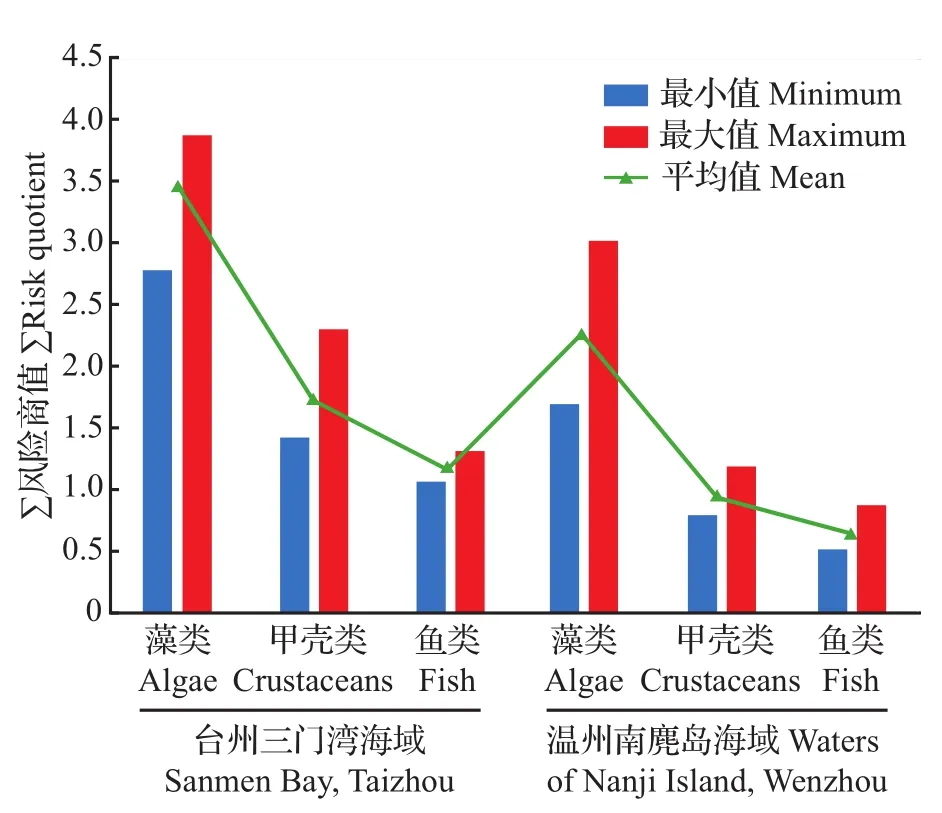
图6 不同采样点采集的海洋沉积物中5种PAEs对不同水生生物∑QR的影响Fig.6 ∑QRfor different aquatic organisms in five PAEs of marine sediments collected at different sampling points
在不同采样点采集的海洋沉积物中5种PAEs对藻类、甲壳类、鱼类的∑QR见图6。台州三门湾海域5种PAEs对水生生物的∑QR范围为1.06~3.87,温州南麂岛海域为0.51~3.02;在各采样点沉积物样品中PAEs对藻类的风险最大,其次为甲壳类,对鱼类的风险最小。总体上,台州三门湾海域PAEs对水生生物的风险略高于温州南麂岛海域。
3 结论
本研究采用超声波萃取法提取海洋沉积物中的PAEs,提取液浓缩后经200 mg GCB分散固相萃取净化后,进行GC-MS分析和萃取剂、固相吸附剂、分散剂选择优化,并进行了方法准确度、精密度考察。结果表明,所测样品中PAEs总量为297.43~550.25 μg/kg,组成上以DIBP、DBP、DEHP为主,占PAEs总量的88.7%~96.7%;经生态风险评估表明,当采用质量基准法评价时,各采样点沉积物中PAEs含量均小于相应的环境风险限值,生态风险较低;采用风险商值法评价表明,PAEs对藻类的风险最大,其次为甲壳类,对鱼类的风险最小。总体上,台州三门湾海域PAEs对水生生物的风险略高于温州南麂岛海域。
