复合微生物肥对茶树生长的促进作用初探
2019-07-07肖开兴肖析蒙杨瑶君易志飞
肖开兴,肖析蒙,杨瑶君,易志飞,唐 雪
(1.乐山师范学院 竹类病虫防控与资源开发四川省重点实验室,乐山 614000;2.乐山师范学院 生命科学学院,乐山 614000;3.西华大学, 食品与生物工程学院,成都 610039)
农药化肥对茶树品质造成严重破坏,急需要生态环保的新技术。近年来,微生物菌肥对植物的促生、抗病等领域的研究速度迅猛,已发现其对谷类和豆科等植物的增产、增收效果显著[1],根际促生菌有助于增加植物盐胁迫能力,增强植株耐受性[2],为满足农业可持续发展的需要,使用菌肥代替部分化肥已经受到了研究人员的关注[3],复合微生物肥是一种经过特殊的加工工艺制成的、含有活菌的生物肥料,可通过解磷、固氮、解钾来提升土壤中营养元素的效果[4],在本实验中,以植株的生长状态,叶片中茶多酚、叶绿素的含量,土壤中氮磷钾的含量作为体现复合微生物肥促生、抗病效果的主要检测指标。
茶叶源自中国,早期是作为祭品使用,茶叶饮品也被誉为“世界三大饮品之一”,茶多酚(tea polyphenols, TPs)是茶叶中多类物质的总称。研究表明,饮茶对人体健康具有重要的保护作用,且其药理作用和安全性已经得到证实[5~6]
叶绿素(chlorophyll)是植物光合作用最重要的色素之一,也是评价叶片光合能力的主要指标之一[7],植物先通过叶绿素利用光能来进行光合作用从而为植物提供营养,经研究表明,对植物使用菌肥后植株叶片中叶绿素含量的提高[8]。
土壤中的营养元素的存在状态对植物来说至关重要,其含量也是影响植物生长发育的重要条件,氮、磷、钾作为大量元素,对植物的生长尤为重要,本实验分析了复合微生物肥对茶树土壤中的铵态氮、速效磷、有效钾的影响,以期研究复合微生物肥对增加茶叶产量和改善茶叶品质的作用。
1 材料与方法
1.1 材料与仪器
1.1.1 材料
1.1.1.1 试验材料
1.1.1.1.1 茶树株高测试材料 该实验所有测试项目实验材料由乐山市夹江县迎江乡郭坪村(经度:103.50纬度:29.78)茶树种植基地提供,测量初次选取长势大致相同的植株,共测试样品60株,其中1~30号样品为处理组(生长期间施加复合微生物肥); 31~60号样品为对照组(生长期间施加普通化肥),处理组用地和对照组用地之间相隔7 m,处于同一水平面上,初次测量时间为2018年3月,二次测量时间为2018年12月。
1.1.1.1.2 茶多酚测试材料 在以下3个测试项目中,实验材料的选取与上述茶树株高测试材料选取的地区一致,海拔相同,茶树长势以及前期施肥情况相同。本项目测试样品共30组,其中1~15号样品为处理组(生长期间施加复合微生物肥);16~30号样品为对照组(生长期间施加普通化肥)。茶叶样品的采制参考《茶树种质资源描述规范和数据标准》[9]。2019年1月12—15日进行样品茶多酚含量测定[10]。
1.1.1.1.3 叶绿素测试材料 该项目共测试样品30组,其中1~15号样品为处理组(生长期间施加复合微生物肥);16~30号样品为对照组(生长期间施加普通化肥)。样品在采制时选取顶部成熟叶片,避免采摘的叶片出现破损、虫病等情况,采摘的大小要求基本一致2019年1月21—24日进行样品叶绿素含量测定[11]。
1.1.1.1.4 土壤中主要营养元素测量材料 该项目共测试样品30组,其中1~15号样品为处理组(生长期间施加复合微生物肥);16~30号样品为对照组(生长期间施加普通化肥)。选取植株根系附近土壤作为实验样品,为避免土壤物质理化性质遭到破坏,将样品于通风处自然风干约10 d,所得干燥样品便于实验后续操作。
1.1.1.2 化学试剂 茶多酚纯品、酒石酸钾钠、氯化亚铁、丙酮、磷酸二氢钾、磷酸氢二钠(以上试剂均为AR级)、土壤养分测定相关试剂(由托普云农科技股份有限公司提供)。
复合微生物肥 由四川鑫鑫骄扬生物科技有限公司提供,产品含枯草芽孢杆菌等有效菌5亿CFU/克,有机质70%,蓄水倍数60倍。
酒石酸亚铁溶液 准确称取硫酸亚铁样品1g,酒石酸钾钠样品5 g,加水溶解后定容至1L(可加少量铁粉防止配置好的溶液发生氧化)。
pH7.5磷酸缓冲溶液 准确称取磷酸二氢钾9.08 g(经过100 ℃、2.5h烘干处理),加水溶解后定容至1L;准确称取磷酸氢二钠23.9 g,加水溶解后定容至1L,需用时取上述两种溶液按照KH2PO4∶Na2HPO4=17∶3的比例均匀混合使用。
1.1.2 实验仪器
分光光度计、土壤测定仪(本项目测定使用土壤测定仪由托普云农科技股份有限公司研发)、摇床、烘箱、水浴锅、电子天平。
1.2 方法
1.2.1株高测量方法
测量植株基部至主茎顶部记为主茎生长点之间的距离。根据实际情况,本实验采用软皮尺进行数据测量。
1.2.2 叶片样品处理方法
样品采集后,将样品放至0 ℃冰箱保存,实验时,取大小大致相同叶片,在其同一部位,避开比较粗大的叶脉,选取约1 cm2,均匀切成1 mm宽、5 mm长的细丝状,切成20份。
1.2.3 土壤样品处理方法
将土壤放置于通风口,均匀铺在干净的纸板上,风干10 d,待风干后,将样品碾磨处理,过80目筛,去除土壤中植物根茎等杂质。收集处理好的样品(完成每项测量指标需处理好的土壤样品4~5 g)。
1.2.4 样品中茶多酚的检测
1.2.4.1 制作茶多酚标准曲线 茶多酚类的物质能够和亚铁离子结合,形成蓝色的络合物,并且在一定波长有最大的吸收度,茶多酚在溶液中的含量与形成的络合物的吸光度在一定范围内成正比,因此可用分光光度法测量茶多酚在溶液中的含量。本实验需准确称取0.5 g茶多酚纯品,用水定容至100 mL,用移液枪量取0.00 mL、0.10 mL、0.20 mL、0.30 mL、0.40 mL、0.50 mL,加水至10 mL,再向其加入酒石酸亚铁溶液5 mL[12],混合均匀加入磷酸缓冲液至刻度,摇匀,静置10 min。在550 nm处用空白溶液作为参比,测定其吸光度,从而绘制茶多酚标准曲线。
1.2.4.2 样品中茶多酚含量的测定 每组取茶叶样品0.5 g倒入装有20 mL水的玻璃管中,放置于水浴锅中,水浴温度为60 ℃,浸提时间为120 min[13]。水浴完成后,用移液枪吸取茶叶样品浸提液2 mL,同时,加入配制好的酒石酸亚铁溶液5 mL,再加入蒸馏水8 mL,摇匀,加入磷酸缓冲液至容量瓶刻度线,摇匀,静置10 min。在550 nm处用空白溶液作为参比,测定其吸光度,根据绘制好的茶多酚标准曲线(见图1)计算得出样品中的茶多酚浓度。
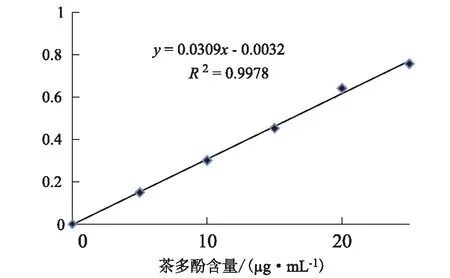
图1 茶多酚标准曲线
1.2.5 样品中叶绿素含量的测定
1949年经Arnon解释和推导以来[14],丙酮法作为Arnon法在国际上被广泛应用至今[15]。将处理好的叶片样品倒入20 mL、80%丙酮溶液中,在黑暗条件下提取24 h。根据Lambert-Beer定律,在645 nm和663 nm处用80%丙酮溶液作为参比,测定其吸光度,根据以下公式计算得出样品中叶绿素的含量:
C=Ca+Cb=8.04A663+20.29A645[16]
(1)
1.2.6 土壤样品中铵态氮、速效磷、有效钾含量的测定
本项目测定使用托普云农科技股份有限公司研发的土壤养分测试仪。
1.2.6.1 铵态氮含量的测定 每组准确称取土壤样品4 g,放入容量为100 mL三角瓶中,加入20 mL蒸馏水以及1号粉末1 g,在摇床中摇匀10 min,160 r·min-1,过滤,所得滤液用移液枪吸取 1 000μL于比色皿中,此为待测液;用移液枪吸取900 μL蒸馏水,再加入100 μL氮标准溶液,混匀,所得溶液为标准液;用移液枪吸取2 mL蒸馏水于比色皿中,此为空白液。向标准液和待测液中各加入100 μL氮1号试剂,混匀,再加入100 μL氮2号试剂,混匀。停放20 min,再加入800 μL蒸馏水,立即上机操作,记录数据。
1.2.6.2 速效磷含量的测定 每组准确称取土壤样品4 g,放入容量为100 mL三角瓶中,加入20 mL蒸馏水以及2号粉末0.5 g(用精确pH试纸测定土壤为弱碱性),在摇床中摇匀10 min,160 r·min-1,过滤,所得滤液用移液枪吸取200 μL于比色皿中,再加入800 μL蒸馏水,此为待测液;用移液枪吸取900 μL蒸馏水,再加入100 μL磷标准溶液,混匀,所得溶液为标准液;用移液枪吸取 2 000 μL蒸馏水于比色皿中,此为空白液。向标准液和待测液中各加入100 μL磷1号试剂和800 μL蒸馏水,混匀,再加入50 μL磷2号试剂,混匀。立即上机操作,记录数据。
1.2.6.3 有效钾含量的测定 每组准确称取土壤样品4 g,放入容量为100 mL三角瓶中,加入20 mL蒸馏水以及1号粉末1 g,在摇床中摇匀10 min,160 r·min-1,过滤,所得滤液用移液枪吸取 1 000 μL于比色皿中,此为待测液;用移液枪吸取900 μL蒸馏水,再加入100 μL钾标准溶液,混匀,所得溶液为标准液;用移液枪吸取2mL蒸馏水于比色皿中,此为空白液。向标准液和待测液中各加入100 μL钾1号试剂,混匀,再加入100 μL钾2号试剂,混匀。停放5 min,再加入800 μL蒸馏水,立即上机操作,记录数据。
2 结果与分析
2.1 株高测量结果与分析
从图2可以看出,在经过施肥处理的茶树处理组中,在第二次记录数据时,第7组的长速最快,增长达到了56 cm,第30组的生长速度较慢,增长了11 cm,在经过复合微生物肥施肥处理的30株样品植株中,其平均株高达到了102.73 cm,初次测量时平均株高为74.67 cm,植株平均增高达到了28.06 cm,增幅达37.58%。
从图3中可以看出,没有经过施肥处理的对照组,在进行第二次测量的时候,第47组的长速最快,增长达到了30 cm,第35组的生长速度较慢,仅生长了2 cm,在未经过复合微生物肥施肥处理的30株样品植株中,其平均株高为89.90 cm, 初次测量时平均株高为73.87 cm,植株平均增高达到了16.03 cm,增幅为21.66%。
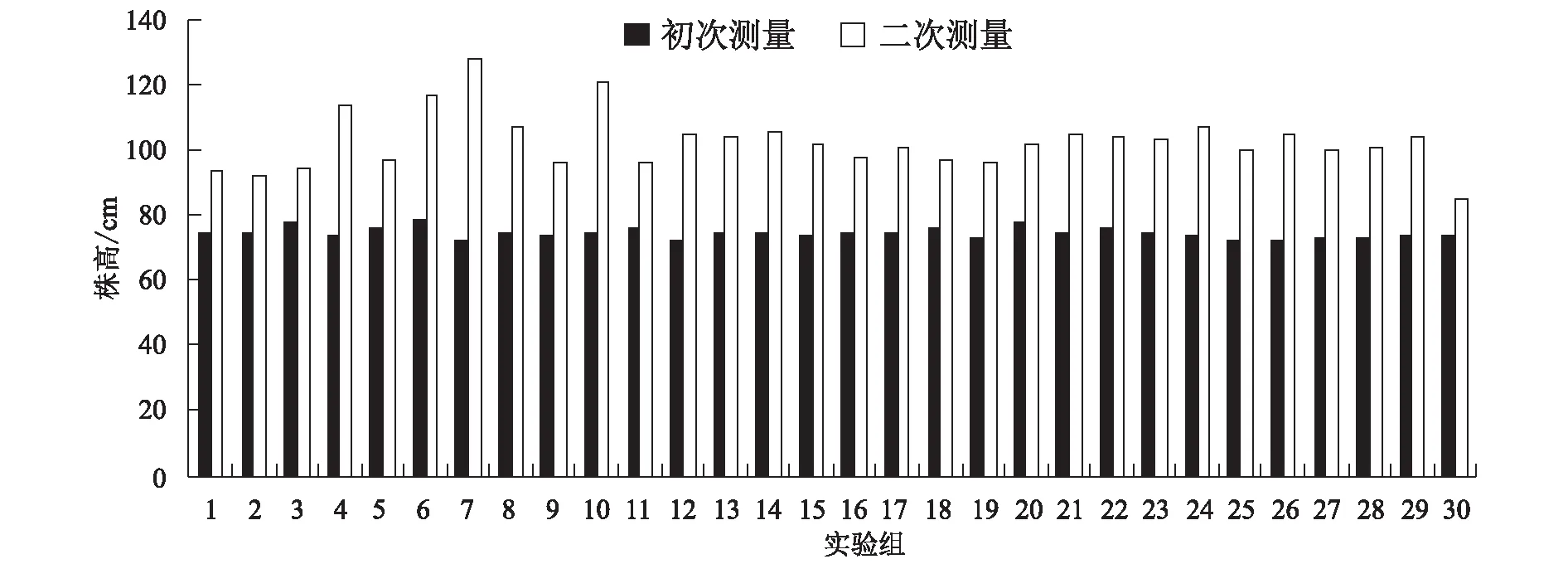
图2 实验组株高测量结果
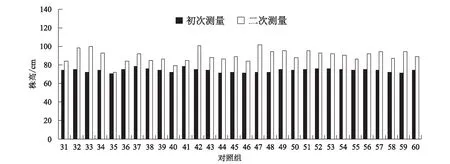
图3 对照组株高测量结果
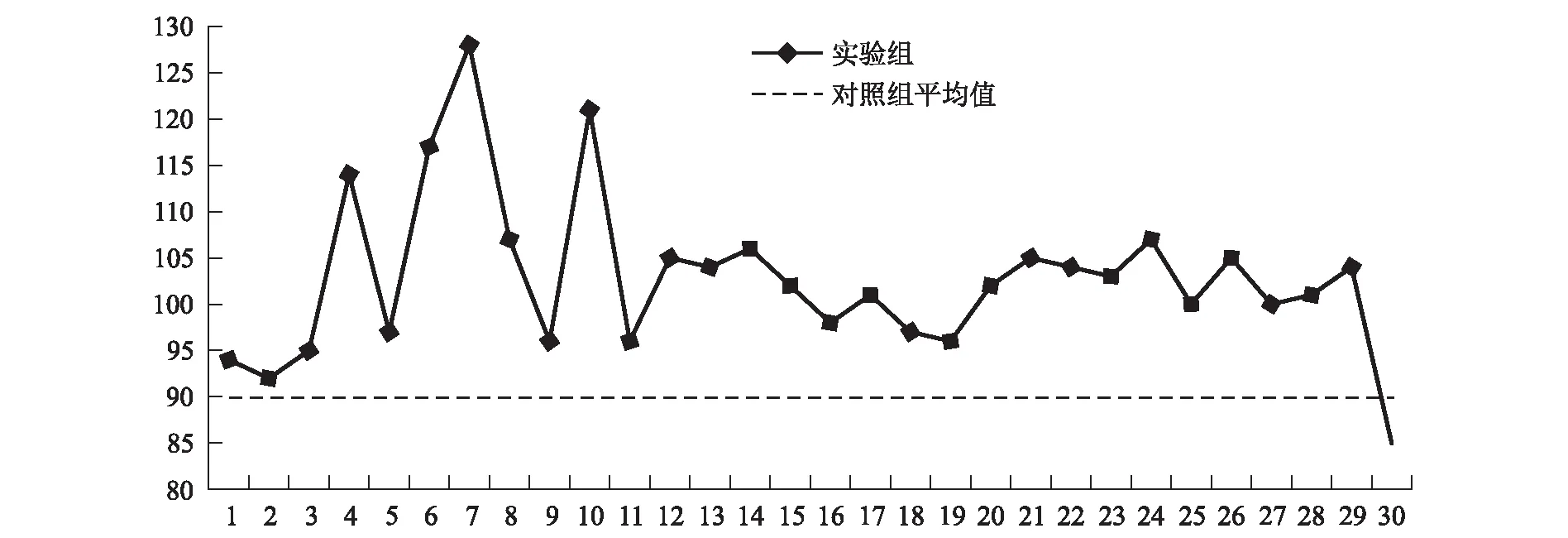
图4 实验组与对照组株高平均值比较结果
结合实验组和对照组的数据来看,在初次测量时,为保证实验的科学性、准确性,在选择实验对象时,选取的实验组样本即施肥处理的30株茶树比选取的对照组即未施肥处理的30株茶树在平均株高上仅高出0.8 cm,在第二次测量时,实验组即施肥处理的茶树比对照组即未施肥处理的茶树仅高达12.83 cm,在实验组的30组样本中,有29组的增长高度高于对照组的平均水平,有1组的增长高度略低于对照组的平均水平。经Excel的显著性分析结果显示,复合微生物肥对茶树的生长具有促进作用,且效果明显。
2.2 茶多酚含量测量结果与分析
由表1可以看出,经过施肥处理的15组茶树样品中,其茶叶中的茶多酚含量最高可达411.43 g·kg-1,最低为309.49 g·kg-1,极差为101.94 g·kg-1,平均含量为374.86 g·kg-1;未经过处理的15株茶树样品中,其茶叶中的茶多酚最高为406.58 g·kg-1,最低为293.31 g·kg-1,极差为113.27 g·kg-1,平均含量为334.99 g·kg-1;经过施肥处理的15株茶树的茶叶的平均茶多酚含量比未经过处理的15株茶树样品中茶叶的平均茶多酚含量高出36.87g·kg-1。在实验组的15组样本中,有13组的增长高度高于对照组的平均水平,有2组的增长高度略低于对照组的平均水平,增长率达86.7%,且实验组和对照组的差异性极显著(P=0.002832<0.01)。经实验测量结果表明,复合微生物肥对茶树的生长具有促进作用,且效果明显。实验结果显示,该复合微生物肥有助于提高茶树中茶多酚含量,进一步提升茶叶的品质。
表1 茶叶中茶多酚含量的测量数据
Tab.1 The measurement data of contents of tea polyphenols

处理组对照组平均值371.86334.99最大值411.43406.58最小值309.49293.31变异系数%(CV)0.07380.1092
2.3 叶绿素含量测量结果与分析
由表2我们可以知道经过施肥处理的15组茶树样品中,其茶叶中的叶绿素含量最高可达1.04 mg·g-1,最低为0.98 mg·g-1,极差为0.06 mg·g-1,平均含量为1.00 mg·g-1;未经过处理的15株茶树样品中,其茶叶中的茶多酚最高为1.01 mg·g-1,最低为0.96 mg·g-1,极差为0.05 mg·g-1,平均含量为0.986 mg·g-1;经过施肥处理的15株茶树的茶叶的平均茶多酚含量比未经过处理的15株茶树样品中茶叶的平均茶多酚含量高出0.02 mg·g-1。在实验组的15组样本中,有13组的增长高度高于对照组的平均水平,有2组的增长高度略低于对照组的平均水平,且实验组和对照组的差异极显著(P=0.000253<0.01),实验结果显示,该复合微生物肥有助于茶树中叶绿素含量的提高。
表2 茶叶中叶绿素含量的测量数据
Tab.2 The measurement data of contents of chlorophyll

处理组/(mg·g-1)对照组/(mg·g-1)平均值1.004320.98563最大值1.03537 1.01085 最小值0.98560 0.96176 变异系数%(CV)0.0125710.012715
2.4 土壤中铵态氮、速效磷、有效钾含量测量结果与分析
2.4.1 铵态氮含量测量结果与分析
铵态氮是氮元素的一种自然存在状态,它可以与其他形式的氮元素在某些条件下相互转化,易溶解,因此能够被植物快速吸收,同时也容易被水分带走。从表3可以看出在经过施用复合微生物肥处理的15个样品中,铵态氮平均值达到了122.134 mg·kg-1,最大值为297.62 mg·kg-1,而未经过施用复合微生物肥处理的15个样品中,铵态氮的平均值为40.571 mg·kg-1,最大值为129.63 mg·kg-1,在平均值上增长了81.563 mg·kg-1,增幅达49.74%。增长态势稳定、良好,且实验组和对照组差异性极显著(P=0.000772<0.01)。经过试验结果证明,复合微生物肥有助于土壤中的铵态氮的固定,增加土壤中铵态氮的含量,有利于植物的生长。
2.4.2 速效磷含量测量结果与分析
速效磷指的是在土壤中容易被植株吸收的磷成分,也是评价土壤提供磷水平的一个重要指标,当速效磷的含量达到25 mg·kg-1时,即被称为含磷较高的土壤[17]。由测量数据可以得出,复合微生物肥对速效磷在土壤中的固定并无显著性差异(P=0.374855>0.05),从表3可以看出,施用复合微生物肥的土壤速效磷的平均含量为58.169 mg·kg-1,降幅为6.09%,属于含磷较高的土壤,未使用菌肥的土壤速效磷的含量为61.941 mg·kg-1,同属于含磷较高的土壤。研究表明,施用枯草芽孢杆菌后,植物中的全氮、全磷、全钾含量均增加[18],即植物吸收的矿质元素增加,有利于植物的生长。
2.4.3 有效钾含量测量结果与分析
有效钾含量是土壤提供钾水平的一个重要指标,据表3可以看出,经过施肥处理的土壤,有效钾的含量被控制在了 1 048.442 mg·kg-1,而未经过施用复合微生物肥处理的土壤,有效钾的含量达到了 1 566.292 mg·kg-1,施用菌肥后土壤中的有效钾含量降低了约33%,且实验组和对照组具显著性差异(0.01 表3 土壤中铵态氮、速效磷、有效钾含量测量结果与分析 Tab.3 The contents measurements data and analysis of ammonium nitrogen、quick-impact phosphorus and effective potassium of chlorophyll 平均值(mg·kg-1)最大值(mg·kg-1)最小值(mg·kg-1)变异系数/%(CV)铵态氮(处理组)122.134 297.620 23.020 0.843752铵态氮(对照组)40.571 129.630 8.440 0.60022速效磷(处理组)58.169 163.040 10.940 0.375622速效磷(对照组)61.941 118.540 19.730 0.636471有效钾(处理组)1 048.442 2 128.900 311.300 0.587958有效钾(对照组)1 566.292 3 244.560 332.700 0.550017 本实验所使用的复合微生物肥有助于茶树的生长,促生长率达96%以上,选取样本在9个月的时间里,普遍生长28 cm以上,增幅达37.58%;该菌肥对茶叶中茶多酚含量增加也很明显,平均含量比未经过施肥处理的植株增长了36.87g·kg-1,相较于未施肥处理的植株,茶多酚含量增长约11%;叶片中的叶绿素含量在经过施肥处理后也有所提高,有利于植株进行光合作用积累有机物,有利于植株的生长;同时,菌肥的使用对土壤中的营养物质有所影响,尤其是对铵态氮的作用,平均增长了81.563 mg·kg-1,极大地提高了土壤中的氮成分含量,也对肥力不均的现象有所改善,有效控制了土壤中高钾含量的现象。 近几年来,在农民的种植方面,施肥是一个十分普遍的现象,种植和施肥已经紧密地联系在了一起,但是根据大量的实验证明,土地中作物对肥料的利用率不断下降,由此可知,施用化肥不能保证土地常年增产,且大量施用化肥还会造成土壤污染、水污染等一系列问题。微生物菌肥的出现极大地改善了这一情况,菌肥中的枯草芽孢杆菌、巨大芽孢杆菌在活化后产生的分解酶,能有效的将土壤中的有机质分解为小分子,释放出无机盐[20]。在植物发育的早期, 植物根际促生菌的使用会直接影响芽和植物根系的生长,从而提高植物吸收营养的能力以达到提高作物产量的作用[21]。将有机肥和复合微生物肥搭配使用,将会减少施肥用量,缓解土壤中肥力不均的问题[22]。除此之外,有研究证明,根际促生菌也有利于提高植物在干旱胁迫条件下造成的极端环境的存活率[23],将菌肥与改性吸水性竹纤维搭配使用,还可以运用到干旱土壤的种植,解决土壤板结,具有有效涵养水源,稳定供给营养成分的作用。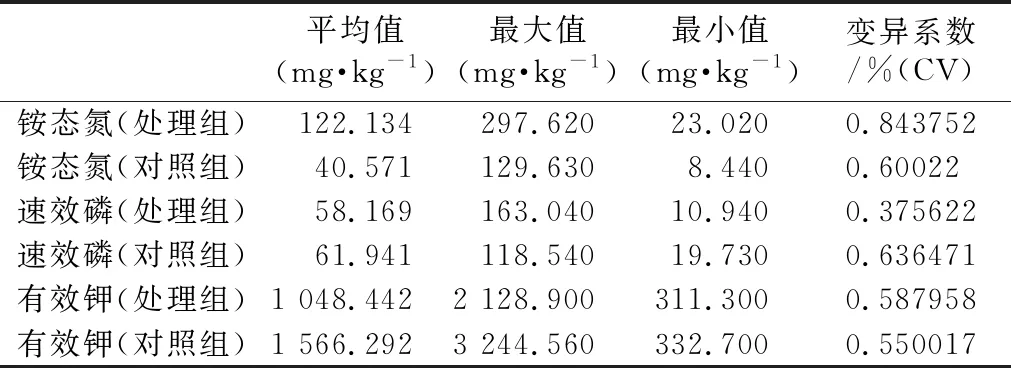
3 讨论
