牛支原体临洮分离株NOX-1的克隆表达、酶学活性及其亚细胞定位研究
2019-07-06张志雄邢小勇包世俊
李 丹,张志雄,邢小勇,包世俊
(甘肃农业大学动物医学院,兰州 730070)
牛支原体(Mycoplasma bovis,M. bovis)是牛科动物的一种重要的致病性支原体[1],感染后主要分布于牛呼吸道和乳腺组织中,可引起牛的角膜结膜炎、肺炎、乳腺炎、关节炎以及生殖道损伤等多种疾病[2-3]。自1961年Hale首次从患乳腺炎的病牛乳汁中分离到M. bovis以来[3],世界各地相继报道了牛支原体感染相关疫情。目前,牛支原体感染呈世界性分布,包括欧美等许多养牛业发达的国家和地区。2008年我国首次从患有坏死性肺炎的肉牛中分离出支原体,确诊为牛支原体肺炎[6]。目前,我国绝大多数地区发生牛支原体肺炎疫情,给我国养牛业造成了严重的经济损失[7]。
烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)氧化酶(NADH oxidase,NOX)在有O2存在的条件下,通过催化NADH生成NAD+。NOX可与以NAD+为辅酶的氧化还原酶偶联,在催化氧化还原反应的同时生成NADH,从而使辅酶能够循环再生,产生提高催化反应效率的效果。根据产物的不同,可将NOX分为两类:一类为产H2O2型NADH氧化酶(NOX-1),另一类为产H2O型NADH氧化酶(NOX-2)[8-9]。1996年,Higuchi等[10]对变形链球菌(Streptococcus mutans)的NOX-2基因进行了克隆和原核表达,并将其与粪链球菌(Streptococcus faecalis)NOX-1基因进行比对,发现相似性小于20.4%。1999年Auzat 等[11]通过对肺炎链球菌(Streptococcus pneumoniae)NOX的研究,首次发现了酶活性降低会导致病原微生物的适应力及毒力下降。2016年研究人员对蓝氏贾第鞭毛虫(Giardia lamblia)NOX基因进行克隆、表达及结构功能等相关研究,发现NOX蛋白与蓝氏贾第鞭毛虫致病性相关[12]。本研究采用PCR技术对牛支原体NOX-1基因进行扩增,进而完成NOX-1基因原核表达载体的构建、表达,以及表达产物NOX-1在M.bovis内的初步定位,以期为进一步探索NOX的生物学功能以及M. bovis有关后续研究奠定基础。
1 材料和方法
1.1 材料和试剂牛支原体(M. bovis)临洮株由甘肃农业大学动物医学院兽医传染病学实验室分离并保存;大肠杆菌(E. coli)DH5α、BL21(DE3)感受态细胞购自北京全式金生物有限公司;表达载体pET-28a(+)质粒购自Novagen公司;新西兰白兔(Oryctolagus cuniculus)购自中国农业科学院兰州兽医研究所实验动物中心。
限制性内切酶BamH Ⅰ和XhoⅠ、PrimerSTAR®Max DNA聚合酶购自TaKaRa公司;DNA Marker购自CWBio公司;Protein Marken、T4DNA Ligase购自Thermo公司;TMB(四甲基联苯胺)显色试色液、DAB(二氨基联苯胺)底物显示液购自Tiangen公司;Ni-NAT His Bind Purification Kit购自Novagen公司;支原体培养基基础购自Hopebio公司;胰蛋白胨、酵母提取物购自Oxoid公司;马血清购自Mhbio公司;Triton X-114、弗氏完全佐剂和弗氏不完全佐剂购自Sigma公司;羊抗兔HRP-IgG购自Canlife公司;其他试剂均为国产分析纯。
BCA(二喹啉甲酸)蛋白定量试剂盒购自Beyotime公司;DNA纯化回收试剂盒、质粒小提试剂盒购自Tiangen公司。
1.2 引物合成利用PrimerSelect软件,参照GenBank中M.bovisHubei株NOX-1基因序列(GenBank 登录号:NC_015725.1),并对序列中4个编码色氨酸的密码子TGA进行优化(表1)。
1.3 M. bovis基因组的提取将M.bovis临洮株菌液按10%接种量转接于牛支原体液体培养基,37℃、5%CO2环境中培养35 h,取1.5 mL菌液,9500×g离心10 min,用1×PBS洗涤2次,弃去上清后用100 μL双蒸水(ddH2O)重悬沉淀,沸水浴10 min,冰浴5 min,8000×g离心10 min,上清液即为粗提的M.bovis基因组DNA。
1.4 NOX-1基因的PCR扩增以粗提的M.bovis基因组DNA作为模板,采用PCR扩增得到M.bovis临洮株NOX-1基因。PCR反应体系为40 μL:2×PrimerSTAR®Max DNA聚合酶20 μL,模板(M.bovis基因组)2 μL,上、下游引物各1 μL,双蒸水(ddH2O)16 μL。样品送至金唯智生物科技有限公司进行测序,PCR反应条件见表2。

表1 NOX-1基因overlap PCR的引物序列Table 1 Primer sequences of NOX-1 gene for overlap PCR amplification

表2 PCR扩增条件Table 2 PCR amplification condition
1.5 序列分析应用DNAStar软件对不同分离株的NOX-1基因序列进行比较分析,并构建系统进化树。
1.6 原核表达载体的构建将优化后PCR产物与pET-28a (+)分别用BamHⅠ和XhoⅠ双酶切,回收产物于4℃过夜连接后转化大肠杆菌感受态细胞DH5α,涂布含有卡那霉素抗性的LB平板(1.0 g胰蛋白胨、0.5 g酵母提取物、1.0 g NaCl、1.1 g琼脂粉溶于100 mL蒸馏水中,高温灭菌后加入100 μg/μL卡那霉素75μL),于恒温培养箱中37℃过夜培养,挑取单个菌落进行菌液PCR鉴定,正确的阳性质粒命名为pET-NOX-1,并送金唯智生物科技有限公司进行测序。
1.7 pET-NOX-1原核表达及表达产物的纯化
1.7.1 pET-NOX-1原核表达 取重组表达质粒pETNOX-1转化E. coli感受态细胞BL21,涂布于LB培养基平板,挑取单个菌落于5 mL LB液体培养基中过夜培养后,按1%比例转接于5 mL 2-YT培养基中,待OD值达0.6时加入终浓度为1 mmol/L的IPTG诱导表达,并进行SDS-PAGE分析。
1.7.2 目的蛋白纯化 取200 mL经IPTG诱导的菌液在4℃、8000×g离心10 min后弃上清,沉淀用PBS洗涤2次,重悬于10 mL Binding Buffer中,并使用超声波破碎(45%,工作5 s,间歇5 s)。待破菌悬液至透亮后4℃、8000×g离心10 min,上清用0.45 μm滤膜过滤后,应用Ni-NAT His Bind Purification Kit纯化目的蛋白(操作方法参照试剂盒说明),纯化产物使用SDS-PAGE进行分析,最后用BCA蛋白定量试剂盒测定目的蛋白含量。
1.8 His-NOX-1酶促活性及其影响因素的测定
1.8.1 His-NOX-1的酶活性测定 反应体系为2 mL,0.1 mol/L的磷酸钾缓冲液(pH 7.5)含1 mmol/L 的二硫苏糖醇(DTT),实验组加入His-NOX-1蛋白至终浓度为5 μg/mL,然后加入黄素腺嘌呤二核苷酸(FAD)辅基至终浓度为10 μmol/L,在25℃作用5 min后加入底物牛支原体烟酰胺腺嘌呤二核苷酸(NADH)至终浓度为500 μmol/L,每隔一定时间在OD340处读取数值。同时以不加NADH为对照组,不加His-NOX-1的为空白组,其他反应条件不变。His-NOX-1的比活力计算公式为:

1.8.2 温度对His-NOX-1活性的影响 在pH7.5条件下,分别测定4℃、20℃、25℃、30℃、37℃、42℃、50℃、60℃时的His-NOX-1酶促活性,每个温度重复测3次。
1.8.3 pH对His-NOX-1活性的影响 以25℃为条件,分别测定pH为2.0、4.0、6.0、6.5、7.0、7.5、8.0、8.5、9.0、10.0时的His-NOX-1酶促活性,每个pH值重复测3次。
1.8.4 底物浓度对His-NOX-1活性的影响 利用上述方法在确定最适温度和pH的情况下,分别测定NADH终浓度为50 μmol/L、100 μmol/L、200 μmol/L、300 μmol/L、400 μmol/L、500 μmol/L、1 mmol/L时的His-NOX-1酶促活性,每个浓度重复测3次。
1.9 多克隆抗体的制备及效价的测定将纯化的His-NOX-1与等体积的弗氏完全佐剂混合并充分乳化后免疫新西兰兔,首免剂量为800 μg/只,背部皮下多点注射。首免后2周进行第2次免疫,剂量减半(400 μg/只)并加等体积的弗氏不完全佐剂,之后每隔1周免疫1次,剂量和方法与2免相同。第4次免疫1周后采血,静置后吸取血清,并使用间接ELISA法测定血清抗体效价。
1.10 膜蛋白的提取取200 mL培养至对数生长后期的M.bovis临洮株菌液,8000×g离心10 min后弃掉上清,1×PBS洗涤3次,使用适量PBS悬浮菌体沉淀使之形成原体积150倍浓缩。从中吸取16 μL菌液,加入4 μL的5×上样Buffer制成全菌上样蛋白,在剩余的菌液中依次加入50 μL的蛋白酶抑制剂和终浓度为3% TritonTMX-114后,充分混匀并于4℃静置30 min,37℃水浴10 min。9500×g离心10 min,将上层水相(胞浆蛋白)和下层油相(膜蛋白)分别移入干净的离心管中(弃去水相和油相交界处的液体),分别加入3倍体积的-20℃预冷的乙醇,置-20℃冻存3 h以后,4℃、9500×g离心10 min,弃上清,沉淀于超净台中风干后,分别加入等体积的1×PBS(含8 mol/L尿素)溶解,用于分析His-NOX-1在M.bovis中的分布。
1.11 His-NOX-1在M.bovis内的分布
1.1 1.1 Western blot分析 分别取8 μLM.bovis全菌蛋白、胞浆蛋白、膜蛋白及His-NOX-1蛋白,经SDSPAGE分离后转印至硝酸纤维膜(NC膜);将NC膜置5%脱脂乳中于4℃封闭过夜后,除去封闭液,加入适量用TBST稀释的His-NOX-1抗血清(1∶2000稀释),37℃孵育2 h后用TBST洗涤3次,每次10 min;加入TBST稀释的羊抗兔IgG-HRP(1∶1000稀释),37℃孵育1 h后用TBST洗涤3次,每次10 min,洗涤后用DAB显色试剂盒显色。
1.1 1.2 ELISA检测 取M.bovis胞浆蛋白和膜蛋白溶液各10 μL,分别加入90 μL包被液中,混匀后移入酶标板的不同孔中,37℃静置1 h后置4℃包被过夜。TBST洗涤3次(每次5 min)后,每孔加入200 μL 5%脱脂乳,37℃孵育3 h。TBST洗涤3次(每次5 min),每孔加入100 μL用TBST稀释的His-NOX-1抗血清(稀释比例1∶2000),37℃孵育1 h。TBST洗涤3次(每次5 min)后,每孔加入100 μL TBST稀释的山羊抗兔IgG-HRP(稀释比例1∶8000),37℃孵育1 h。TBST洗涤3次后,每孔加入100 μL TMB显色液,避光显色10~15 min后加入50 μL 2 mol/L H2SO4终止反应,并于450 nm处测定OD值。
2 结果
2.1 NOX-1基因扩增产物的鉴定以粗提的M.bovis基因组DNA为模板,通过PCR扩增获得NOX-1基因的5个片段及NOX-1基因全长,经1%的琼脂糖凝胶电泳得到1条约1365 bp的目的条带(图1),结果与理论预期相符合。
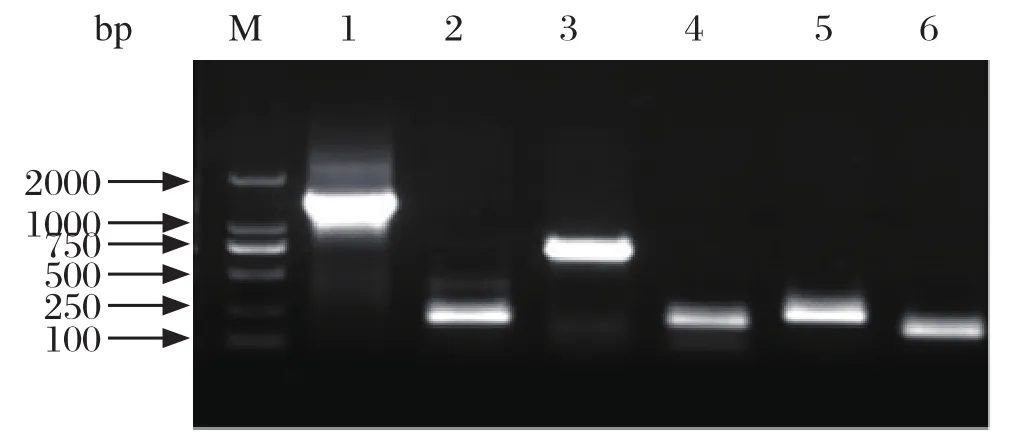
图1 牛支原体临洮株NOX-1基因的overlap PCR扩增Fig. 1 Overlap PCR amplification of M.bovis Lintao strain NOX-1 gene
2.2 NOX-1基因序列分析M.bovis临洮株NOX-1基因序列与目前国内外牛支原体流行菌株的NOX-1基因序列比较分析结果显示,M.bovis临洮株的NOX-1基因与国内外牛支原体流行菌株的NOX-1基因同源性很高,其中与M.bovisCQ-W70株、M.bovisHB0801株、M.bovisHubei-1株、M.bovis08M株、M.bovisHB0801-P115株、M.bovisHB0801-P150株、M.bovisNM2012株相似性高达99.6%,与M.bovisHB0801-P180 株相似性99.5%,与M.bovisPG45株的相似性达98.5%(图2)。

图2 M.bovis NOX-1基因系统进化树Fig.2 Phylogenetic tree on NOX-1 gene of M.bovis
2.3 原核表达载体pET-NOX-1的构建构建的原核表达载体pET-NOX-1用BamHⅠ和XhoⅠ双酶切鉴定,酶切产物大小与理论预期目的片段大小一致(图3)。
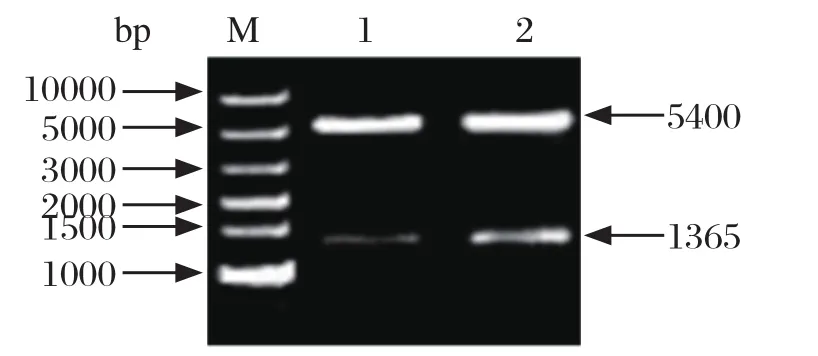
图3 pET-NOX-1的双酶切鉴定Fig. 3 Double endonucleases digestion identification of pET-NOX-1
2.4 His-NOX-1原核表达及表达产物的纯化SDSPAGE检测结果显示,原核表达产物His-NOX-1主要以包涵体的形式表达,大小约为50 kDa,与预期大小一致,且重组蛋白可以上清的形式表达(图 4)。
2.5 His-NOX-1酶促反应活性纯化的重组蛋白His-NOX-1酶促活性测定结果表明,在pH7.5、25℃的条件下,His-NOX-1酶活性随时间的变化如图5所示,因而可得His-NOX-1的比活力为75.9 IU/mg。
2.6 温度和pH对His-NOX-1活性的影响不同温度和pH条件下His-NOX-1酶活性测定结果表明, His-NOX-1的酶促反应最适温度为30℃(图6A),最适pH为7.5,而在pH7.0~pH8.0时His-NOX-1活性较强,当pH低于4.0或高于9.0时酶活性呈显著降低趋势,甚至失活(图6B)。

图4 His-Nox-1原核表达的SDS-PAGE分析Fig.4 SDS-PAGE analysis of His-Nox-1 expression

图5 His-Nox-1重组蛋白酶活性分析Fig. 5 Analysis of His-NOX-1 activity
2.7 His-NOX-1的米氏常数及最大反应速率在不同底物浓度条件下,通过双倒数作图得到两者之间的关系式:y=7.5825x+0.0292(R2=0.9978)(图7),并且求出His-NOX-1的米氏常数:Km(NADH)=256.41 μmol/L,最大反应速率:Vmax=34.25 μmol/(L·min)。
2.8 血清抗体效价测定新西兰白兔4次免疫后进行心脏采血并分离抗血清,通过间接ELISA法测定抗体效价,结果显示,血清抗体效价在1∶38 400以上。
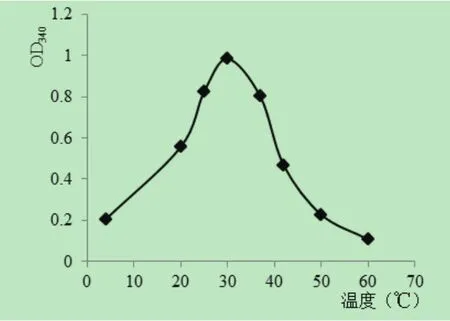
图6 A pH对His-NOX-1活性的影响Fig. 6A Effect of pH on His-NOX-1 activity
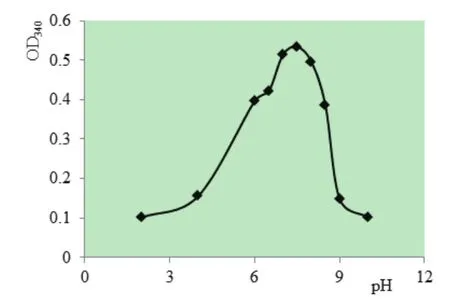
图6 B 温度对His-NOX-1活性的影响Fig. 6B Effect of temperature on His-NOX-1 activity

图7 双倒数曲线图Fig.7 The double reciprocal curve graph
2.9 His-NOX-1在M.bovis内的分布Western blot及ELISA检测结果显示,制备的M.bovisHis-NOX-1兔抗血清能与M.bovis全菌蛋白、纯化的His-NOX-1蛋白、胞浆蛋白及膜蛋白发生特异性结合,在约50 kDa处均有明显的条带(图8),证明M.bovisNOX-1在其细胞膜和细胞浆内均有分布。ELISA检测结果证实,NOX-1在细胞浆内的分布量大于细胞膜(图9)。

图8 His-NOX-1在M.bovis细胞膜和细胞质中含量分布的Western blot分析Fig.8 Western blot analysis of distribution of NOX-1 in the membrane and cytoplasm from M.bovis

图9 NOX-1在M.bovis细胞膜和细胞质中分布的ELISA分析Fig.9 ELISA analysis of distribution of NOX-1 in the membrane and cytoplasm from M.bovis
3 讨论
在1981年,Reinards等[13]就推测出NOX-1型NADH氧化酶的反应机理。对于NOX-1型NADH氧化酶,在电子从NADH传递给H2O2或H2O的过程中会经过O2-中间体。NADH先把电子传递给FAD或FMN的半醌形式(FMNH)再传给O2,形成O2-。O2-再与H+反应生成H2O2。某些NOX-1型NADH氧化酶含有Fe-S簇,电子通过Fe-S簇传给O2,形成O2-。如莱氏阿原体(A. laidlawii)中的NOX-1含有FMN结合域和Fe-S簇,因此通过两种方式都可以得到电子,形成O2-中间体[14]。
包世俊等[15]通过二维电泳技术结合Western blot对滑液支原体WVU1853株免疫相关膜蛋白进行了初步分析,证实了滑液支原体NADH氧化酶为其膜表面的一种免疫原性蛋白质。Zhao等[16]对M.bovisNOX-1研究发现,重组NOX-1对胎牛肺细胞具有粘附作用,是一个潜在的毒力因子,并进一步证实了M.bovisNOX-1的产物为H2O2。本研究通过M.bovisNOX-1基因的克隆、表达、产物酶活性的测定及亚细胞定位,为进一步研究有关NOX-1的生物与功能奠定基础。
本研究参照GenBank中M.bovisHubei株NOX-1基因序列设计特异性引物,利用DNASTAR对目的基因进行初步序列分析,发现序列中存在4个编码色氨酸的密码子TGA,而TGA在大肠杆菌中为终止密码子,可导致该基因在大肠杆菌中进行表达时的终止,这在一定程度上增加了扩增目的基因的难度。因此,本研究设计了5对特异性引物,将序列中的色氨酸密码子TGA突变为同义密码子TGG,先扩增出4个小的基因片段,最后得到总的目的基因。同时,减小了表达载体对NOX-1基因表达、酶活测定的影响。
经过对目的基因表达产物的酶活性进行测定发现,从4℃开始,在不同的温度条件下,随着反应温度的升高,酶促反应逐渐加快,当温度达到30℃时,酶促反应速率达到了最大,之后随温度的升高酶促反应逐渐降低。可能有两方面的原因:一是底物或者辅基的结构发生了改变,二是温度过高导致底物发生了一定程度的降解。His-NOX-1在pH 7.0~8.0之间酶促反应较高,在pH为7.5处出现最高峰,判定pH7.5为最适pH,这一结果与大多数的NADH氧化酶相一致。
Western blot及间接ELISA检测了M.bovis临洮株His-NOX-1的亚细胞定位,结果显示,M.bovisHis-NOX-1在细胞膜和细胞浆中均有分布,且细胞膜的分布量小于细胞浆,这将为M.bovis膜蛋白的研究提供一定的依据。
