硬化地表对不同树种土壤微生物群落结构和功能的影响
2019-07-05于伟伟陈媛媛汪旭明王效科
于伟伟,陈媛媛,汪旭明,王效科,3,*
1 中国科学院生态环境研究中心,城市与区域生态国家重点实验室,北京 100085 2 中国科学院大学,北京 100049 3 北京城市生态系统研究站,北京 100085
随着城市化的快速发展,城市人口迅速增加,城市用地迅速扩张[1]。硬化地表是城市化的重要标志[2]。中国是世界上硬化地表面积最大的国家,硬化地表几乎覆盖了城市的63%[3]。城市硬化地表主要分为透水硬化(如透水路面等)和不透水硬化(如混凝土建筑、柏油路面等)两种形式[4]。硬化地表为城市提供干净整洁的环境和便利高效的生活生产设施,同时也产生了一系列负面影响,如减少雨水下渗形成地表径流[5],增加地表温度[6],改变土壤和植物的蒸发[7],阻止土气交换[8]等。为了缓解硬化地表给城市带来的不利影响和城市绿地面积不足,城市绿化树木已经栽种到硬化地表上[9],然而硬化地表会抑制树木的生长[7,10],降低植物根茎生物量[11]。不同类型硬化地表对树木生长的影响存在差异,Morgenroth认为透水硬化地表上植物生长优于不透水硬化地表[12-13],Volder等[14]的研究结果表明两种类型硬化地表对树种生长影响无显著差异。Montague和Kjelgren通过研究4个树种在6种不同程度硬化地表的生长状况得出结论,认为不同树种对硬化地表的响应因树种和硬化类型而异[15]。
土壤微生物是生物地球化学循环的驱动者,是生态系统功能和服务的重要支撑者。硬化地表从多方面影响土壤性质和功能,如硬化地表增加土壤的紧实度[16]、改变土壤理化特性[17-18]、提高土壤温度、降低土壤含水量[19]、引起土壤碳流失[20]、阻碍凋落物进入土壤、造成土壤有机碳及微生物量碳、氮含量降低,并导致土壤微生物活性及功能下降[17,21-22]。与不透水硬化地表相比,透水硬化地表能在一定程度上缓解硬化地表对土壤微生物的消极影响[22]。Francini等[23]发现不同地表植被及树种对土壤微生物的影响不同。不同树种的凋落物和根系分泌物存在差异,这将会导致硬化地表下不同树木的土壤微生物的种类及数量存在差异。已有研究多集中在对硬化地表下树木生长和土壤微生物量及酶活性的影响上,与土壤生态学过程尤其相关的微生物群落的响应及其反馈研究较少,不同树种下土壤微生物对硬化地表的响应并不清楚,致使硬化地表植树对城市生态系统的功能和服务的影响认识不足。磷脂脂肪酸(PLFA)是所有活细胞的基本组分,具有广泛的结构多样性,常被用作微生物群落的分子标记[24-25],被广泛应用于土壤微生物群落结构和功能的研究中。BIOLOG微孔板是一种以碳源利用为基础的定量分析方法,广泛应用于评价土壤微生物群落的功能多样性[26]。PLFA和BIOLOG分析方法结合可以很大程度地提高结果的可靠性。
本研究原位模拟透水和不透水两种类型硬化地表,并设置自然地表为对照,选取5年树龄的常绿针叶树油松(Pinustabulaeformis)和落叶阔叶树白蜡(Fraxinuschinensis)中0—20 cm的表层土,采用氯仿熏蒸浸提法、磷脂脂肪酸法(PLFA)及BIOLOG培养法,分析评价土壤微生物量、群落结构和功能,探讨不同类型硬化地表对土壤微生物群落的影响及不同树种下土壤微生物的响应,为科学全面评价城市绿地生态系统功能和服务提供数据支撑,为硬化地表树木选育和管理提供科学依据。
1 材料与方法
1.1 试验地概况
试验地设在北京市昌平区马池口镇丈头村种子管理站(40°12′N,116°08′E),属暖温带大陆性季风气候,四季分明,年平均降水量550.3 mm,集中于夏季的6—8月份,年均气温12.1℃。土壤类型为潮土,质地为砂壤。试验硬化处理土壤理化性状见表1(方法参见土壤农化分析[27])。
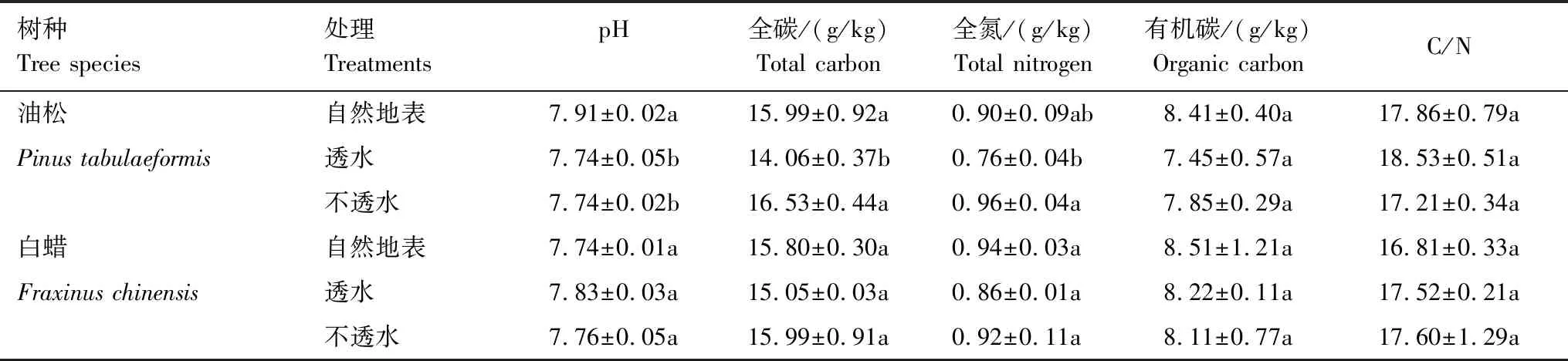
表1 不同硬化处理下土壤理化性状
同列不同字母表示处理间差异显著(P<0.05)
1.2 试验设计
试验地于2012年4月12日铺设,设置透水地表、不透水地表和自然地表三个硬化处理,以自然地表作为对照,渗透率超过0.4 mm/s的透水砖铺设地面作为透水地表,渗透率几乎为0的不透水砖铺设地面作为不透水地表。每个硬化处理3个重复,分别种植白蜡和油松,每个重复小区种植树木23棵,分5行,行距和株距均为1 m。硬化地表上树根周围留有20 cm×20 cm的方形树坑。试验所用砖的大小为20 cm×10 cm×6 cm(长×宽×高)。供试油松和白蜡选用1年生幼苗,于2012年4月16日移栽。
1.3 土壤样品的采集
于2015年9月9日用直径2.5 cm的土钻采集0—20 cm土层的土壤样品。每个小区按“Z”形随机采用5点混样的方法取距离树干0.5 m左右的土样,硬化地表撬开砖,取完土后将砖复原,不透水硬化处理用水泥密封砖缝。样品带回实验室过2 mm筛后分3份,一份放在-80℃冰箱用于PLFA测定,一份放在4℃冰箱用于微生物碳氮和BIOLOG测定,剩余土样风干用于理化性状的测定。
1.4 分析方法
微生物量碳、氮的测定采用氯仿熏蒸-浸提-非色散红外吸收法:称取两份鲜土(25g),一份用氯仿熏蒸24 h,另一份未熏蒸;用100 mL 0.5 mol/L的K2SO4溶液萃取,在摇床上震荡30 min,用Whatman滤纸过滤;滤液用总有机碳(氮)分析仪(Elementar, Liqui TOC II, Germany)测定[28]。
土壤微生物量碳(Cmic)和氮(Nmic)计算:
Cmic=CF-CUF/K
(1)
Nmic=NF-NUF/K
(2)
式中,CF和NF分别为熏蒸土壤浸提液的总碳和氮含量,CUF和NUF分别为未熏蒸土壤浸提液中的总碳和氮含量,K为熏蒸提取法的转换系数,取值0.45。
BIOLOG测定采用BIOLOG®-ECO培养板培养:称取10 g鲜土,加入90 mL无菌NaCl溶液(0.85%)在摇床上震荡30 min,在超净工作台中用无菌NaCl溶液(0.85%)稀释到10-3,用8通道100 μL加样器将稀释液接种到BIOLOG微孔板上。将接种好的培养板放在25℃恒温培养箱培养7 d,每24 h在590 nm波长下读取培养板的吸光值。试验采用72 h的数据对微生物碳源利用进行分析[26]。
每孔颜色平均变化率(AWCD)计算公式为:
AWCD=∑(C-R)/n
(3)
式中,C为每个有培养基孔的光密度值,R为对照孔的光密度值,n为培养基孔数,ECO板n值为31。
培养基的丰富度(richness)指数指被利用的碳源总数目,多样性(diversity)指数采用Shannon-Weinner指数(H′):
H′=∑(Pi×logPi)
(4)
Pi=(C-R)/∑(C-R)
(5)
PLFA的测定:取4 g冷冻干燥的土样,用氯仿、甲醇和磷酸缓冲液(1∶2∶0.8,V/V/V)振荡提取,取氯仿相,N2吹干,氯仿溶解过硅胶柱(100—200目),以甲醇洗涤,N2吹干洗涤液,用甲醇甲苯溶液(1∶1,V/V)溶解后甲酯化[29],加1 mL含内标19:0的正己烷溶液,上GC-MS(Agilent 6850 GC-MS)测定。使用细菌脂肪酸标准和MIDI峰鉴别软件(MIDI, Inc., Newark, DE)确定峰,根据内标浓度确定不同结构峰面积浓度[30]。PLFA含量用nmol/g表示。其中,i14:0、14:0、15:0、16:0、17:0、18:0、14:1w5c、a15:0、i15:0、i15:1w6c、a16:0、i16:0、16:1w7c、16:1w9c、16:3 w6c、a17:0、17:0cy、i17:0、a17:1w9c、i17:1w9c、10Me 17:1、10Me 18:1、17:1w8c、i18:0、18:1w5c、19:0cy表示细菌[30- 33];16:1 w5c、18:1 w7c、18:1 w9c、18:2 w6c、18:3 w6c表示真菌,16:1 w5c表示丛枝菌根真菌(AMF),10Me 16:0、10Me 17:0、10Me 18:0、10Me 19:0、10Me 20:0表示放线菌[31,33- 34];真菌/细菌(F/B),环丙基脂肪酸/前体结构 [(cy/pre),(cy17:0+cy19:0)/(16:1 w7+18:1 w7)],饱和脂肪酸/单不饱和脂肪酸[(sat/mono), (14:0+15:0+16:0+17:0+18:0+20:0)/(16:1 w9c+16:1 w7c+16:1 w5c+17:1 w8c+18:1 w9c+18:1 w7c+18:1 w5c+19:1 w11c+ 20:1 w9c)]表示环境压力[35- 36]。计算细菌、真菌、AMF和放线菌含量以及F/B、cy/pre、sat/mono的值。
1.5 数据处理
运用SPSS 22.0对数据进行统计分析。不同硬化处理间土壤微生物量碳与氮、多样性指数、丰富度指数及对6类碳源利用的差异采用One-Way ANOVA进行显著性分析。BIOLOG实验采用72 h土壤微生物的吸光值用PCA(主成分分析)进行碳源利用类型差异的分析。对PLFA单体的含量进行PCA分析,分析不同类型硬化地表下土壤微生物群落结构的差异。用Origin Pro 2016制图。
2 结果与分析
2.1 土壤微生物量碳氮
硬化地表显著降低土壤微生物碳氮含量(图1)。与自然地表(Control, C)相比,透水硬化地表(Pervious pavement, P)和不透水硬化地表(Impervious pavement, IP)使油松土壤微生物碳的含量分别显著降低74%和83%(P<0.05),P和IP使白蜡土壤微生物碳的含量分别显著降低72%和69%(P<0.05);油松土壤微生物量氮在P和IP下分别显著降低67%和80%(P<0.05),白蜡土壤微生物量氮在P和IP下均显著降低64%(P<0.05)。土壤微生物量碳氮在不同树种间也存在差异,但是树种和硬化处理间没有交互作用。
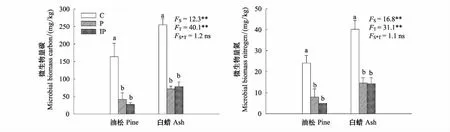
图1 土壤微生物量碳氮的变化Fig.1 Changes of soil microbial carbon and nitrogenP:透水硬化地表Pervious pavement;IP:不透水硬化地表Impervious pavement;C:自然地表Control;F:F值 F-Value;S:树种Tree species;T:处理Treatments; *:*<0.05, **<0.01;ns:不显著 no significant difference
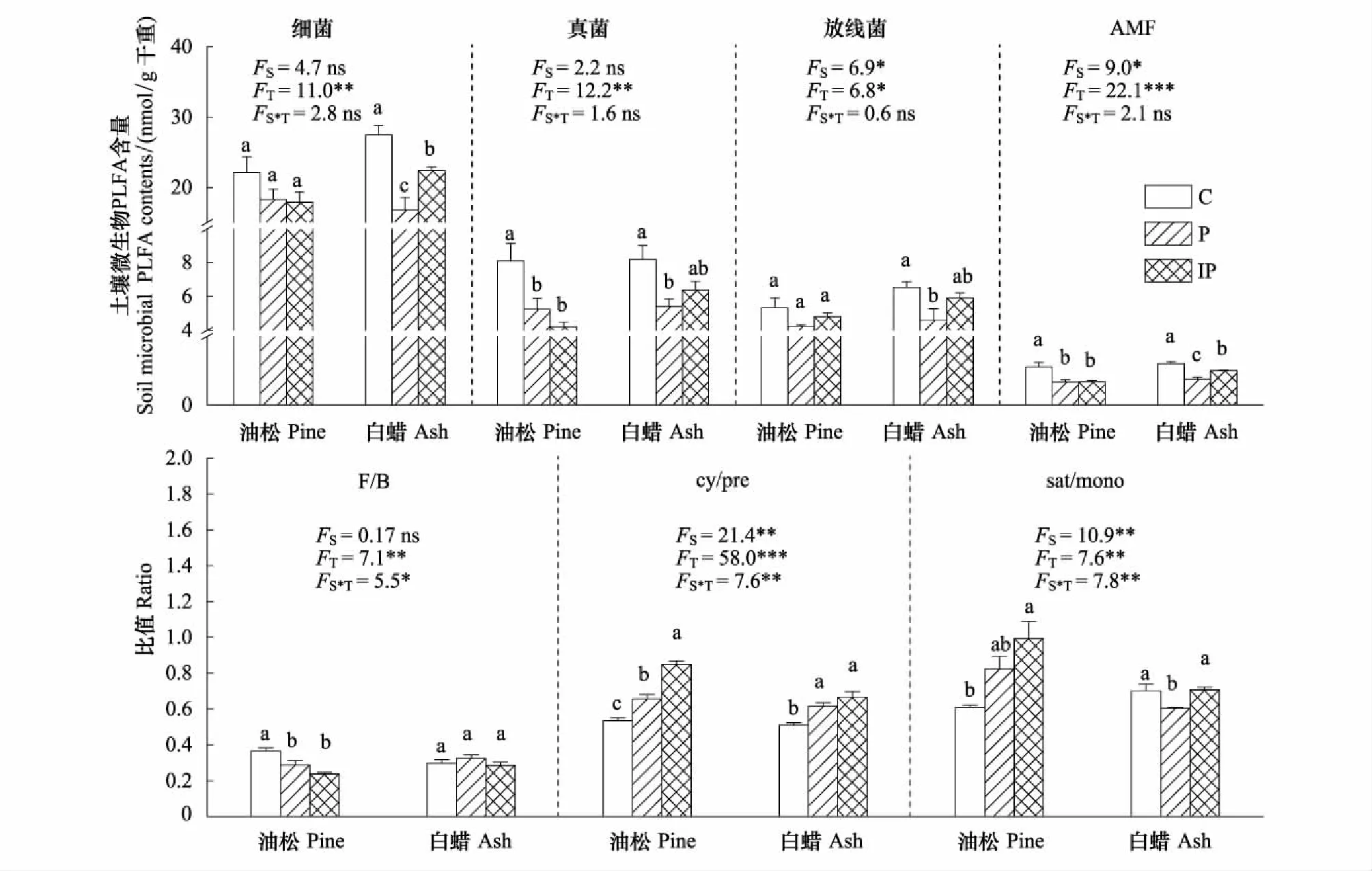
图2 土壤微生物PLFA各组分和比值Fig.2 Soil microbial group PLFAs contents and ratiosAMF:丛枝菌根真菌 arbuscular mycorrhizal fungi;F/B:真菌/细菌 fungi/bacteria;cy/pre:环丙基脂肪酸/前体结构 cyclopropyl fatty acid/monoenoic precursors;sat/mono:一般饱和脂肪酸/单不饱和脂肪酸 normal saturated fatty acid/monounsaturated fatty acid
2.2 土壤微生物群落结构
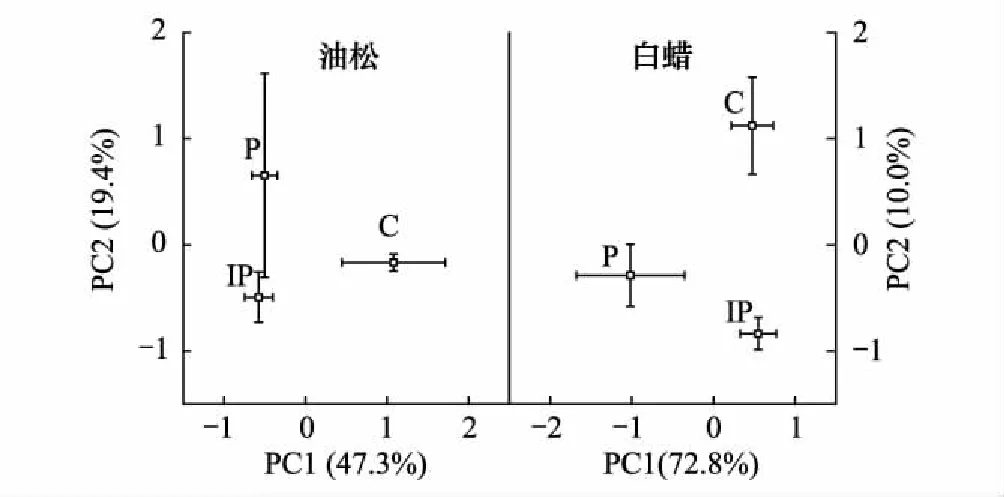
图3 微生物群落结构主成分分析 Fig.3 Principal component analysis of PLFA data distinguished under pine and ash with different pavements
硬化地表对土壤微生物群落结构的影响显著(图2)。白蜡树下土壤细菌,在透水硬化地表(P)和不透水硬化地表(IP)下,比自然地表(C)分别显著降低39%和18%(P<0.05),在P下比在IP下显著降低25%(P<0.05)。油松树下土壤真菌,在P和IP下比C分别显著降低35%和48%(P<0.05),白蜡树下土壤真菌在P下比C显著降低34%(P<0.05)。白蜡树下土壤放线菌在P下比C显著降低30%(P<0.05)。油松与白蜡树下土壤AMF在P和IP下比C分别显著降低40%和39%(P<0.05)与38%和16%(P<0.05),白蜡树下土壤AMF在P下比IP显著降低26%(P<0.05)。油松树下土壤F/B在P和IP下比C分别显著降低22%和35%(P<0.05),油松与白蜡树下土壤微生物cy/pre在P和IP下比C显著升高23%和59%(P<0.05)与21%和31%(P<0.05)。油松树下土壤微生物cy/pre在IP下比在P下显著升高19%(P<0.05)。与C相比,IP使油松土壤sat/mono显著升高63%(P<0.05),P使白蜡土壤sat/mono显著降低14%(P<0.05)。树种的差异仅对土壤放线菌、丛枝菌根真菌(AMF)及环境压力指标F/B、cy/pre和sat/mono有显著影响。树种和硬化程度的交互作用对土壤微生物F/B、cy/pre和sat/mono有显著影响。
主成分分析结果表明不同硬化地表类型下,土壤微生物群落结构具有显著性差异(图3)。油松土壤微生物群落结构两个主成分解释了总变量的66.7%(PC1=47.3%,PC2=19.4%),白蜡土壤微生物群落结构两个主成分解释了总变量的82.8%(PC1=72.8%,PC2=10.0%)。油松土壤微生物群落结构PC1(F=6,P<0.05)能将3个硬化处理显著区分开,与油松土壤微生物群落中与主成分PC1显著相关的主要为真菌特征脂肪酸16:1 w5c、18:1 w7c、18:1 w9c、18:2 w6c、18:3 w6c和放线菌特征脂肪酸10Me 16:0、10Me 17:0、10Me 18:0(表2),白蜡土壤微生物群落结构PC2(F=10,P<0.05)能将3个硬化处理显著区分开,白蜡土壤微生物群落中与PC2显著相关的均为细菌特征脂肪酸(表2)。
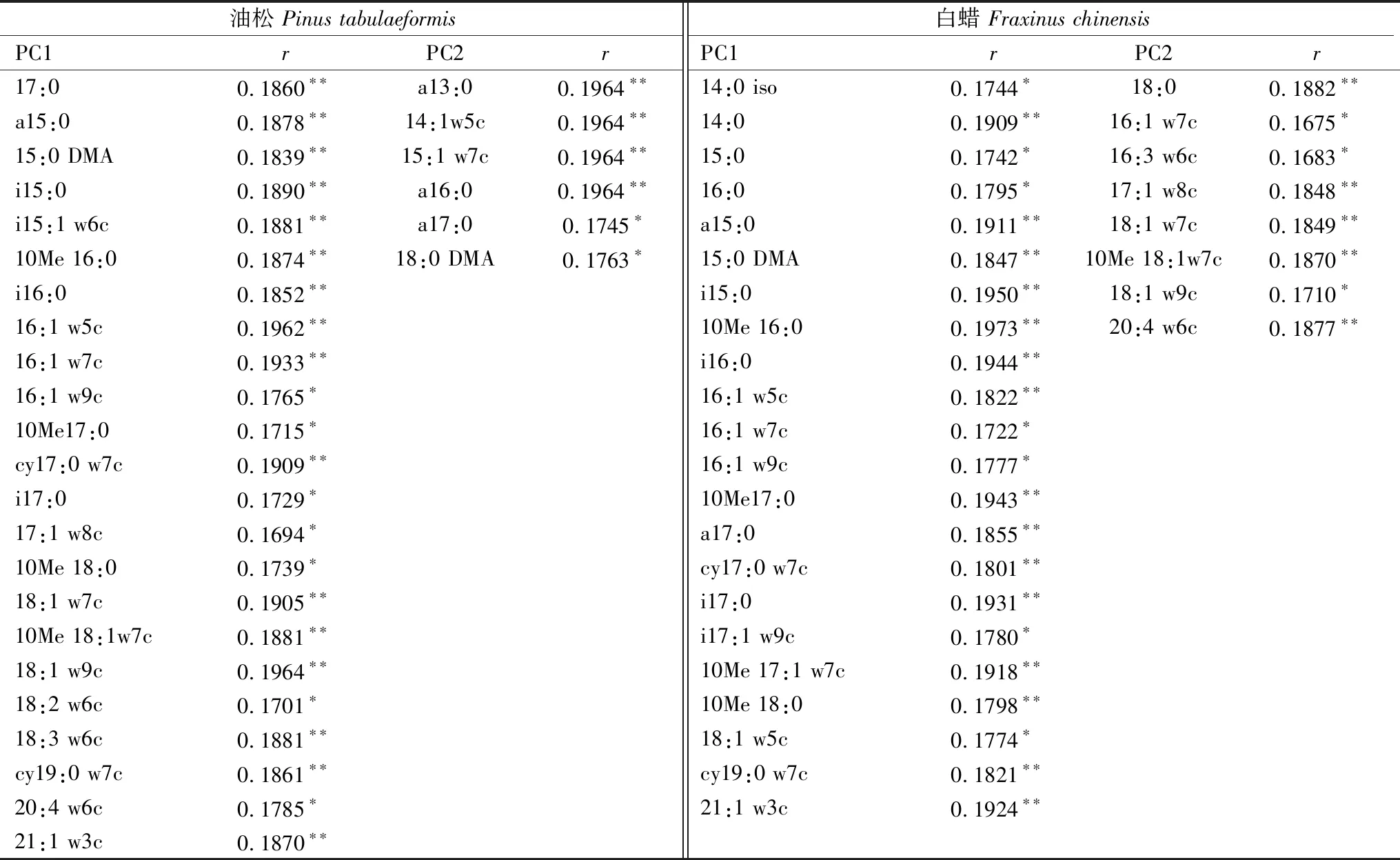
表2 土壤微生物中与主成分显著相关的PLFA单体
**P<0.01, *P<0.05
2.3 土壤微生物群落功能
硬化地表限制土壤微生物群落功能(图4)。油松和白蜡土壤微生物平均每孔变色率在不透水硬化地表下分别显著降低32%和68%(P<0.05),两种树种间存在显著差异,树种和硬化处理间存在交互作用。油松和白蜡在P和IP下土壤微生物群落对糖类、氨基酸类、羧酸类三类主要碳源的利用超过70%。油松和白蜡土壤微生物在IP下对这三类主要碳源的利用比率发生变化,IP使油松土壤微生物对糖类的利用比率降低,对羧酸类的利用比率升高;IP使白蜡土壤微生物对糖类的利用比率升高,对羧酸类的利用比率降低。
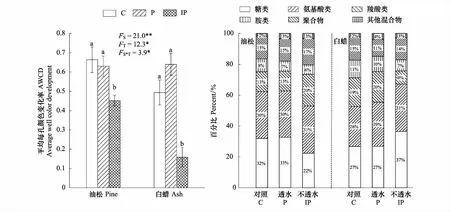
图4 BIOLOG培养72 h平均每孔颜色变化率和土壤微生物对不同碳源利用百分比Fig.4 Average well color development (AWCD) at 72 h during experiment and the effect of pavements on utilization of main carbon sources
硬化地表对土壤微生物群落功能的影响表现在对碳源的利用上(表3)。IP显著降低油松土壤微生物对糖类、氨基酸类、胺类、聚合物的利用,降幅分别为52%、31%、50%和20%(P<0.05),IP使白蜡土壤微生物对糖类、氨基酸类、羧酸类、胺类和聚合物的利用分别显著降低56%、62%、85%、80%和70%(P<0.05),P使白蜡土壤微生物对氨基酸类的利用显著升高43%(P<0.05)。两个树种土壤微生物群落功能存在差异,油松土壤微生物对糖类、氨基酸、聚合物的利用显著高于白蜡(表3)。树种和硬化处理的交互作用显著影响土壤微生物对羧酸类、胺类及聚合物的利用(表3)。
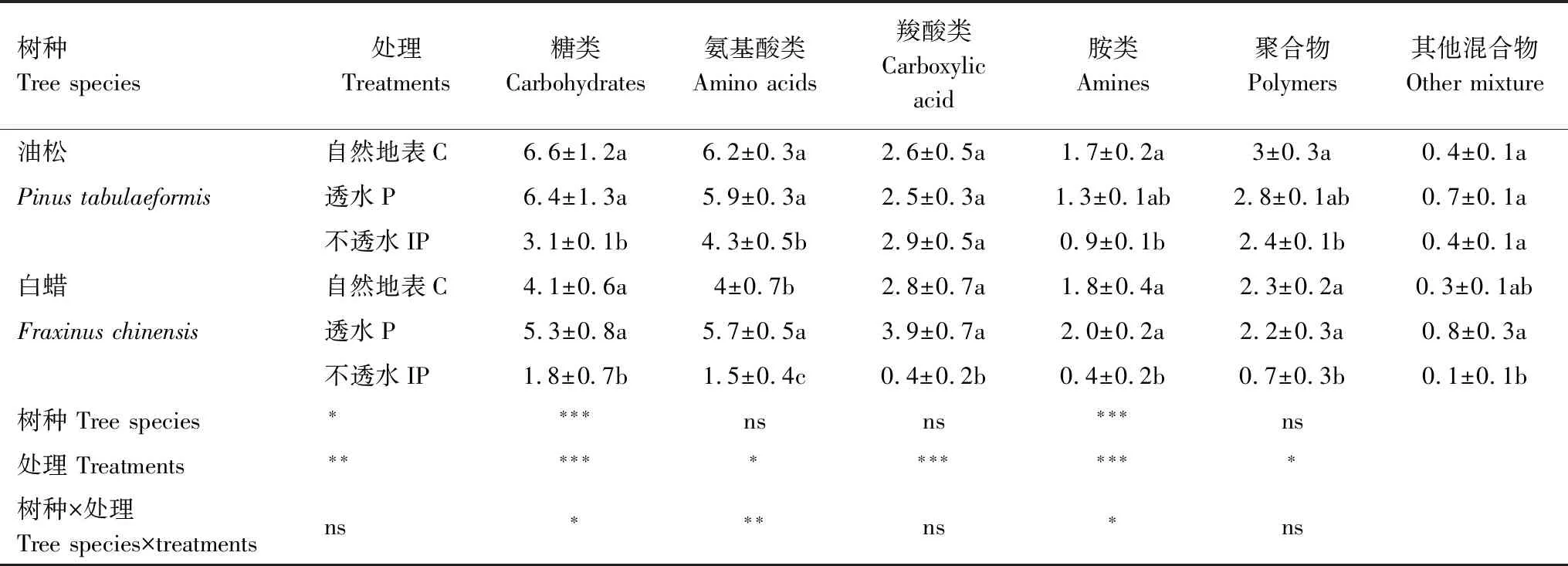
表3 BIOLOG培养72 h土壤微生物对六类碳源的利用
同列不同字母代表在5%水平上LSD多重比较差异显著; *P<0.05,**P<0.01,***P<0.001
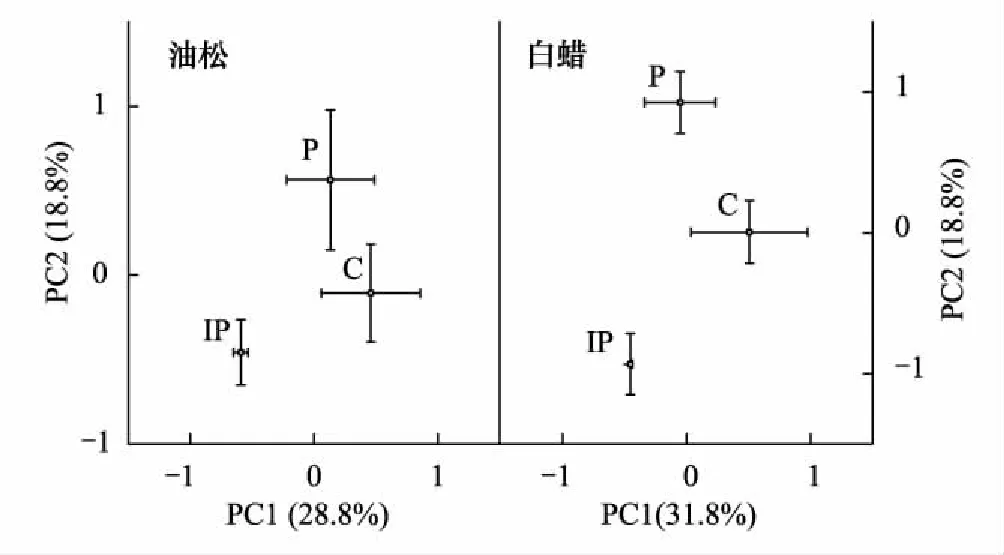
图5 土壤微生物碳源利用主成分分析 Fig.5 Principal component analysis of carbon source utilization pattern distinguished under pine and ash with different pavements
主成分分析表明硬化地表改变了不同树种下土壤微生物群落对单一碳源的利用(图5)。油松土壤微生物碳源利用的两个主成分解释了总变量的40.6%(PC1=28.8%,PC2=11.8%),白蜡土壤微生物碳源利用的两个主成分解释了总变量的50.6%(PC1=31.8%,PC2=18.8%)。白蜡土壤微生物碳源利用的PC2(F=18,P<0.001)能将3个硬化处理显著区分开,表明硬化地表改变了白蜡土壤微生物单一碳源利用。
不透水硬化地表降低土壤微生物群落功能丰富度和多样性指数(图6)。不透水硬化地表使油松和白蜡土壤微生物丰富度分别显著降低27%和70%(P<0.05),不透水硬化显著降低油松和白蜡土壤微生物多样性指数,降幅达10%和37%(P<0.05)。硬化处理和树种对土壤微生物丰富度和多样性的影响存在交互作用。
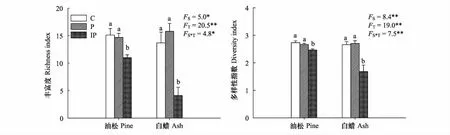
图6 土壤微生物群落丰富度和多样性指数Fig.6 Richness and diversity of soil for different pavements
3 讨论
本研究发现硬化地表显著影响土壤微生物群落结构和功能:(1)硬化地表下土壤微生物碳、氮的含量均显著降低(P<0.05),这与Wei等[21]的研究结果一致,Piotrowska和Charzyński通过现场观测的方法也发现硬化地表降低土壤微生物量碳、氮[22]。可能由于硬化地表将土壤“保护”起来[4],阻碍凋落物进入土壤引起土壤中碳及氮素含量降低,从而造成土壤微生物量碳氮的降低。(2)硬化地表下土壤微生物细菌、真菌、AMF数量均显著降低,这可能由于硬化地表增加了土壤紧实度和土壤温度,降低了土壤含水量[16,19],改变了土壤理化特性[17- 18],从而影响土壤微生物的生长。细菌、真菌数量的减少,主要与硬化地表减少了进入土壤的有机物数量有关。土壤真菌数量降低会造成细菌数量的减少,因为很多细菌依赖真菌分解物生存,同时,真菌数量的降低也会增加N流失[37]。(3)硬化地表下土壤微生物cy/pre的比值显著升高。可能是由于硬化地表降低土壤水分[5]、增加地表温度[6]、阻碍土气交换[8]等,从而导致硬化地表下土壤微生物环境压力增大。城市硬化地表阻碍土壤与环境之间的物质能量交换,降低土壤总氮、微生物量碳、氮和微生物活性及微生物群落功能多样性[17,20- 21]。
本研究发现不同类型硬化地表对土壤微生物群落结构和功能的影响不同。表现在:(1)与自然地表(C)相比,不透水硬化地表(IP)下土壤微生物平均每孔变色率显著降低(图4),土壤微生物对糖类、氨基酸类、羧酸类、胺类、聚合物的利用显著降低(表2),土壤微生物功能多样性和丰富度指数显著降低(图6),而透水硬化地表(P)下这些指标未发生显著改变。可能由于透水硬化地表有利于雨水下渗,增加地表通透性,有利于大气和土壤之间的气体交换,改善了土壤理化性状[38]。Piotrowska等[22]研究发现不透水硬化地表下土壤微生物荧光素二乙酸酯水解酶和硝酸还原酶活性比透水硬化地表下低,Morgenroth等[12-13]通过研究也发现不透水硬化地表下植物的生长比透水硬化地表下差,进入土壤有机物将减少。(2)硬化地表下土壤微生物群落的变化主要体现在对环境压力的响应上,如sat/mono、cy/pre值升高[39-40]。与C相比,IP下土壤微生物磷脂脂肪酸F/B比值显著降低,sat/mono比值显著升高,P下无显著变化;P和IP下土壤微生物磷脂脂肪酸cy/pre比值都显著高于C,IP下土壤微生物cy/pre比值显著高于P。sat/mono和cy/pre这些压力指标一般反应土壤微生物受到土壤温度、水分、养分以及物理胁迫的程度。与P相比,IP下雨水几乎无法下渗,凋落物也无法回土,导致土壤微生物的环境胁迫更大。可见,硬化地表不利于土壤微生物的生长,不透水硬化地表下土壤微生物受到的影响更大。
本研究以硬化地表下的油松和白蜡林间土为研究对象,研究了不同树种土壤微生物对不同类型硬化地表的响应。对两个树种在两种类型硬化地表下土壤微生物PLFA结构做主成分分析(图3),油松PC1能将3个硬化处理显著区分开,与油松PC1显著相关的PLFA结构主要是真菌和放线菌;白蜡PC2能将3个硬化处理显著区分开,与白蜡PC2显著相关的PLFA结构都是细菌,表明硬化地表改变了两个树种土壤微生物菌群的主导形式。油松和白蜡分别属于常绿树和落叶树,Polyakova和 Billor研究发现不同树种凋落物不同[41],凋落物与土壤微生物群落结构和功能变化密不可分,可能由于硬化地表阻隔凋落物进入土壤改变了土壤微生物群落组成及数量造成菌群主导形式的变化。本研究发现油松土壤真菌、AMF的数量及F/B值在P和IP下都显著降低,表现为C>P, IP,表明硬化地表使油松土壤微生物群落向细菌主导型转化;白蜡土壤细菌和AMF在P和IP下均显著降低,表现为C>IP>P,真菌和放线菌表现为C>P,表明透水硬化对白蜡土壤微生物的不利影响更大。Francini等[23]发现落叶树和常绿树对土壤微生物群落结构的影响不同,落叶树白蜡由于产生易分解的富含氮的凋落物,其土壤微生物一般以细菌为主导,而常绿树油松土壤微生物一般以真菌为主导[42],油松土壤微生物向细菌主导型的转化也意味着油松土壤微生物群落功能的衰减。油松土壤压力指标cy/pre表现为IP>P>C,sat/mono表现为IP>C,表明不透水硬化地表对油松土壤造成的环境压力更大, Xu等[43]发现土壤pH值是城市土壤微生物群落变化的一个主要驱动因子,本研究中油松在硬化地表下土壤pH值降低(表1)可能是土壤环境压力增大的原因;Montague等[15]发现不同类型硬化地表温度及表层土壤温度不同,而种植不同树种也会改变土壤温度及水分含量,土壤温度和水分的变化也可能是土壤环境压力变化的原因,同时,土壤环境压力的变化也会造成微生物结构和功能的变化。土壤微生物对单一碳源的利用做主成分分析(图5),白蜡PC2能将3个硬化处理显著区分开,说明硬化地表对改变了白蜡土壤微生物对碳源的利用导致土壤微生物功能的变化,本研究发现油松土壤微生物对糖类、氨基酸类和聚合物的利用比白蜡高,可能与分泌物数量有关,Polyakova和Billor认为常绿树的根系分泌物较落叶树高[41]。
4 结论
硬化地表降低土壤微生物数量、丰富度及多样性指数,增加土壤微生物环境胁迫,改变土壤微生物群落结构,削弱土壤微生物群落功能,透水硬化对土壤微生物的负效应有一定的减缓作用,不同树种对硬化地表的响应存在差异。不同树种和硬化地表类型对土壤微生物的影响存在交互作用。硬化地表是城市环境的主要特征,城市绿化树木也是城市必不可少的生态因子,二者在城市生态系统中的功能是复杂的,对土壤微生物的影响非常重要,但城市环境中影响土壤微生物的因素又是多样的。本研究采用原位模拟的试验方法研究5年生绿化树木林间土壤微生物对硬化地表的响应,考虑到城市硬化地表的长期性,本结果也具有一定的局限性,但总体上能说明硬化地表对土壤微生物的影响趋势。对于城市硬化地表对土壤微生物群落的影响机制以及不同树种土壤微生物群落对硬化地表的响应机理,还需要结合其他环境因子以及实地观测结果作进一步验证。
