脂氧素A4改善肺微血管内皮细胞炎症损伤的体外实验研究
2019-07-04陈云志连泽来余华军孔鸿儒戴胜杰黄超豪孙洪伟
陈云志,连泽来,余华军,孔鸿儒,戴胜杰,黄超豪,孙洪伟
(1.温州医科大学附属第一医院 肝胆胰外科,浙江 温州 325000;2.温州医科大学 药学一班,浙江 温州325035)
脂氧素A4(lipoxin A4,LXA4)是机体自身在炎症后期产生的一种内源性脂质抗炎介质,能促进炎症反应的及时消退,其最突出的优点是在炎症的病理过程中发挥作用且不会干扰机体正常的生理活动,无糖皮质激素、非甾体抗炎药和免疫抑制剂等传统抗炎药的多种副作用[1-2]。因此,LXA4代表着全新的“促进炎症消退”的炎症治疗策略,可能有很好的临床应用前景[3]。我们前期的动物实验证实,LXA4对重症急性胰腺炎(sever acute pancreatitis,SAP)继发的急性肺损伤(acute lung injury,ALI)有治疗作用,但其具体的作用机制尚不十分清楚。肺微血管内皮细胞(pulmonary microvascular endothelial cells,PMVECs)是肺的主要功能细胞,它介于血液和组织之间,在SAP继发ALI的过程中发挥着至关重要的作用[4-5]。因此我们推测,LXA4对SAP继发ALI的治疗作用可能是通过改善PMVECs的炎症损伤来实现的。本研究就LXA4对因炎症受损的PMVECs是否有治疗作用进行探讨,现报道如下。
1 材料和方法
1.1 主要试剂材料
PMVECs(广州Focusbio生物科技有限公司);RPMI 1640(美国Gibco公司);胰蛋白酶、DMSO、MTT(Sigma公司);胎牛血清(美国HyClone公司);LXA4(美国Cayman公司);TNF-α(英国PEPROTECH公司);ReverTra Ace® qPCR RT Kit、SYBR® Green Realtime PCR Master Mix(日本TOYOBO公司);GAPDH、IL-1β、VCAM-1、NF-κB p65引物序列(上海Invitrogen生物有限公司)。
1.2 主要仪器
5% CO2恒温培养箱;细胞超净工作台;倒置相差显微镜;7500型实时荧光定量PCR仪及分析软件;
1.3 PMVECs的培养
用RPMI 1640培养基(含10% HyClone胎牛血清,100 U/mL青霉素,100 μg/mL链霉素),在37 ℃、5%CO2条件下进行培养,瓶底被细胞铺满时,用0.25%胰酶消化,传代培养。取对数生长期细胞用于实验。
1.4 分阶段实验及分组
第一阶段:分为空白对照组(完全培养基培养)和TNF-α组(分别以5、10、20 ng/mL处理24 h),采用MTT法检测空白对照组及不同浓度TNF-α组对PMVECs存活率及单层通透性的影响。第二阶段:分为模型组(20 ng/mL TNF-α处理24 h)和治疗组(1、10、100 μg/L LXA4干预24 h),检测各项指标。
1.5 指标检测
(1)PMVECs的鉴定及形态观察:培养的PMVECs采用免疫荧光法检测细胞CD31的表达,以此来鉴定不同组PMVECs在倒置显微镜下观察生长情况及形态改变。(2)各组PMVECs细胞存活率检测:采用MTT法。(3)各组PMVECs单层通透性的测定:用针头式滤器检测TNF-α损伤前后及LXA4干预后PMVECs单层通透性的变化。(4)各组PMVECs IL-1β、VCAM-1、NF-κB p65 mRNA的表达情况:细胞完成相应处理后,用Trizol提取各组细胞总RNA,按照逆转录试剂盒操作说明分两步完成逆转录反应:第一步,RNA在65 ℃进行5 min后,立即冰上冷却;第二步,反应液组成:RT Enzyme Mix 0.5 µL,Primer Mix 0.5 µL,5×RT Buffer 2 µL,Nuclease-free Water 6 µL,RNA 1 µL;反应条件:37 ℃、15 min逆转录反应→98 ℃、5 min酶失活反应;进行实时荧光定量PCR(引物设计和合成由上海Invitrogen生物有限公司完成,具体见表1)。

表1 基因引物序列
1.6 统计学分析
2 结果
2.1 PMVECs干预前后形态对比
首先通过免疫荧光CD31鉴定PMVECs,正常内皮细胞单层呈“铺路石样”外观,CD31抗体免疫荧光染色后呈强阳性(如图1A所示)。空白对照组细胞生长状态良好,贴壁牢固,细胞间连接紧密,多角形或长条梭形,大小均匀,边界清楚,呈单层“铺路石”样生长排列(如图1B所示)。TNF-α处理后,细胞收缩、变圆,胞体变小,细胞间隙增宽,胞核模糊,细胞边界变模糊,有细胞脱落的现象(如图1C所示)。而LXA4干预后,与TNF-α处理组比较,细胞收缩情况有所好转,呈短或长梭形改变,细胞边界有向正常组变化的趋势,细胞间紧密,细胞脱落较少(如图1D所示)。

图1 PMVECs干预前后形态对比
2.2 PMVECs经TNF-α干预前后细胞存活率的改变
经不同浓度TNF-α干预后,PMVECs存活率明显下降,且该副效应随TNF-α浓度递增逐渐加强,如表2所示。
表2 不同浓度TNF-α干预PMVECs前后细胞存活率的改变(±s,n=6)

表2 不同浓度TNF-α干预PMVECs前后细胞存活率的改变(±s,n=6)
与空白对照组比较,**P<0.01
分组 存活率(%) P值空白对照组 100±5.42 -5 ng/mL TNF-α组 76.39±9.30** 0.0003 10 ng/mL TNF-α组 61.87±11.67** <0.0001 20 ng/mL TNF-α组 49.54±12.64** <0.0001
2.3 不同浓度LXA4对TNF-α干预后PMVECs存活率的影响
TNF-α干预后的PMVECs,经不同浓度LXA4处理,其存活率明显改善,且该正效应随着LXA4浓度的递增逐渐加强,如表3所示。
2.4 TNF-α对PMVECs单层通透性的影响及LXA4处理后的改善作用
表3 LXA4对炎症损伤的PMVECs存活率的影响(±s,n=6)

表3 LXA4对炎症损伤的PMVECs存活率的影响(±s,n=6)
与TNF-α组比较,**P<0.01
组别 存活率(%) P值T N F-α组(2 0 n g/m L,下同) 5 0.7 3±1 4.4 3 -T N F-α+1 μ g/L L X A 4组 6 1.2 8±1 6.6 6 0.2 6 8 4 T N F-α+1 0 μ g/L L X A 4组 6 9.8 1±1 5.3 3 0.0 5 0 3 T N F-α+1 0 0 μ g/L L X A 4组 8 2.3 2±8.7 1** 0.0 0 1 0
TNF-α损伤30、60、90 min后PMVECs单层通透系数(Kf值)较损伤前显著增高;加入LXA4干预时Kf值均显著低于TNF-α组。测定结果如表4所示。
2.5 LXA4对损伤后PMVECs炎症因子表达的影响
我们通过荧光定量RT-PCR分别检测空白对照组、模型组及治疗组(100 μg/L LXA4干预)的炎症因子IL-1β、VCAM-1、NF-κB p65的mRNA表达情况(采用2-△△CT方法进行计算)。结果显示,TNF-α处理后,损伤的PMVECs炎症因子IL-1β、VCAM-1、NF-κB p65的mRNA表达明显增加(P<0.05)。而经LXA4干预后,IL-1β、VCAM-1、NF-κB p65的mRNA表达明显减少(P<0.05),基本恢复到TNF-α干预前的水平(P>0.05),如表5所示。
表4 TNF-α及LXA4对PMVECs通透系数的影响(±s,n=3)

表4 TNF-α及LXA4对PMVECs通透系数的影响(±s,n=3)
与损伤前比较用*P表示,与TNF-α组比较用#P表示
Kf(mL/min·cm2·kPa)损伤前 损伤后15 min 损伤后30 min 损伤后60 min 损伤后90 min TNF-α组 0.021±0.011 0.019±0.015 0.037±0.005 0.067±0.007 0.096±0.007*P值 - 0.8613 0.0835 0.0036 0.0006 TNF-α+LXA4组 0.019±0.010 0.020±0.008 0.029±0.009 0.039±0.008 0.058±0.011*P值 - 0.8989 0.2674 0.0538 0.0105#P值 0.8272 0.9238 0.2496 0.0103 0.0072组别
表5 三组炎症因子的荧光定量RT-PCR结果(±s,n=3)
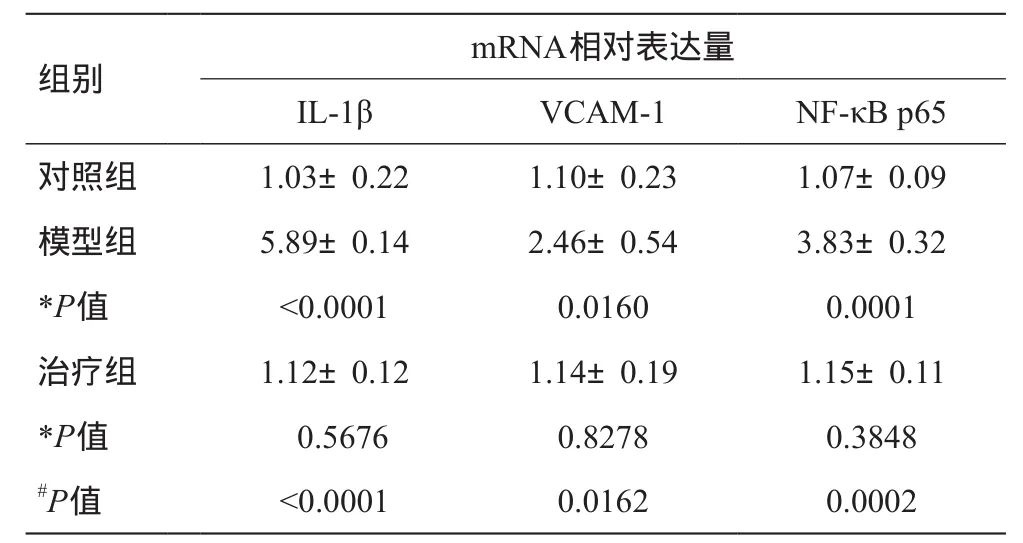
表5 三组炎症因子的荧光定量RT-PCR结果(±s,n=3)
与对照组比较用*P表示,与模型组比较用#P表示
组别 m R N A相对表达量I L-1 β V C A M-1 N F-κ B p 6 5对照组 1.0 3±0.2 2 1.1 0±0.2 3 1.0 7±0.0 9模型组 5.8 9±0.1 4 2.4 6±0.5 4 3.8 3±0.3 2*P值 <0.0 0 0 1 0.0 1 6 0 0.0 0 0 1治疗组 1.1 2±0.1 2 1.1 4±0.1 9 1.1 5±0.1 1*P值 0.5 6 7 6 0.8 2 7 8 0.3 8 4 8#P值 <0.0 0 0 1 0.0 1 6 2 0.0 0 0 2
3 讨论
介于血液和组织间隙之间的PMVECs对调节肺的气体交换及血液与肺间质之间的水液平衡至关重要[6]。炎症介质导致PMVECs形态与功能受损,诱导PMVECs凋亡,由此引发PMVECs的连接由正常的紧密变为病态的疏松,最终使PMVECs屏障功能受损,毛细血管通透性增加,从而使得血管中的蛋白质及体液向肺间质的渗出增加,继而导致ALI的发生[7-8]。TNF-α是炎症介质的典型代表,是一种主要由活化的单核巨噬细胞产生的糖蛋白,是炎症损伤级联反应的触发剂,在SAP继发的ALI发生发展中起着关键作用[9]。
本研究体外培养人PMVECs,镜下观察到正常细胞生长状态良好,呈大小均匀地多角形或长条梭形,贴壁牢固,细胞间连接紧密,呈单层“铺路石”样生长排列,与国内外研究报道一致[10-11]。而采用不同浓度(5、10、20 ng/mL)TNF-α干预PMVECs后,镜下观察PMVECs细胞收缩,胞体变小,形态变圆,细胞边界模糊,间隙增宽,胞核模糊,有细胞脱落现象。与空白对照组PMVECs相比,TNF-α干预后的PMVECs存活率显著降低,且随着TNF-α浓度的升高,PMVECs的存活率明显降低,单层通透性明显升高。TNF-α干预后的PMVECs IL-1β、VCAM-1、NF-κB p65 mRNA表达量均显著升高。上述结果均证明,TNF-α确能引起PMVECs的ALI。TNF-α主要通过作用于血管内皮细胞表面的TNF-α受体,使PMVECs产生IL-1β和IL-6等,共同介导病变血管的炎症反应[9,12]。TNF-α与其受体结合后主要通过影响细胞内调控炎症反应的关键因子(如NF-κB)的活化来调控炎症反应,可激活中性粒细胞增加其表达白细胞分化抗原CD11+/CD18+复合物,同时激活血管内皮细胞(EC),使其表达ICAM-1与血管细胞黏附分子-1(VCAM-1),从而导致白细胞和EC间相互作用,促使释放大量活性氧和弹性蛋白酶,损害血管内皮细胞和器官组织细胞,增加血管通透性[6,13-14]。
LXA4是机体自身在急性炎症后期产生的一类脂质抗炎介质,具有广泛的抗炎促消退功能,被誉为炎症反应的“刹车信号”或“停止信号”。本研究结果显示,LXA4干预组与TNF-α处理组比较,其PMVECs细胞收缩情况有所好转,细胞间紧密,细胞脱落较少,细胞边界有向正常组变化的趋势;且PMVECs存活率和单层通透性均显著改善,该效应具有剂量依赖性;PMVECs的炎症因子IL-1β、VCAM-1、NF-κB p65 mRNA表达量均显著下降。因此,我们的研究结果证实,LXA4确能改善TNF-α引起的PMVECs急性炎症损伤。但LXA4通过何种分子途经达到上述治疗作用,本研究尚未明确,我们推测可能与TNF-α的炎症通路和凋亡通路相关,有待后续进一步深入研究。
