牛樟芝泛醌类活性成分研究进展*
2019-07-04衣振伟刘晓凤王光强熊智强艾连中夏永军
衣振伟,刘晓凤,王光强,熊智强,艾连中,夏永军
(上海理工大学 医疗器械与食品学院,上海食品微生物工程技术研究中心,上海 200093)
牛樟芝(Antrodia camphorata)是20世纪90年代在我国台湾发现的珍稀药用真菌,专一寄生于台湾特有的保护树种牛樟树(Cinnamomum kanehirai)腐朽树干内壁,生长极为缓慢(1年~3年),自然产量稀少,其主要培养方式如图1所示[1,2]。近年来,许多学者研究显示牛樟芝具有多种功能活性,含有丰富的次级代谢产物,包括三萜类化合物、泛醌类化合物、Antrodins类化合物、超氧歧化酶、多糖等[3-7]。牛樟芝不同培养方式获得的产物有较大差异。子实体中含有丰富的三萜类化合物,尤其是具有24(28)-en侧链特征的麦角甾烷类三萜;而菌丝体中含有的主要活性成为泛醌类化合物Antroquinonols以及马来酸衍生物Antrodins[8]。其中以Antrquinonol为代表的泛醌类组分是极具应用潜力的活性化合物。本文从牛樟芝泛醌类组分活性、生物及化学合成等角度对其进行综述。

图1 不同培养方式得到的牛樟芝Fig.1 Antrodia camphorata obtained by different culture methods
1 牛樟芝泛醌类组分的发现
2007年,Lee等[9]人将固态发酵樟芝磨成粉末后用正己烷进行萃取,从中得到Antroquinonol,是牛樟芝固态发酵产物中鉴定出的第一个泛醌类化合物,分子式为C24H38O4,微黄色,属于脂溶性苯醌,结构上与辅酶Q3相近。Yang等[10]从牛樟芝固态发酵粉末中分离出4-acetyl-Antroquinonol-B和Antroquinonol-B,皆为无色油脂化合物,分子 式 分 别 为C26H38O7及C24H36O6,Antroquinonol及Antroquinonol-B结构式相差一个五碳环,Antroquinonol-B及4-acetyl-Antroquinonol-B结构式相差一个乙酰基(acetyl)。Antroquinonol-D也是从牛樟芝固态发酵产物中分离得到,与Antroquinonol相差一个甲氧基[11]。研究结果表明牛樟芝泛醌类化合物具有显著的抗肿瘤、抗炎等生理活性,开发价值较大,其结构如图2所示。
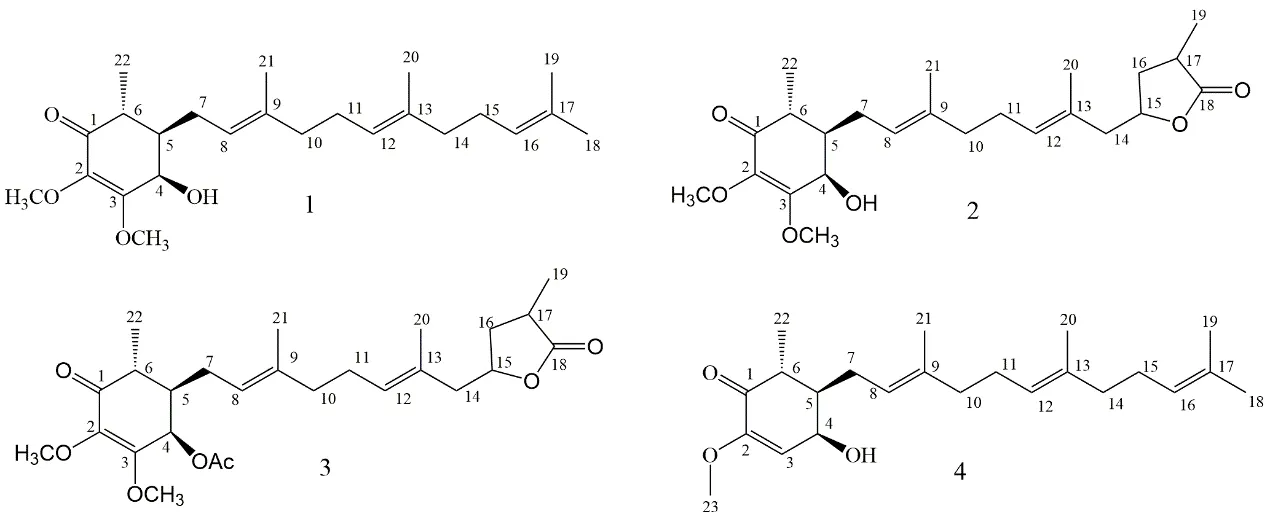
图2 牛樟芝菌丝体中的泛醌类化合物Fig.2 Ubiquinone compounds in the mycelium of Antrodia camphorata
2 牛樟芝泛醌类活性成分功能研究
2.1 抗癌活性
研究表明泛醌类组分能够抑制多种癌细胞的增殖和迁移,目前已有文献报道包括Hep3B、HepG2、MCF-7、MDA-MB-231、DU-145、LNCaP 等。Antroquinonol能够下调Bcl2蛋白的表达,从而降低与之相连的P13K和mTOR蛋白水平,促进NSCLC细胞凋亡[12]。通过抑制P13K/AKT/β-catenin信号通路,Antroquinonol能够抑制结肠癌干细胞转移和侵染[13]。Lin等[14]研究证明,Antroquinonol能够抑制两种结肠癌细胞系HCT15和LoVo的增殖,两者的G150值分别为34.8 μM和17.9 μM。此外,该研究还显示Antroquinonol能够抑制结肠癌细胞的侵袭和迁移且呈剂量依赖性。Lee等[15]人也有类似的发现,Antroquinonol能够在不影响细胞活力的情况下对乳腺癌细胞侵袭和迁移具有预防作用,低浓度(2.5~10 μM)的Antroquinonol显着降低了乳腺癌细胞系MDAMB-231的侵袭和迁移(50%~80%)。
4-acetyl-Antroquinonol-B 作用于肝癌细胞HepG2, 其 1C50 为 0.1 μg·mL-1,能够调 节 p53、p21以及p27蛋白水平,有效抑制mTOR磷酸化,降低VEGF表达量以及RhoGTPases活性,从而抑制肝癌细胞增殖和迁移,此外还具有抗酒精性肝损伤作用[16-19]。
2.2 抗炎活性
炎症,是机体损伤的一种防御反应,也是每天都会出现在人类生活中的一种复杂的生理反应,通常表现为发红、肿胀和疼痛。研究发现,它与许多病理条件包括糖尿病、关节炎、心血管疾病有关。
Chang等[20]人发现,Antroquinonol具有良好的降低细胞氧化胁迫作用的活性,可以穿过血脑屏障,在阿尔茨海默病小鼠模型实验中,能够有效提高学习和记忆能力,降低大脑β-淀粉样物水平,减少星形细胞增生程度。Antroquinonol也具有良好的抗炎活性,能够有效地对抗节段硬化性肾小球肾炎(FSGS)以及通过腹腔注射沙门氏菌型LPS诱导的严重红斑狼疮肾炎,通过激活Nrf2抗氧化通路、抑制T细胞和NLRP3炎性体,显著改善蛋白尿症状,从而缓解严重的1gA肾炎[21,22]。4-acetyl-Antroquinonol和Antroquinonol-B能强烈的抑制巨噬细胞生成NO,其 1C50 分别为 16.2 μg·L-1和 14.7 μg·L-1[23]。
2.3 保肝活性
长期的酒精摄入会引起肝脏疾病,大量科学文献显示过量酒精摄入会增加肝中酶类、细胞因子和趋化因子比如天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、肿瘤坏死因子(TNF-α)、活性氧(ROS)、一氧化氮(NO)和细胞脂质过氧化作用,这些都在酒精诱发的肝脏疾病的发病机理和进程中有重要作用[24]。另外饮酒会导致体内自由基过量产生,接着导致肝脏中还原型谷胱甘肽(GSH)含量水平的自然损耗[25]。
Kumar等[26]证明了从牛樟芝菌丝体醇提取物中得到的Antroquinonol能通过Nrf-2激活作用保护肝细胞免受乙醇诱发的氧化应激。研究发现Antroquinonol能显著抑制由酒精诱发的AST、ALT、ROS、NO、MDA产量和人类肝癌HepG2细胞中GSH损耗。蛋白印迹和RT-PCR分析显示Antroquinonol能通过MAPK途径增强Nrf-2激活和下调抗氧化基因HO-1。本研究表明了Antroquinonol通过一种涉及Nrf-2激活作用和向上调控MAP激酶蛋白介导的下游抗氧化基因表达的机制来实现对肝细胞免受乙醇诱发的氧化应激的保护作用。在活体内喂食牛樟芝菌丝体醇提取物也得到了相似结果。结果表明Antroquinonol在酒精性肝病方面有治疗价值。
2.4 其他活性
牛樟芝泛醌类活性成分除了在抗癌、抗炎、保肝方面表现突出,据科研人员近年来探究发现其在抗氧化、抑制肿瘤、增强免疫力等方面也具有显著的效果。
Guan等[27]人研究了Antroquinonol作为抗氧化剂和抑制炎症反应,评估其对CD8+T细胞的免疫抑制作用和对色素沉着的保护作用。研究发现,Antroquinonol可以抑制CD8+T细胞的增殖,减少CD8+T细胞浸润和促炎性细胞因子分泌,并在体外抑制细胞因子1L-2和1FN-γ以及T细胞活化标记物CD69和CD137的产生,以抵抗H2O2诱导生成的脱色素。
Antroquinonol能够降低神经胶质瘤细胞C6抗凋亡蛋白含量,同时提高促凋亡蛋白合成,进一步研究显示,Antroquinonol的氢键与粘着斑激酶(FAK)的86位Arg残基结合,抑制其酶活从而抑制肿瘤形成[28]。
Yu等[29]证明了Antroquinonol通过顺序信号级联诱导人胰腺癌AsPC-1细胞的抗癌活性。 它诱导P13-kinase/Akt活性受到抑制,进而阻断mTOR/p70S6K/4E-BP1信号通路,导致细胞周期蛋白和Cdks的下调,翻译抑制造成细胞周期G1停滞和线粒体依赖性细胞凋亡。上调的K-ras也可能通过与Bcl-xL的结合促成细胞凋亡。此外,自噬细胞死亡和加速衰老也至少部分地解释了AsPC-1细胞中的Antroquinonol介导的抗癌作用。
3 牛樟芝泛醌类组分生物合成研究进展
3.1 泛醌类组分的一般合成途径及其关键酶
3.1.1 泛醌生物合成途径
泛醌是一类脂溶性醌类化合物,侧链由不同数目(6~10)异戊二烯单位组成,在各类生物代谢中具有广泛的功效。从泛醌的结构上来看,它的生物合成(图3)前体是4-羟基苯甲酸。细菌通过酶消除分支酸的丙酮酸部分来合成,而植物和动物由苯丙氨酸或酪氨酸经4-羟基苯丙烯酸中间体来合成。4-羟基苯甲酸酚羟基在辅酶Q2(CoQ2)的作用下,与一个适当长度的焦磷酸聚异戊二烯酯反应,在其邻位发生C-烷基化,产物结构可进一步被修饰,如羟基化、O-甲基化、脱羧等,这些反应在真核生物和原核生物中不同;其中,Ubi1、辅酶Q6(CoQ6)和辅酶Q7(CoQ7)的作用是催化途径中三个单加氧酶反应,而辅酶Q5(CoQ5)的作用则是催化泛醌和甲基萘醌二者合成途径的甲基化反应。

图3 泛醌类化合物的生物合成途径Fig.3 Biosynthesis pathway of ubiquinone compounds
3.1.2 泛醌生物合成途径中关键酶
参与泛醌生物合成的酶类数量多,且催化反应种类多,这就给代谢调控的研究带来了诸多困难。
1)辅酶 Q2(CoQ2)
辅酶Q2(CoQ2),4-羟基苯甲酸聚异戊二烯转移酶,是参与CoQ生物合成,将聚丙烯酰侧链连接到4-羟甲苯甲酸酯环,产生膜结合的第一泛醌中间体。研究表明,该基因的突变将导致CoQ10缺陷,进而阻碍了线粒体氧化作用中的电子传递链[30];该基因的突变还会导致致命性婴儿多系统疾病[31]。
2)辅酶 Q3(CoQ3)
辅酶Q3(CoQ3),O-甲基转移酶,催化泛醌生物合成的两个甲基化步骤。CoQ3第一次甲基化发生在途径内的不同位置,因此涉及不同的底物,并归类为聚异戊二烯基二羟基苯甲酸酯甲基转移酶和2-聚异戊二烯基-6-羟基苯酚甲基化酶,第二次甲基化时这两种酶是共同的,被归类为3-脱甲基柏木醇-3-O-甲基转移酶。Poon等[32]研究证明人类CoQ3酶可以恢复CoQ3缺失酵母突变体的泛醌-6的生物合成;Jonassen等[33]研究证实了来自酵母和大鼠的酶也分别催化3-脱甲基柏木醇-6和3-脱甲基柏木醇-9的甲基化。
3)辅酶 Q5(CoQ5)
辅酶Q5(CoQ5),2-甲氧基-6-聚异戊二烯基-1,4-苯并喹啉甲基化酶,参与泛醌生物合成的甲基化步骤,是泛醌生物合成途径中的C-甲基转移酶,Dibrov等[34]研究表明将来自酿酒酵母的CoQ5基因导入大肠杆菌后,它能够补充UbiE突变体的呼吸缺陷。
4)辅酶 Q6(CoQ6)
辅酶Q6,单加氧酶,是泛醌生物合成所必需的进化上保守的单加氧酶,负责泛醌的醌环C5-羟基化。Heeringa等[35]研究发现CoQ6的突变引发肾病综合症并伴有神经性耳聋,在小鼠和斑马鱼中的敲除CoQ6基因导致细胞凋亡增加而生长减少。
5)辅酶 Q7(CoQ7)
辅酶Q7,5-脱甲氧基泛醌羟化酶,负责泛醌生物合成中5-脱甲氧基泛醌在5-羟基泛醌中的羟基化。研究显示该基因突变与寿命延长有关[36-37];Felkai S等[38]研究发现该基因缺陷减缓各种发育和生理过程,包括细胞周期,胚胎发生,胚胎后生长,节律行为和衰老。
6)UbiD
UbiD,3-辛二酰基-4-羟基苯甲酸羧基裂解酶,是催化3-辛烯基-4-羟基苯甲酸向2-辛二烯基苯酚转化途径的酶。UbiD对于合成泛醌是至关重要的。大肠杆菌ubiD突变体会使Q8生物合成产生缺陷,累积4-羟基-3-辛酰基苯甲酸(HP8B),且降低脱羧酶活性[39]。
3.2 牛樟芝泛醌类组分合成途径探索
牛樟芝泛醌类组分其化学结构与CoQ非常相似,具有类似的母核以及异戊二烯侧链,在液态发酵中添加CoQ0、对羟基苯甲酸、香叶醇等前体物能够有效地诱导牛樟芝合成Antroquinonol,通过蛋白质组学分析表明,添加CoQ0 能上调S-腺苷蛋氨酸合成酶的表达,为Antroquinonol 合成提供甲基[40]。4-acetyl-Antroquinonol的合成途径也与CoQ的合成相关,通过添加对羟基苯甲酸、CoQ0等醌环前体,能够诱导其合成。通过在发酵中添加13C同位素标记的油酸,结果显示Antroquinonol和4-acetyl-Antroquinonol-B的醌环上有13C检出,牛樟芝泛醌类组分可能由苷色酸作为醌环前体,利用聚酮体合成途径合成[41]。此外,牛樟芝风味成分2,4,5-trimethoxybenzaldehyde和橙花叔醇能够有效地诱导4-acetyl-Antroquinonol-B合成[42]。
牛樟芝遗传背景及重要活性成分合成途径的研究非常薄弱,部分学者对其菌体生长过程中一些调控酶基因以及涉及子实体化的基因进行了研究[43-44]。研究表明CoQ0的转化率较低,说明转化过程中存在限速步骤,影响泛醌类组分产量的进一步提高。但是目前对牛樟芝泛醌类组分的合成途径研究较为欠缺。对于牛樟芝菌丝体而言,深入研究牛樟芝遗传体系,利用不同组学技术研究自身活性成分(Antroquinonols、Antrodins等)的合成机制,用以提高产量,是非常重要的。
泛醌类组分,包括Antroquinonol、Antroquinonol B和4-acetyl-Antroquinonol B等,在常规液态发酵中是不能合成的,周璇等[45]通过在其中添加前体物CoQ0诱导牛樟芝菌丝体合成Antroquinonol;随后,在同步萃取发酵时添加植物油,不仅诱导产生了Antroquinonol,还获得了较多Antroquinonol B。固态发酵菌丝体中可以合成泛醌类物质,然而,牛樟芝菌丝体较为脆弱,在固态发酵过程中不能进行搅拌,否则菌丝断裂会严重抑制菌体生长和代谢。因此,固态发酵的传至和传热会受到严重影响,进而限制固态发酵的容器大小和规模,生产效率较低。
4 牛樟芝泛醌类活性成分化学合成研究进展
4.1 Antroquinonol的短时间化学合成
Antroquinonol化学合成法的研究主要开始于近两年,2015年Hsu等[46]人提出了一种简单的合成Antroquinonol的方法,利用2,3,4-三甲氧基苯酚经过七步合成Antroquinonol,大大简化了Antroquinonol化学合成的步骤。
Antroquinonol具有独特的核心结构4-羟基-2,3-二甲氧基环己-2-烯酮,其带有4,5 -顺式- 5,6 -反式构型的甲基、法尼基和羟基取代基。Antroquinonol的短时间合成由2,3,4-三甲氧基苯酚分七步完成,首先在甲醇中氧化成富含2,3,4,4-四甲氧基环己二烯酮的高电子基质,然后作为关键步骤与二甲基醚进行Michael反应,随后进行烷基化、还原和差向异构化,在3个连续的立体中心处加入所需的取代基。
4.2 Antroquinonol D的化学全合成
2014年Sulake等[47]人通过4 -甲氧基苯酚实现了Antroquinol D的全合成。此外,研究了二甲氧基环己二烯酮的迈克尔加成。主要步骤涉及螯合和基质控制环己酮的非对映体选择性还原和内酯化。内酯合成促进了酮的非对映选择性还原,合成中的其他关键反应包括丙二酸二甲酯在环己二烯酮上的迈克尔加成,二羟基化和Wittig烯化。
2015年Sulake等[48;49]人又对樟芝泛醌类活性成分的全化学合成方法进行了相关的报道,描述了Antroquinonol和Antroquinonol D的第一次全合成。该路线的特征是铱催化的烯烃异构化-克莱森重排反应(1CR),内酯化和Grubbs烯烃复分解。通过硒化/氧化方案和消除β-甲氧基来实现所需的α, β-不饱和度,以提供来自共同中间体的两种天然产物。
5 存在问题及展望
本文综述了近年来以Antroquinonol为代表的牛樟芝中泛醌类活性成分的研究,发现了其拥有的生物活性比如保肝、抗炎及抗癌活性等,为开发出治疗人类疾病的有效药物奠定了基础。
由于牛樟芝的珍稀及泛醌类物质的微少产量已经远远不能满足人类的大量需求,因此,促进牛樟芝生长和泛醌类物质合成的研究刻不容缓。泛醌类组分的合成主要包括化学合成法和微生物发酵法两种方式。其中关于化学合成法的研究主要开始于近两年,但是现有的Antroquinonol类化学合成方法的步骤复杂、总收率低以及产品纯度低,很难实现工业化的生产。
通过微生物发酵的牛樟芝菌丝体培养物与子实体特征活性成分虽然相差较大,但是其特有的泛醌类化合物以及Antrodins类等化合物有效地补充了菌丝体产物的不足,更重要的是菌丝体培养能够实现大规模工业化生产,因此,我们应着力于微生物调控,实现泛醌类活性成分的大量获得。
