鞘内联合给予T10与MK-801对神经病理性痛模型大鼠脊髓背角NR1与CREB蛋白磷酸化的影响
2019-07-04王健
王 健
(中国人民解放军94750部队医院门诊所,福建 龙岩 366200)
疼痛(Pain)是中枢神经系统功能障碍与代谢紊乱的一类疾病,是临床上常见的症状之一。由于其发生机制复杂,目前尚缺乏有效的治疗手段。神经元是构成神经系统结构和功能的基本单位,在疼痛的发生与发展过程中扮演着主要角色。既往研究表明当外周神经受到损伤时,受损局部的神经末梢以及脊髓背角内活化的胶质细胞会释放如趋化因子CXCL1,肿瘤坏死因子-α(TNF-α)、兴奋性氨基酸、以及一氧化氮(NO)等物质,与神经元上的相应受体结合,从而使得神经元发生活化[1-2]。
环磷腺苷效应元件结合蛋白(cAMP-response element binding protein;CREB)是一种核内转录因子,在神经元上广泛存在,并且CREB能够作用于特定的基因进而影响该基因的表达。有研究表明,当外周神经受到损伤时,脊髓背角浅层神经元内CREB的磷酸化水平处于高表达状态,并且给予PKA的激动剂可以显著增加CREB的磷酸化水平[3],促进疼痛的发生,这也间接证明了CREB在疼痛中发挥的重要作用。
雷公藤内酯醇(T10)是中药雷公藤的主要有效成分,具有抗炎、免疫抑制的重要作用。有研究报道称,鞘内给予T10能够明显缓解由脊神经结扎(SNL)引起的神经病理性痛,并且抑制由SNL诱导的胶质细胞的激活以及细胞因子的释放[4-5]。但其具体的镇痛机制尚不十分清楚。N-甲基-D-门冬氨酸(N-methyl-D-aspartic acid,NMDA)受体在疼痛的发生与发展过程中扮演着重要的角色,其选择性的拮抗剂,能够长时程的阻断NMDA受体并且明显抑制神经病理性痛状态下神经元的超兴奋性,临床上常用于复杂性局部痛综合征和截肢后幻肢痛的治疗。NR2B亚单位在脊髓的表达局限于和疼痛密切相关的背角浅层,因此针对NR2B亚单位的拮抗剂效果较为明显、且其副作用通常都较小。综合以上结果,不难看出NR2B亚单位和CREB的磷酸化参与了疼痛发生与发展过程中神经元内的相关分子机制的改变。因此,本研究拟通过神经病理性痛模型大鼠进一步探究鞘内联合给予T10和MK-801对脊髓背角浅层神经元内NR2B以及CREB磷酸化水平的影响。
1 材料与方法
1.1 实验动物及分组
健康雄性SD大鼠,体重220~250 g(由第四军医大学动物实验中心提供)。恒温22~25℃饲养并保证12 h的光照,动物可自由摄取水和食物。采用随机数字表法,随机分为6组(n=36):正常对照组(normal),假手术—生理盐水组(sham-saline),脊神经结扎—生理盐水组(SNL-saline),SNL-T10组,SNL-MK-108组,SNL-T10+MK-108组。所有实验均在第四军医大学伦理委员会批准下进行。
1.2 实验试剂与设备
实验过程中使用的试剂主要包括T10(福建医学科学院)、MK-801(Sigma)、兔抗p-CREB IgG(Cell Signal Technology)、兔抗p-NR2B IgG(Santa Cruz)、小鼠抗NeuN IgG (Millipore)、生物素 (biotin) 结合的驴抗兔 IgG(Jackson Immuno-Research)、生物素结合的驴抗小鼠IgG(Millipore),Alexa594结合的卵白素(Avidin,Invitrogen)、Alexa488结合的驴抗小鼠IgG(Jackson Immuno-Research)、小鼠抗β-actin IgG(Sigma)、HRP结合的驴抗兔和小鼠IgG(北京中杉)、Von-Frey 细丝(Stoelting)、恒冷箱冰冻切片机(Leica,CM1800)、10%十二烷基苯磺酸钠-聚丙烯酰胺凝胶(Bio-Rad)、聚偏氟乙烯(PVDF)膜(Millipore)、多通道激光共聚焦显微镜(FV1000,Olympus)。
1.3 鞘内置管
7%水合氯醛腹膜腔注射麻醉大鼠(0.4 mL/100 g),待麻醉彻底后备皮并在脊椎L4~S1节段沿后正中线作长约5 cm的纵切口,分层切开皮肤、皮下组织和肌肉,钝性分离肌肉直至椎骨暴露于视野中。剪刀剪开并用咬骨钳咬掉腰椎棘突,钝性分离棘突两侧肌肉和筋膜至清晰暴露硬脊膜,用注射器轻轻破开硬脊膜。顺应硬脊膜破口处经蛛网膜下腔向头侧缓慢地插入预先用无菌生理盐水灌充的PE-10导管,直至导管吻侧到达腰膨大(L4~L5)部位。用微量注射器经导管外口注入约10 mL无菌生理盐水,若硬脊膜破口处有脑脊液或气泡溢出即封住导管外口。将封口后的管口通过皮下穿出至颈部固定并分层缝合,创伤局部抗炎抗感染。鞘内置管3 d后挑选整体状态良好、无运动功能障碍的大鼠进行下一步实验,置管成功与否可行鞘内注射0.2%利多卡因10 μL,观察大鼠下肢及尾部是否出现瘫痪或运动功能障碍。
1.4 SNL和鞘内给药
7%水合氯醛腹膜腔注射麻醉大鼠(0.4 mL/100 g),待麻醉彻底后备皮并在脊椎L4~S1节段沿后正中线作长约5 cm的纵切口,分层切开皮肤、皮下组织和肌肉,钝性分离肌肉直至椎骨暴露于视野中。钝性分离左侧椎旁肌肉,切除L6脊椎横突,将L4~L6脊神经用玻璃挑针分离,3.0细铬丝线紧紧结扎L5脊神经,分层缝合后局部抗炎抗感染。Sham组给与同期处理但不结扎神经。根据课题组之前对T10和MK-801药效结果的研究[6],取T10剂量的ED50值(10 μg/kg,鞘内注射)与MK-801剂量的ED50值(30 μg/kg,鞘内注射)于术后第3~7天的实验组每天单独给予10 μLT10或MK-801以及T10与MK-801各5 μL进行联合给药。
1.5 机械性痛阈测定
鞘内注射药物后2 h,将各组大鼠置于高架网格有机玻璃罩内适应约30 min。用Von-Frey纤维细丝(1.4~26 g)缓慢给与大鼠术侧后足足心施压弯成“S”形,检测过程中以持续时间≤5 s为标准,若大鼠出现缩足、舔足或撤足等行为则视为对该强度细丝敏感(此时记下该细丝承受的强度),否则视为不敏感并继续后续强度测定。测定伊始从1.4g开始逐渐增大强度,同一强度的纤维丝测试10次,每次间隔2 min,10次中若有6次及以上出现敏感反应(>60%)的最低强度视为此刻机械缩足阈值。各组大鼠均在造模前连续2 d及造模后1~10 d给与缩足阈值测定。
1.6 免疫荧光化学染色
将各组大鼠于给药后的第4天,使用7%水合氯醛腹膜腔注射麻醉(0.4 mL/100 g),待麻醉彻底后迅速开胸,建立体外灌注通道后用约200~250 mL磷酸缓冲液(PB,0.01 mol/L,pH 7.2~7.4)冲去大鼠体内血液,待大鼠肝脏出现白褐迹象时用含4%多聚甲醛的的PB(0.1 mol/L,pH7.2~7.4)500 mL先快后慢固定约1~1.5 h。灌注完毕取出脊髓腰膨大节段于上述固定液中后固定2 h左右,后置于含30%蔗糖的PB(0.1 mol/L,pH7.2~7.4)溶液中4℃环境下脱水2 d,取出腰膨大节段并用恒冷箱切片机将其横切,切片厚约25 μm,将切片置于PBS(0.1 mol/L,pH7.2~7.4)中漂洗5 min 3次后,滴加5%山羊血清37℃封闭2 h,后加入小鼠抗Neu NIgG(1∶200)和兔抗p-CREBIgG(1∶100)于室温下摇床孵育1 h后,置于4℃孵育48 h;生物素结合的驴抗兔IgG(1∶500),室温下孵育6 h;Alexa 488标记的驴抗小鼠IgG(1∶500)和Alexa594标记的Avidin(1∶500)4 h。一抗和二抗的孵育液为含5%驴血清、0.3% TritonX-100、0.05%叠氮钠和0.25%角叉菜胶的0.01 mol/LPBS溶液,三抗的孵育液为含0.3% Triton X-100的0.01 mol/LPBS溶液。反应结束后在暗光条件下漂洗、裱片,待自然晾干后荧光封片剂封片,多通道激光共聚焦显微镜下观察并摄片,所有切片均在同一背景下拍摄。
1.7 Western blot
将各组大鼠于给药后的第4天,使用7%水合氯醛腹膜腔注射麻醉(0.4 ml/100 g),待麻醉彻底后迅速开胸,建立体外灌注通道并用事先预冷的PBS溶液(0.01 mol/L,pH7.2~7.4)快速冲血,取出腰膨大节段并于冰上迅速分离右侧腰膨大处脊髓背角,将取好的组织加入事先溶解有蛋白酶抑制剂和磷酸酶抑制剂的强效组织裂解液中,匀浆机低温匀速裂解后,置于离心机中4℃离心5 min(12000 r/min),取出离心管并吸取上清液,使用BCA法进行组织蛋白定量。蛋白样品采用10%的SDS-PAGE进行电泳分离,每个样孔确定含10 μg及以上的蛋白上样体积,参照孔加入预染蛋白marker,根据其位置确定所需蛋白pNR2B、pCREB及β-actin的位置,切取所需凝胶并电转到预先用甲醇溶液浸泡1min激活的PVDF膜上行免疫杂交反应。5%脱脂奶粉封闭2 h后加入对应的一抗[兔抗p-NR2BIgG(1∶100),兔抗p-CREBIgG(1∶200),小鼠抗β-actinIgG(1∶5000)],4℃环境下孵育过夜后TBS-T漂洗10 min 3次,分别加入HRP结合的驴抗兔和小鼠IgG(1∶5000)室温孵育1 h;TBS-T漂洗5 min 3次后,在Bio-Rad成像系统中向条带中滴加化学发光液激发荧光并进行荧光条带的扫描,ImageLab摄片并分析条带的荧光密度值,以pNR2B、pCREB与β-actin的荧光密度值之比计算出各组相对蛋白表达量。
1.8 统计学方法
本研究所有数据均在SPSS 19.0软件中进行统计分析,采用Mean±SEM表示,单因素方差分析进行组间差异的比较,两独立样本的t检验比较对照组与实验组的行为学痛阈及pCREB与蛋白的表达差异,P<0.05表示差异有统计学意义。
2 结果
2.1 鞘内联合给予T10和MK-801对SNL诱导的机械性痛敏的影响
SNL术前2天和术后1~10 d连续检测大鼠PWT(见图1),结果显示:术后第1 d起,SNL组大鼠术侧后爪机械性缩足阈值(PWT)明显下降(P<0.01),且在3 d之后基本保持平稳;SNL-T10组或SNL-MK-801组大鼠在鞘内分别给予T10或MK-801干预后第3 d术侧后爪的PWT明显提高,与给药前相比有显著性差异(P<0.05);SNL-T10+MK-801联合给药组大鼠第3 d术侧后爪的PWT提高幅度较SNL-T10组或SNL-MK-801组明显,与SNL-saline组相比较差异更加显著(P<0.01);停止给药后,SNL-T10+MK-801联合给药组较SNL-T10组或SNL-MK-801组单独给药组镇痛疗效持续时间长。

图1 鞘内给予T10、MK-801及二者联合使用 对大鼠SNL诱导的痛阈的影响
2.2 鞘内联合给予T10和MK-801对脊髓背角磷酸化的NR2B亚单位表达的影响
Western blot结果显示(见图2):与正常组或假手术组相比较,SNL-saline组大鼠在术后第7天术侧背角磷酸化的NR2B亚单位的表达明显上调(P<0.01);SNL-T10组或SNL-MK-801组在鞘内单独给予T10或MK-801后术侧脊髓背角NR2B的磷酸化水平明显下调(P<0.05);而SNL-T10+MK-801组在鞘内联合给予T10和MK-801后第7天,大鼠术侧背角NR2B的磷酸化水平较SNL-T10组或SNL-MK-801组明显下调(P<0.05)。
2.3 鞘内联合给予T10和MK-801对脊髓背角磷酸化的CREB表达的影响
免疫荧光组织化学双标染色结果显示:磷酸化的CREB大量表达于腰膨大节段脊髓背角神经元的胞体内(见图3A,D),与NeuN阳性神经元呈双重标记。Western blot检测结果显示(见图4),与Sham-saline组相比,SNL-saline组磷酸化的CREB的表达水平明显上调(P<0.01),鞘内联合给予T10和MK-801能够明显下调CREB的磷酸化水平(P<0.01)。
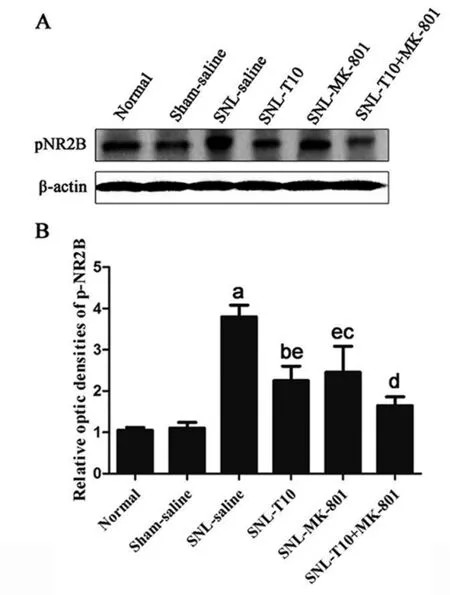
图2 鞘内给予T10、MK-801及二者联合使用对大鼠脊髓背角pNR2B蛋白表达的影响
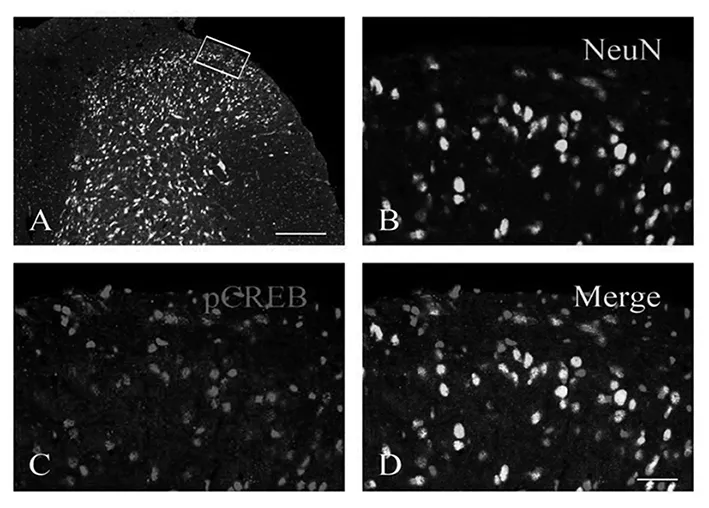
图3 磷酸化CREB表达于脊髓背角浅层神经元中

图4 鞘内给予T10、MK-801及二者联合对大鼠脊髓背角pCREB蛋白表达的影响
3 讨论
本实验通过L5脊神经结扎构建慢性神经病理性痛模型,观察到SNL可以明显诱导大鼠术侧后足机械性痛敏。之后通过免疫荧光双标染色方法观察到脊髓背角pCREB主要表达在神经元的胞体内;采用Western blot方法检测到SNL后大鼠脊髓背角NR2B和CREB的磷酸化水平明显增加。本实验结果提示鞘内联合给予T10和MK-801能够显著缓解大鼠术侧后爪的机械性痛阈,效果较单独给予T10或MK-801时明显,同时降低了NR2B和CREB的磷酸化水平。
当外周神经受到损伤时,脊髓背角的小胶质细胞和星形胶质细胞会被序贯激活[7],激活的胶质细胞会释放大量的促炎症细胞因子如IL-6,IL-1β,TNF-α等炎症介质,这些介质可与神经元上的相应受体结合,从而使得神经元发生活化,参与慢性痛的发生与发展。既往研究报道,NO可以与神经元上NMDA受体特定的区域结合,从而提高了神经元的兴奋毒性[8-9]。因此,抑制NMDA受体能够有效降低神经元的兴奋性。
环磷腺苷效应元件结合蛋白(CREB)又被称为转录增强因子,是一种基因调节蛋白。在促炎症细胞因子、兴奋性氨基酸以及一氧化氮(NO)等刺激下,神经元中活化的PKA进入细胞核,通过氨基端激酶诱导域磷酸化来活化CREB,从而调节靶基因的转录。本研究结果提示,SNL模型大鼠鞘内联合给予T10和MK-801后,其术侧后爪热机械性痛阈明显提高(P<0.05),CREB的磷酸化水平也显著降低,神经元的兴奋性也得到一定的抑制,从而阻碍了神经病理性痛的发生与发展。
T10作为中药雷公藤中的药效成分,其药理活性强,性质稳定,具有抗过敏,免疫抑制、抗肿瘤、抗感染等作用[10-11];目前在系统性红斑狼疮、类风湿性关节炎等各种自身免疫性疾病和器官移植引起的免疫排斥反应以及免疫系统介导的炎症反应中具有广泛应用。MK-801是谷氨酸受体的特异性拮抗剂,在临床癫痫等疾病的治疗中效果显著。本实验中,我们利用T10的抗炎和MK-801的抗谷氨酸毒性的作用,将二者联合应用于慢性神经病理性痛SNL模型中。结果提示,T10+MK-801联合给药的镇痛效果要明显优于T10或MK-801单独给药组,且减少了二者的使用剂量,一定程度上降低了T10与MK-801给机体带来的毒副作用。其联合作用机制可能与T10联合MK-801抑制脊髓背角内的炎症反应以及NR2B和CREB的磷酸化进而影响神经元的活性有关。但T10联合MK-801是否还可能通过其他途径影响神经元的活性有待进一步深入研究。
