癌痛消颗粒联合肝动脉化疗栓塞术治疗原发性肝癌的疗效及其对白介素12、白介素10、γ干扰素的影响研究
2019-07-03李屏李明芬韦巍张荣臻杨磊林洪升殷君邓增富
李屏,李明芬*,韦巍,张荣臻,杨磊,林洪升,殷君,邓增富
原发性肝癌(PLC)在我国具有较高的发病率和病死率,而PLC 患者在确诊时多已失去手术指征,远期预后不佳[1]。随着介入放射技术的发展,肝动脉化疗栓塞术(TACE)已成为中晚期肝癌患者的重要治疗手段,TACE 治疗可以阻断肿瘤血供并向肿瘤注入高浓度的化疗药物,对肿瘤细胞的杀伤作用较好;但仍有一定比例的患者在TACE 治疗后发生近期疾病进展,患者术后生存质量、生活能力较低[2]。
机体平衡失调而产生“癌毒”,是我国传统医学理论中肿瘤发生的根本原因。现代医学认为细胞增殖与凋亡失衡是肿瘤发生的主要机制,其中自然杀伤细胞(NK 细胞)有着重要作用,而白介素(IL)-12、IL-10 和γ 干扰素(IFN-γ)是反映NK 细胞状态的常用免疫因子。癌痛消颗粒是广西中医药大学第一附属医院韦艾凌教授自拟药方,该方由膈下逐瘀汤化裁而来,根据“泄实为主,补虚为辅”的治则加味组成,经临床证实治疗肝癌有效[3]。而癌痛消颗粒与TACE 联合应用的临床疗效及其对NK 细胞相关免疫因子的影响尚不十分明确。为此,本研究采用癌痛消颗粒联合TACE 治疗PLC,观察其疗效及其对IL-12、IL-10、IFN-γ 的影响,旨在为临床提供帮助。
1 资料与方法
1.1 研究标准 诊断标准:(1)西医诊断标准:符合《原发性肝癌诊疗规范(2011年版)》[4]中PLC 的诊断标准,即经病理组织学和/或细胞学检查诊断为肝细胞癌。(2)中医证候血瘀毒结兼正虚证诊断标准:参考《中药新药临床研究指导原则(试行)》[5]及《中医内科学》[6],主症:胁肋疼痛,胁下肿块。次症:纳呆;神疲乏力;形体消瘦;面色晦暗;脘腹胀满;大便溏薄;盗汗自汗;发热。舌脉象:舌质红或绛或紫黯有瘀斑、瘀点,苔薄,脉弦涩或细而无力。凡具备主症,次症具备2 项或2 项以上,兼见舌脉象者即可诊断为血瘀毒结兼正虚证[7]。纳入标准:(1)符合PLC 的西医诊断标准与分期标准[4],且不宜手术的Ⅱb、Ⅲ期患者;(2)PLC 后复发、转移,按临床分期不宜手术的Ⅱb、Ⅲ期患者,预计生存期>90 d;(3)中医证候符合血瘀毒结兼正虚证的诊断标准[5-6];(4)愿意行TACE,且存在TACE 适应证,无明显麻醉禁忌证者;(5)Karnofsky评分>50分,无明显心、肺、肾及骨髓功能障碍者;(6)年龄18~65 岁;(7)愿意行中药治疗者。排除标准:(1)继发性肝癌;(2)合并严重心血管、肾、肺、造血系统疾病;(3)存在难治性腹腔积液、胆瘘、腹腔内感染、消化道出血等严重并发症;(4)不耐受中药;(5)严重过敏体质。
1.3 治疗方案 患者均给予低脂优质蛋白饮食和保肝治疗,对照组采用TACE 治疗:完善术前准备,患者取仰卧位,局麻后行股动脉穿刺置管,导管进至肝总动脉,经造影明确血管分支及肿瘤的侧支循环,并根据肿瘤大小、数目及动脉支配情况,超选择插管,先后经导管注入顺铂注射液(齐鲁制药有限公司,国药准字H20023460,20 ml∶20 mg)40 mg、注射用盐酸多柔比星(深圳万乐药业有限公司,国药准字H44024359,10 mg/瓶)50 mg、氟尿嘧啶注射液(上海旭东海普药业有限公司,国药准字H31020593,10 ml∶0.25 g)0.5 g, 之后将碘化油注射液(烟台鲁银药业有限公司,国药准字H37022398,4800 mg∶10 ml)充分乳化后注入肿瘤供血动脉进行栓塞[6-7]。栓塞完成后再次行肝动脉造影,观察栓塞效果。TACE 治疗后4 周门诊复查上腹部CT 和甲胎蛋白(AFP)水平,并行第2 次TACE 治疗。试验组在对照组的基础上给予癌痛消颗粒,1 剂/d,开水冲服。8 周为1 个疗程,患者均治疗1个疗程。癌痛消颗粒组方为白花蛇舌草、红花、党参、半枝莲、桃仁、乌药、赤芍、枳壳、黄芪、五灵脂、莪术和甘草等。单味中药饮片购自江阴天江药业有限公司,具体组方由广西中医药大学第一附属医院将单味中药配置成免煎颗粒。
本研究价值:
既往研究显示肿瘤患者的免疫状态异常,是肿瘤发生发展的重要原因之一,恢复机体抗肿瘤免疫功能而达到清除肿瘤的目的是目前肿瘤治疗研究的热点。自然杀伤细胞(NK 细胞)是免疫监视作用中主要的细胞类型,本研究通过研究NK 细胞相关免疫因子白介素(IL)-12、NK 细胞因子干扰素(IFN)-γ、免疫抑制因子IL-10 的测定,证实原发性肝癌患者存在NK 细胞相关免疫因子的异常,并且提示癌痛消颗粒联合肝动脉化疗栓塞术治疗后患者NK细胞的活化水平得到提高,从而为改善患者免疫状态、提高患者疗效和改善其预后打下了基础。
本研究不足之处:
本研究未能检测NK 细胞数目及活化状态。机体免疫反应是一个庞大的网络系统,仅以少量细胞因子评价其免疫状态容易造成结果误差,因此需要加入更多证据证实癌痛消颗粒联合肝动脉化疗栓塞术治疗可以通过促进患者免疫功能达到并改善患者的远期预后的作用。
1.4 治疗监测和随访 治疗后监测:患者术后第1 个月门诊复查上腹部CT 以及血常规、肝功能、肾功能等指标;此后每3 个月复查1 次腹部彩超、肝功能。密切关注患者治疗依从性和毒副作用的发生情况,存在严重毒副作用时立即停药并给予相应治疗。疗程结束前联合门诊复查进行随访;疗程结束后采用电话对患者进行随访。主要终点事件为疾病进展,次要终点事件为全因死亡。随访截至2018-03-05。
1.5 观察指标与疗效评价 比较对照组与试验组患者临床疗效,治疗前及治疗后7 d、4 周、8 周的中医证候积分,治疗前及治疗后8 周血清IL-12 水平、血清IL-10 水平、血清IFN-γ 水平、欧洲癌症治疗研究组织的生存质量测定量表(EORTC QLQ-C30)评分,预后情况和毒副作用。
疗效评价:采用实体瘤疗效评价标准1.1 版[5-7]进行疗效评价。完全缓解:原有病灶在动脉期的增强显影完全消失;部分缓解:原有病灶直径较治疗前减小≥30%;病情稳定:原有病灶直径较治疗前减小但未达部分缓解或有增加但未达疾病进展;疾病进展:病灶直径增大≥20%或出现新的病灶。总有效率(ORR)=(完全缓解例数+部分缓解例数)/总例数×100%。
地下水水量修复可以通过人工回灌补给地下水方式得以部分解决。受水区地下水补给水源有雨洪资源、再生水和南水北调来水。受水区沿太行山前平原洪积扇区,是地下水人工补给和调蓄十分有利的空间条件。受水区内由于地下水超采,许多含水层疏干,形成了无数大大小小的地下水降落漏斗,这也为地下水储存和调蓄提供了空间(地下水库)。建设地下水库,不但可增辟可利用的水资源,调控地下水水位,而且可以腾出地下库容,增大降雨入渗,减少降雨径流流失,减少潜水蒸发,调节地表水、引黄引江水、土壤水和地下水,控制土壤返盐,防止渍涝灾害,改良盐碱地等。

表1 对照组与试验组基线资料比较〔n(%)〕Table 1 Comparison of the baseline data between the experimental and control groups
中医证候积分依据《中医内科学》[6]中PLC 分级量化表对主症即胁痛及胁下肿块之无、轻、中、重各级记分,分别为0、3、6、9 分,其余次症之无、轻、中、重各级记分,分别为0、2、4、6 分;分值越高表示症状越严重[7]。
于治疗前和治疗后8 周抽取患者静脉血5 ml,离心后留取血清保存。采用人IL-12、IL-10、IFN-γ 相应酶联免疫吸附试验试剂盒(德国Promocell 公司生产,采购自江苏普诺生生物科技有限公司),以汇松MB-580 酶标分析仪(深圳市汇松科技)及其相应试剂定量检测血清IL-12、IL-10、IFN-γ 水平。
采用EORTC QLQ-C30,在治疗前和治疗后8 周对对照组、试验组患者的生存质量进行评估:量表共30 个问题,分别从5 个功能领域(躯体、角色、情绪、认知、社会功能)、3 个症状领域(疲劳、疼痛、恶心/呕吐)、1 个总体健康状况/生存质量领域和6 个单一条目(睡眠质量、食欲、腹泻、便秘、呼吸困难和经济状况)对患者的生存质量进行测量。对于功能领域和总体健康状况/生存质量领域,分值越高表示功能状况和生存质量越好;在症状领域,分值越高提示症状越严重,生存质量越差[8]。
预后情况指标为总生存时间(OS)和疾病进展时间(TTP)。
毒副作用主要根据常见毒副作用评价标准,统计3 级以上毒副作用发生率[9]。
1.6 统计学方法 采用SPSS 23.0 和GraphPad Prism 6.0 统计学软件进行数据分析。符合正态分布的计量资料以(± s)表示,两组间比较采用成组t 检验;多组间比较采用单因素方差分析,组间两两比较采用LSD-t 检验;同组治疗前后比较采用配对t检验。计数资料以相对数表示,组间比较采用χ2检验;等级资料比较采用秩和检验。采用Kaplan-Meier 法绘制生存曲线,组间比较采用Log-rank 检验。预后分析采用Cox 比例风险回归模型分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 对照组与试验组患者临床疗效比较 试验组患者治疗后ORR 为83.72%(36/43),高于对照组的65.12%(28/43),差异有统计学意义(χ2=3.909,P=0.048,见表2)。患者TACE 治疗前后典型CT 图像见图1。
2.2 对照组与试验组患者治疗前及治疗后7 d、4 周、8 周中医证候积分比较 对照组与试验组患者治疗前及治疗后7 d中医证候积分比较,差异无统计学意义(P>0.05);试验组患者治疗后4、8 周中医证候积分均低于对照组,差异有统计学意义(P<0.05);治疗后7 d、4 周、8 周对照组和试验组患者中医证候积分均低于本组治疗前,差异有统计学意义(P<0.05,见表3)。

表2 对照组与试验组患者临床疗效〔n(%)〕Table 2 Clinical responses in the experimental and control groups
2.3 3 组治疗前后血清IL-10、IL-12、IFN-γ 水平比较 3组治疗前、治疗后8 周血清IL-10、IL-12、IFN-γ 水平比较,差异有统计学意义(P<0.05);对照组与试验组治疗前、治疗后8 周血清IL-10 水平均高于健康组,血清IL-12、IFN-γ水平低于健康组,差异有统计学意义(P<0.05);试验组治疗后8 周血清IL-10 水平低于对照组,血清IL-12、IFN-γ水平高于对照组,差异有统计学意义(P<0.05);治疗后8周对照组与试验组血清IL-10 水平低于本组治疗前,血清 IL-12、IFN-γ 水平高于本组治疗前,差异有统计学意义(P<0.05,见表4)。

图1 TACE 治疗前后典型CT 图像Figure 1 Typical CT images of primary liver cancer patients before and after hepatic arterial chemoembolization
表3 对照组与试验组患者治疗前及治疗后7 d、4 周、8 周中医证候积分比较(±s,分)Table 3 Comparison of TCM symptom scores between the control and the experimental groups before treatment and by the end of the 7th day,4th and 8th weeks of treatment
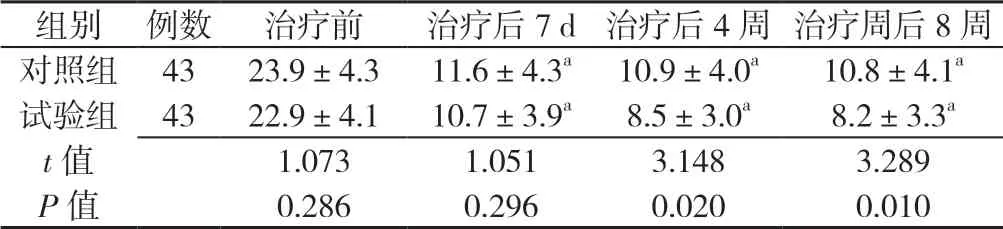
表3 对照组与试验组患者治疗前及治疗后7 d、4 周、8 周中医证候积分比较(±s,分)Table 3 Comparison of TCM symptom scores between the control and the experimental groups before treatment and by the end of the 7th day,4th and 8th weeks of treatment
注:与本组治疗前比较,aP<0.05
组别 例数治疗前治疗后7 d 治疗后4 周 治疗周后8 周对照组 4323.9±4.311.6±4.3a 10.9±4.0a10.8±4.1a试验组 4322.9±4.110.7±3.9a8.5±3.0a8.2±3.3a t 值1.0731.0513.1483.289 P 值0.2860.2960.0200.010
2.4 对照组与试验组患者治疗前后EORTC QLQ-C30 中功能领域、症状领域评分比较 对照组和试验组患者治疗前EORTC QLQ-C30 中功能领域、症状领域评分比较,差异无统计学意义(P>0.05);试验组患者治疗后8 周EORTC QLQ-C30 中功能领域评分高于对照组,症状领域评分低于对照组,差异有统计学意义(P<0.05);治疗后8 周对照组与试验组患者EORTC QLQ-C30 中功能领域评分高于本组治疗前,症状领域评分低于本组治疗前,差异有统计学意义(P<0.05,见表5)。
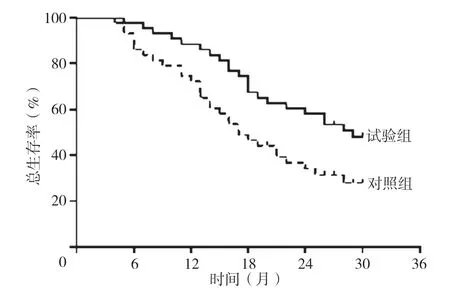
图2 对照组与试验组患者总生存情况Figure 2 Overall survival in the control group and the experimental group

图3 对照组与试验组患者无疾病进展生存情况Figure 3 Progression-free survival in the control group and the experimental group
表4 3 组治疗前后血清IL-10、IL-12、IFN-γ 水平比较(±s,ng/L)Table 4 Comparison of serum IL-10,IL-12 and IFN-γ levels among the three groups before and after treatment

表4 3 组治疗前后血清IL-10、IL-12、IFN-γ 水平比较(±s,ng/L)Table 4 Comparison of serum IL-10,IL-12 and IFN-γ levels among the three groups before and after treatment
注:健康组治疗后8 周数据采用治疗前数据;与健康组比较,aP<0.05;与对照组比较,bP<0.05;与本组治疗前比较,cP<0.05;IL-12=白介素12,IL-10=白介素10,IFN-γ=γ 干扰素
组别例数IL-10IL-12IFN-γ治疗前治疗后8 周治疗前治疗后8 周治疗前治疗后8 周健康组2033.21±2.7733.21±2.7743.76±2.5943.76±2.5941.65±3.5541.65±3.55对照组4355.39±3.56a42.51±3.31ab25.78±8.68a30.59±6.37ab23.11±3.89a30.72±5.95ab试验组4354.58±3.61a38.63±3.51abc27.02±9.21a39.81±7.80abc22.71±4.22a35.65±5.73abc F 值323.93355.134221.911109.018180.93727.949 P 值<0.001<0.001<0.001<0.001<0.001<0.001
表5 对照组与试验组患者治疗前后EORTC QLQ-C30 中功能领域、症状领域评分比较(±s,分)Table 5 Comparison of the scores in function and symptom scales of the EORTC-QLQ-C30 between the control group and the experimental group

表5 对照组与试验组患者治疗前后EORTC QLQ-C30 中功能领域、症状领域评分比较(±s,分)Table 5 Comparison of the scores in function and symptom scales of the EORTC-QLQ-C30 between the control group and the experimental group
注:与本组治疗前比较,aP<0.05
组别 例数功能领域躯体功能角色功能情绪功能认知功能社会功能治疗前治疗后8 周治疗前治疗后8 周治疗前治疗后8 周治疗前治疗后8 周治疗前治疗后8 周对照组 4381.2±8.384.2±10.3a 70.3±9.679.5±10.6a 75.5±11.280.2±11.7a 78.6±11.883.2±10.8a 72.8±10.379.7±11.4a试验组 4380.1±7.689.3±11.5a 71.1±9.885.4±11.2a 77.1±12.385.6±13.1a 79.3±10.487.9±11.8a 73.9±9.884.2±12.2a t 值0.7312.4720.4362.8630.7202.3010.3332.1990.5792.017 P 值0.4660.0150.6630.0050.4730.0230.7400.0300.5640.046组别症状领域疲劳疼痛恶心/呕吐治疗前治疗后8 周治疗前治疗后8 周治疗前治疗后8 周对照组37.9±12.230.8±9.3a23.3±10.29.8±5.3a14.2±8.94.2±2.5a试验组39.4±11.426.3±8.9a24.7±12.67.5±4.6a14.9±9.13.2±1.6a t 值0.6722.6160.6462.4530.4122.521 P 值0.5030.0100.5190.0160.6810.013
2.5 对照组与试验组患者预后情况比较 对照组患者中位OS为17(10,30)个月,试验组患者中位OS 为26(14,30)个月,见图2;以是否死亡为因变量(赋值:死亡=1,生存=0),以组别为自变量(赋值:对照组=1,试验组=2),进行Cox比例风险回归模型分析,结果显示,试验组患者死亡风险低于对照组〔HR=0.529,95%CI(0.309,0.919),P=0.019〕。对照组患者中位TTP 为11(6,15)个月,试验组患者中位TTP 为15(11,22)个月,见图3;以疾病进展情况为因变量(赋值:疾病进展=1,无疾病进展=0),以组别为自变量(赋值:对照组=1,试验组=2),进行Cox 比例风险回归模型分析,结果显示,试验组患者疾病进展风险低于对照组〔HR=0.568,95%CI(0.361,0.893),P=0.006〕。
2.6 对照组与试验组患者治疗后毒副作用发生率比较 对照组患者3 级以上毒副作用发生率为11.63%(5/43),试验组患者3 级以上毒副作用发生率为13.95%(6/43);对照组与试验组患者3 级以上毒副作用发生率比较,差异无统计学意义(χ2=0.104,P=0.747,见表6)。

表6 对照组与试验组患者治疗后3 级以上毒副作用发生情况〔n(%)〕Table 6 Comparison of the occurrence of treatment-related side effects between the control group and the experimental group
3 讨论
广西是我国PLC 的高发地区,发病率和病死率居全国前列,其会带来沉重的家庭负担和社会负担;目前采用单纯西医或中医治疗肝癌,对不可切除肝癌的临床效果均不理想,通过应用中药制剂联合TACE 的相关研究则显示能够延长患者的生存预期[10]。此外,研究中西医治疗对患者肿瘤相关免疫状态的影响,对进一步了解肿瘤发生发展的机制、有效改善肝癌患者预后有重要意义[11]。
本研究对比单纯TACE 治疗(对照组)和癌痛消颗粒联合TACE 治疗(试验组)的临床疗效,结果显示,试验组治疗后ORR 明显高于对照组。中医证候积分是常用的中医药治疗评价工具,能对常见临床症状的严重程度进行量化,分析治疗前后的病情变化。本研究结果显示,试验组患者治疗后4、8 周中医证候积分均低于对照组,治疗后7 d、4 周、8 周对照组和试验组患者中医证候积分均低于本组治疗前,提示应用TACE 治疗不可切除的PLC 具有一定的临床疗效,对于改善患者的临床症状具有积极意义;而在TACE 治疗的基础上联合应用癌痛消颗粒后患者的临床疗效得到了有效提高,患者治疗后的症状改善也更为显著。
延缓疾病进展、延长患者的生存预期是肿瘤治疗的重要治疗目标,而其中OS 和TTP 是最主要的评价指标。本研究通过对对照组和试验组患者进行随访,结果显示对照组和试验组的中位OS 分别为17 个月和26 个月,试验组的死亡风险明显低于对照组;对照组和试验组的中位TTP 分别为11 个月和15 个月,试验组的疾病进展风险明显低于对照组,提示联合应用癌痛消颗粒后患者的疾病进展风险和总死亡风险明显降低,预后改善。中医理论认为,多种因素引起的毒聚、血瘀和正虚等长期作用,可以引起毒结不消、血瘀不行、气机升降失常,若阻于肝脏并长期积聚则可以产生肝癌。而“扶正”与“祛邪”是治疗的主要原则,且我国肝癌患者多具有长期肝炎和肝硬化病史,体质薄弱,肝脏功能差,在以TACE治疗作为祛邪手段的基础上,联合中药治疗,能调和阴阳,生化气血,促进人体的免疫功能,增强抗癌作用[12]。癌痛消颗粒是本院韦艾凌教授在长期实践中总结的自拟药方,在前期临床应用中,其疗效得到了较好验证[3]。方中白花蛇舌草能够清热解毒,兼具活血止痛作用;黄芪补中益气,升举清阳;乌药、枳壳行气疏肝,散寒止痛;而红花、党参、半枝莲、五灵脂、莪术均有活血祛瘀作用,联合甘草调和诸药,共奏疏肝健脾,益气养阴,清热解毒,化痰软坚,理气活血之功效[7]。此外,体外实验也显示,癌痛消颗粒能够干扰细胞周期,从而抑制肝癌细胞系的复制[13]。
现代医学认为癌症发生、发展与机体免疫系统的状态密切相关,而其中肿瘤发生免疫逃逸是癌细胞产生、进展的重要原因;这与中医的“日久引起毒结不消、血瘀不行、气机升降失常”理论较为一致[14]。NK 细胞是免疫监视作用中的主要细胞类型,可以通过在不依赖抗体的情况下迅速杀伤肿瘤细胞[15]。IL-12 作为NK 细胞的活化因子,能与NK 细胞表面受体联合,诱导IFN-γ 的表达增加,从而提高其抑制肿瘤细胞增殖和限制肿瘤转移的作用;IL-10 则是一类具有免疫抑制作用的免疫因子,由主要由多种免疫细胞产生(如单核细胞、巨噬细胞和辅助性T 细胞等)[16]。本研究结果显示,治疗前后对照组与试验组患者血清IL-10 水平高于健康组,血清IL-12、IFN-γ 水平低于健康组,可见肝癌患者在治疗前后的免疫监视作用均明显低于健康人群;治疗后对照组与试验组患者血清IL-10 水平均明显降低,而血清IL-12、IFN-γ 水平明显升高,其中试验组患者血清IL-10 水平低于对照组,血清IL-12、IFN-γ 水平高于对照组,提示癌痛消颗粒联合TACE 后患者NK 细胞的活化水平得到了提高,从而为改善患者免疫状态、提高患者疗效和预后打下了基础,这一免疫监视增强的效果与中医“扶正”作用的内涵较为一致。KUO 等[17]在动物实验中证实,白花蛇舌草提取物能够有效改善小鼠的免疫状态,增强NK 细胞的活化水平;白花蛇舌草的主要成分如1,3-二羟基-2-甲基蒽醌也被证实能够有效促进细胞凋亡,具有较强的抗癌作用[18]。此外,药理学研究还显示,方中红花[19]、党参[20-21]、半枝莲[22-23]等活血祛瘀药物能够调节凝血系统的状态,并能够通过调节免疫活性、诱导细胞分化增殖、抑制转移等一系列作用改善患者的预后。
此外,TACE 治疗通常存在一系列如胃肠道反应、中性粒细胞计数减少、蛋白尿、出血等毒副作用,这与所应用的化疗药物以及肿瘤组织死亡产生的毒素有关;同时,中药汤剂对胃肠道的刺激效应也存在类似的不良反应。本研究结果显示,联合应用癌痛消颗粒的患者毒副作用发生率并未明显升高,提示癌痛消颗粒联合TACE 治疗具有较好的安全性。
综上所述,癌痛消颗粒联合TACE 治疗PLC 具有较好的临床疗效,能够显著减轻患者临床症状,有效调节免疫因子水平,并改善患者的远期预后,且不增加治疗相关的毒副作用。
