HPLC测定不同产地博落回茎叶中N-对香豆酰酪胺的含量△
2019-07-03曾诚曾建国
曾诚,曾建国*
1.中兽药湖南省重点实验室,湖南 长沙 410128;2.湖南农业大学,湖南 长沙 410007
博落回Macleayacordata(willd.)R.Br系罂粟科博落回属多年生草本植物。主要分布于长江中下游各省,最早记载于《本草拾遗》,此外李时珍所著《本草纲目》、2006版《中药大辞典》等中药典籍均有载入,全草皆可入药,在中国已有1000多年的用药历史。
研究表明,博落回植物中活性成分除生物碱以外,还有其他非生物碱皂苷[2]、香豆素类内酯、苯丙酰胺类等。近年来大多数研究对象均是博落回中的生物碱,鲜有研究博落回中的非生物碱。博落回提取物具有调节肠道菌群[3]、抗菌[4]、抗炎[5-6]等作用,通过查阅文献,证实N-对香豆酰酪胺同样具有较好的抗炎、抑菌作用[7-9]。孙晶[10]利用LPS诱导RAW 264.7细胞炎症模型实验中,证明N-对香豆酰酪胺在IC50为13.7 μmol·L-1时能有效抑制LPS细胞释放一氧化氮,同时N-对香豆酰酪胺对宫颈癌等肿瘤细胞也有良好的抑制作用[11-13]。为实现博落回植物资源的综合利用,本实验选取非生物碱N-对香豆酰酪胺为指标,首次对贵州凯里、河南卢氏县、安徽岳西等10个产地博落回茎叶样本进行含量测定,为博落回茎叶微粉相关兽药产品提供新的质控标准。
1 材料
1.1 仪器
1525高效液相色谱仪,包括2707自动进样器和2998 PAD检测器(美国Waters公司),十万分之一分析天平[梅特勒-托利多(上海)仪器有限公司];KQ-250B型超声波清洗器(昆山超声仪器有限公司);DZKW-D-2型水浴锅(上海医疗器械厂)。
1.2 试药
N-对香豆酰酪胺对照品(成都普思生物科技股份有限公司,纯度≥98.0%);甲醇(色谱纯);乙酸乙酯(分析纯);重蒸水;其他试剂均为分析纯。
博落回茎叶样本采集自安徽岳西、贵州凯里、河南卢氏县、湖北英山、江西新余、陕西西安、湖北通山、娄底涟源、河南洛阳、广西桂林,样本由湖南中医药大学杨广民教授鉴定为罂粟科博落回属植物博落回Macleayacordata(Willd.)R.Br.的茎叶。
2 方法与结果
2.1 色谱条件
色谱柱为资生堂MG3 C18(250 mm×4.6 mm,5 μm);流动相为甲醇-水(40∶60);梯度洗脱,洗脱时间为35 min;检测波长为290 nm;流速为1.0 mL·min-1;柱温为35 ℃,进样量为10 μL,见图1。
2.2 对照品溶液的制备
对照品母液:准确称取适量N-对香豆酰酪胺对照品,加甲醇制成质量浓度为0.196 2 mg·mL-1的溶液。
对照品溶液:准确吸取对照品母液3.0 mL,用甲醇定容至10.0 mL,制成质量浓度为0.023 5 mg·mL-1的溶液。

注:A.对照品;B.样品;1.N-对香豆酰酪胺。图1 N-对香豆酰酪胺对照品和博落回茎叶样品的HPLC图
2.3 供试品溶液的制备
准确称取博落回茎叶微粉样品10.0 g,用滤纸包好,置索氏提取器中,加入乙酸乙酯150 mL,称质量,浸泡12 h,水浴(90 ℃)提取至管内液体无色,放冷,称质量,加乙酸乙酯补足质量,经硅胶柱色谱,以二氯甲烷-甲醇(25∶1)洗脱,收集所需洗脱液,经减压浓缩至流浸膏状,加5.0 mL甲醇悬浮,超声15 min,滤过,续滤液经0.45 μm微孔滤膜滤过,即得。
2.4 线性关系考察
分别吸取N-对香豆酰酪胺对照品母液,进样量依次为10、8、6、4、2 μL,注入高效液相色谱仪,按2.1项条件下测定峰面积,以峰面积积分值为纵坐标,N-对香豆酰酪胺浓度为横坐标,经线性回归处理,得回归方程Y=43 589 644.47X-5 951.833(r=0.999 6)。N-对香豆酰酪胺含量在0.077 5~0.470 4 mg呈良好的线性关系。
2.5 精密度试验
准确吸取N-对香豆酰酪胺对照品溶液,同一天内,重复进样6次,记录N-对香豆酰酪胺对照品的峰面积和保留时间,其RSD分别为0.52%和0.10%。结果表明仪器精密度良好。
2.6 稳定性试验
准确称取同一产地(湖北通山)博落回茎叶粉末10.0 g,按2.3项方法制备样品溶液,分别于配制后0、2、4、8、16、24 h进行测定,RSD 为2.03%,表明供试样品在24 h内稳定。
2.7 重复性试验
取湖北通山博落回茎叶粉末6份,按2.3项方法制备供试样品溶液,按2.1项下条件测定,经计算得N-对香豆酰酪胺峰面积均值为322 128,RSD为0.566%,结果表明方法重复性良好。
2.8 加样回收率试验
分别准确称取已知含量的江西新余博落回茎叶粉末(0.001 5%)6份,每份10.0 g,按2.3项制备供试品溶液,分别吸取每份供试品溶液2.5 mL置于5 mL容量瓶中,每瓶中分别准确加入1.30 mL对照品溶液,用甲醇溶液定容至5 mL,按2.1项条件下测定并计算回收率,平均回收率为98.7%,RSD为2.40%,结果见表1。
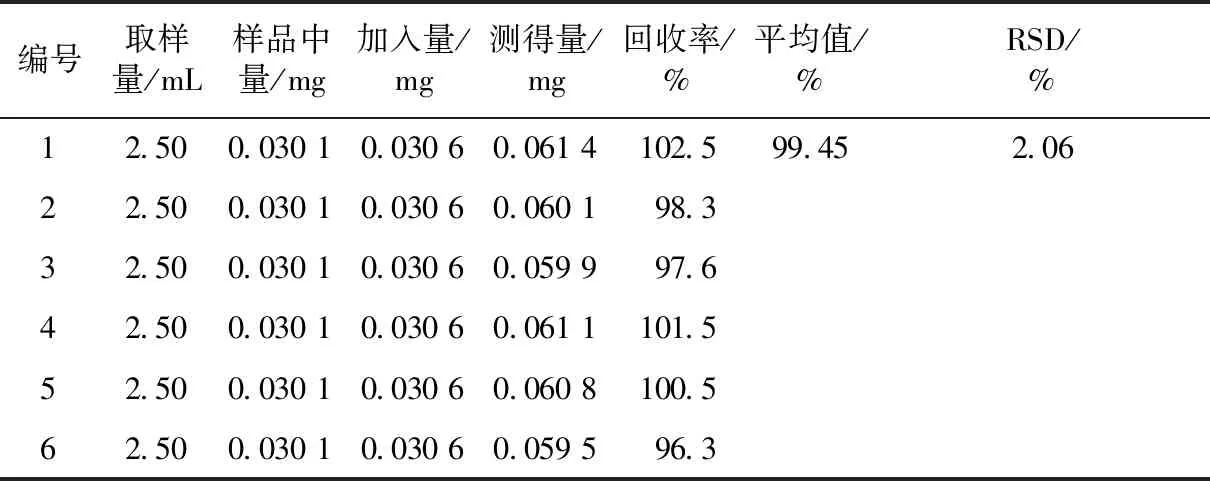
表1 N-对香豆酰酪回收率
2.9 样品含量测定
准确称取10个不同产地的博落回茎叶微粉各10.0 g,按2.3项方法制备供试品溶液,按2.1项条件下测定含量,记录峰面积,结果见表2。

表2 不同产地博落回茎叶中N-对香豆酰酪胺含量测定(n=3)
3 讨论
本实验目的在于建立非生物碱N-对香豆酰酪胺的含量测定方法,为博落回茎叶微粉相关兽药开发奠定基础,并提供新的质控标准。
在提取工艺的考察上,先对比了水、乙酸乙酯、甲醇分别作为提取溶剂时对N-对香豆酰酪胺提取率的影响,结果显示,乙酸乙酯提取的效果优于其他两种溶剂,再用乙酸乙酯为提取溶剂,对比冷凝回流法、索氏提取法、超声提取法对提取率的影响,结果表明,用索氏提取法得到的N-香豆酰酪胺含量最高,提取终点为提取至管内液体无色。故本实验选取乙酸乙酯为提取溶剂,提取方式为索氏提取法。
因为该非生物碱含量低,为了进一步实验需求,对提取后的溶液经硅胶柱层析纯化,以二氯甲烷-甲醇(25∶1)洗脱,收集所需洗脱液,经减压浓缩至流浸膏状,加5.0 mL甲醇悬浮,超声15 min。
全波长扫描结果及查阅的文献,均表明在290 nm波长处,N-对香豆酰酪胺有最大吸收,从而选取290 nm为检测波长。
本实验采用HPLC对10个不同产地的博落回茎叶样本中非生物碱N-对香豆酰酪胺的含量进行测定,结果表明,RSD均小于5%,说明本实验方法是稳定的、可行的,能用于检测博落回其他部位中N-对香豆酰酪胺的含量,邓安珺等[14]从博落回根中分离纯化得到150 mgN-对香豆酰酪胺纯品,表明博落回其他部位中也含该非生物碱,其中各部位的含量值得我们进一步研究,从而达到博落回资源的综合利用开发。
