参莲提取物对ox-LDL诱导的巨噬细胞泡沫化和凋亡的药效学研究及提取部位活性比较△
2019-07-03赵正李琦尹婕孙立东冉庆森李玉洁王娅杰陈颖杨庆翁小刚蔡维艳朱晓新
赵正,李琦,尹婕,孙立东,冉庆森,李玉洁,王娅杰,陈颖,杨庆,翁小刚,蔡维艳,朱晓新
1.安徽中医药大学,安徽 合肥 230038;2.中国中医科学院 中药研究所,北京 100700
动脉粥样硬化(atherosclerosis,AS)是一种内源性促炎和抗炎失衡所引起的慢性炎症性疾病[1-2]。巨噬细胞跨膜蛋白B型清道夫受体-CD36可以无限制地摄取氧化型低密度脂蛋白(ox-LDL),形成胆固醇负载的泡沫细胞[3-4],而巨噬细胞源性泡沫细胞的凋亡是被公认为形成AS坏死核心的关键步骤[5]。ox-LDL可促使巨噬细胞内质网功能紊乱,通过激活内质网应激(endoplasmic reticulum stress,ERS)凋亡相关蛋白酶Caspase-12,诱导细胞凋亡[6-8]。而巨噬细胞的大量凋亡、炎症消散功能的缺失、斑块的不稳定性均与ERS机制相关[9-10]。研究发现[6,11],通过缓解ox-LDL诱导的ERS,抑制巨噬细胞的凋亡,同时加强清除脂质和凋亡细胞的能力,可以达到抗炎与促炎症消散平衡的过程。因此,从炎症消散的角度,提高巨噬细胞对脂质过氧化物清除的有效性,有利于减缓AS的进展。
参莲(SL)提取物是以丹参和穿心莲不同有效部位按照临床剂量5∶3进行配伍,在活血化瘀的基础上引药入心,清解血分毒热[12]。前期研究结果表明,SL提取物能够有效抑制AS模型小鼠斑块的形成[13],改善促炎介质和炎症消散介质的失衡[14],抑制LPS诱导的巨噬细胞的极化[15]。然而SL提取物能否以巨噬细胞为靶点,通过缓解脂质过氧化物诱导的内质网应激,抑制巨噬细胞源泡沫细胞的凋亡,促进炎症消散,干预AS炎症,是本实验的研究重点。因此,本实验以ox-LDL诱导的腹腔巨噬细胞炎症损伤为模型,研究SL提取物对ox-LDL诱导的巨噬细胞泡沫化和凋亡的药效以及不同提取部位之间的活性比较。
1 材料
HWS-350型细胞培养箱(宁波海曙赛福实验仪器厂),IX81倒置显微镜(日本Olympus公司),Centrifuge 5424R型低温高速离心机(德国Eppendoff公司),Centrifuge LEGEND RT+型超高速吊篮离心机(美国Thermo公司),DYY-6D型电泳仪(北京市六一仪器厂),spectra max plus 384连续光谱酶标仪(美国Molecular Device公司)。
氧化型低密度脂蛋白(北京欣盛泽科技有限公司),衣霉素(美国Sigma公司,货号:654380),Brewer改良巯基乙醇酸盐肉汤(美国BD公司,货号:6091782),二甲基亚砜(DMSO,美国amresco公司,货号:2075C127),油红O染色液(北京雷根生物技术有限公司,货号:DL0009A6),钙离子荧光染料Fluo-3 AM(北京索莱宝科技有限公司,货号:F8841),Pluronic F127(美国Sigma公司,货号:P2443),Hepes缓冲液(北京索莱宝科技有限公司,货号:H1095),Hanks平衡盐溶液(Hank’s Balanced Salt Solution,HBSS,北京索莱宝科技有限公司,货号:H1045),Annexin V-FITC/PI细胞凋亡双染试剂盒(美国BD公司,货号:556547),Caspase-3活性检测试剂盒(碧云天生物技术研究所,货号:C1116),Caspase-12抗体(美国Cell Signaling Technology公司,货号:2202),TEMED(C6H16N2)(美国sigma公司,货号:0761),Tris(三羟甲基氨基甲烷,美国Amresco公司,货号:77-86-1),APS(过硫酸铵,美国Sigma公司,货号:A3678),BSA(牛血清白蛋白V,美国Amresco公司,货号:9048-46-8),RIPA裂解液(碧云天生物技术有限公司,货号:P0013B),PMSF(碧云天生物技术有限公司,货号:090616161212),BCA蛋白浓度测定试剂盒(北京普利莱公司,货号:PLL-2017-02)。SL提取物由中国中医科学院中药研究所化学室提供(2016年9月中试加工)。
SPF级6~8周龄C57BL/6J雌性小鼠12只,体质量(20±2)g,购于斯坦福北京生物技术有限公司,许可证号:SCXK(京)2016-0002,批号:11401500043418;动物饲养于室温(25±2)℃、湿度(55±5)%的12 h光暗交替的中国中医科学院基础研究所SPF级实验动物中心。
2 方法
2.1 样品制备
SL提取物和各提取部位的制备和质量控制详细见参考文献[14],其中丹参水溶性提取物部位的得率为1.99%,丹参脂溶性提取部位的得率为1.15%,穿心莲脂溶性提取物的得率为2.43%,按照丹参和穿心莲临床剂量5∶3的配伍比例,换算出在SL提取物中,含43.2%丹参水溶性提取物、25%丹参脂溶性提取物和31.8%穿心莲脂溶性提取物。SL提取物(50 mg)、穿心莲脂溶性浸膏(15.9 mg)、丹参脂溶性浸膏(12.5 mg)、丹参水溶性浸膏(21.6 mg)充分溶解于DMSO中,储备液终浓度为50 mg·mL-1。-20 ℃保存备用。
2.2 腹腔巨噬细胞的提取及分组
3% Brewer改良巯基乙醇酸盐肉汤1 mL腹腔注射C57BL/6J雌性小鼠,常规饲养3 d摘除眼球缺血处死,75%乙醇浸泡10 s后取出,无菌条件下将2 mL RPMI-1640培养基快速注入小鼠腹腔内,回抽腹腔灌洗液转移至15 mL离心管内,此操作重复2次,合并灌洗液,1000 r·min-1离心5 min,弃上清液,用RPMI-1640培养基重悬细胞,调整细胞密度为1×107个细胞/mL,加入培养板各孔中(每孔2.5 mL),37 ℃、5% CO2培养箱中贴壁45 min后,洗去未贴壁细胞,加入DMEM完全培养基(每孔2.5 mL),37 ℃、5% CO2培养箱中培养72 h后加药。分为阴性对照组(Control)、模型组(Model,ox-LDL,20 mg·L-1)、丹参水溶性提取物组(DS,4.32 mg·L-1+20 mg·L-1ox-LDL)、丹参脂溶性提取物组(DZ,2.5 mg·L-1+20 mg·L-1ox-LDL)、穿心莲脂溶性提取物组(C,3.18 mg·L-1+20 mg·L-1ox-LDL)、SL提取物组(10 mg·L-1+20 mg·L-1ox-LDL)、内质网应激诱导剂衣霉素组(TM,1 mg·L-1),其中SL提取物的给药浓度引用自参考文献[15],各提取部位的给药浓度是以SL提取物10 mg·L-1的给药浓度与各提取部位的含量相乘计算得到。
2.3 油红O染色
腹腔巨噬细胞培养于放有细胞爬片的培养板中,细胞加药24 h后,用1×PBS洗涤2次;放入ORO Fixative固定15 min;取出涂片,放于流通的空气中15 min;放入新配置好的ORO Stain,浸染15 min;放入60%的异丙醇漂洗30 s,流水冲洗,放入蒸馏水稍微清洗;放入ORO Buffer 1 min;流水冲洗,晾干。置于倒置显微镜下观察拍照。采用Image Pro-Plus 5.0软件计算阳性细胞的平均分光密度(Integrated OD Average,IA)值(平均分光密度=积分光密度/图片总面积)。
2.4 Annexin V-FITC/PI检测细胞凋亡
药物处理24 h后,用细胞刮刀收集细胞,用1×PBS洗涤两次,加入300 μL的1×Binding Buffer悬浮细胞;加入2 μL的Annexin V-FITC混匀后,避光,室温孵育15 min;上机前5 min加入2 μL的PI染色。用流式细胞仪检测其凋亡率,在双变量流式细胞仪的二维散点图上,左下象限显示活细胞,为(FITC-/PI-);右上象限是坏死细胞,为(FITC+/PI+);而右下象限是凋亡细胞,为(FITC+/PI-)。
2.5 Caspase-3的活性检测
在收集细胞中按照每200万细胞加入100 μL裂解液的比例加入裂解液,重悬沉淀,冰浴裂解15 min;17 000×g,4 ℃离心12 min;把上清液转移至冰浴预冷的离心管中;蛋白定量后,按试剂盒说明书设置反应体系:检测缓冲液40 μL,待测样品40 μL,裂解液10 μL,Ac-DEVD-pNA(2 mmol·L-1)10 μL,总体积为100 μL。37 ℃孵育过夜,酶标仪在405 nm波长处检测吸光度A值,计算Caspase-3酶的比活力。
2.6 钙离子荧光染料Fluo-3 AM测细胞内钙离子浓度
Fluo-3 AM溶解于无水DMSO溶液中,加入20% Pluronic F127的DMSO溶液助溶,制备成5 mmol·L-1的储备液。用HBSS稀释制备成5 μmol·L-1的Fluo-3 AM工作液。将Fluo-3 AM工作液加入培养体系中,在37 ℃下培养20 min。加入5倍体积的含有1%胎牛血清的HBSS,再继续培养40 min。用1 mol·L-1Hepes溶液洗涤细胞3次,细胞重悬,制备成1×106个细胞/mL的单细胞混悬液。37 ℃下培养10 min,然后用美国BD Biosciences AccuriC6流式细胞仪进行钙离子荧光检测。激发波长506 nm,发射波长526 nm。
2.7 Western blot法检测Caspase-12蛋白水平
加药培养24 h后,弃去上清液,用预冷的1×PBS洗涤两次,加入100 μL混合好的RIPA裂解液,冰上裂解30 min,然后10 000 r·min-1,4 ℃离心20 min,取25 μL上清液,BCA法蛋白定量,另一部分加入5×蛋白上样缓冲液后煮沸灭活。12%的聚丙烯酰胺凝胶电泳并恒流转膜将蛋白转移到用无水甲醇活化的PVDF膜上,脱脂牛奶封闭2 h,孵育目的蛋白抗体置于4 ℃冰箱过夜,TBST洗3次,每次10 min,室温孵育二抗2 h,ECL化学发光于凝胶成像系统中显影成像,Image J软件对结果进行灰度扫描分析。
2.8 统计学分析
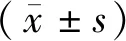
3 结果
3.1 SL提取物及其提取部位对ox-LDL诱导的腹腔巨噬细胞泡沫化的影响
通过油红O染色,观察SL提取物对巨噬细胞吞噬ox-LDL后脂质沉积的影响和比较提取部位的活性差异。与NC组比较,Model组和TM组油红O染色阳性细胞遍布,细胞内脂滴大而多,其IA值显著增加(P<0.01,P<0.05)。与Model组比较,C组、SL组细胞内脂滴明显减少(P<0.01,P<0.01);DS组和DZ组细胞内脂滴无明显变化(P>0.05,P>0.05);但C组和SL组之间的药效差异无统计学意义(P>0.05)。提示,SL整方能够有效减少细胞内胆固醇蓄积,抑制腹腔巨噬细胞泡沫化,且与穿心莲脂溶性提取部位药效相同;而ERS可能进一步增加巨噬细胞内的胆固醇蓄积,促进泡沫细胞的形成。结果见表1、图1。
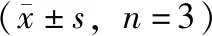
表1 SL提取物及其提取部位对ox-LDL诱导的腹腔巨噬细胞脂质沉积的影响
注:与NC组比较,#P<0.05,##P<0.01;与Model组比较,*P<0.05,**P<0.01。
3.2 SL提取物及其提取部位对ox-LDL诱导的腹腔巨噬细胞凋亡的影响
通过Annexin V-FITC/PI双染实验检测细胞凋亡率。与NC组相比,Model组和TM组显著诱导腹腔巨噬细胞凋亡(P<0.01,P<0.01);与Model组比较,DS组、DZ组、SL组均能显著减少腹腔巨噬细胞凋亡(P<0.01,P<0.01,P<0.01);C组并未有效减少腹腔巨噬细胞凋亡(P>0.05);其中SL组的药效优于DS组和DZ组(P<0.01,P<0.05),但DS组和DZ组之间的药效差异无统计学意义(P>0.05)。提示,SL整方能够有效抑制巨噬细胞源性泡沫细胞凋亡,药效优于丹参各提取物部位;而ERS可引起巨噬细胞的凋亡。结果见图2、表2。

图1 SL提取物及其提取部位对ox-LDL诱导的腹腔巨噬细胞泡沫化的影响(400×)

图2 SL提取物及其提取部位对ox-LDL诱导的腹腔巨噬细胞凋亡的影响
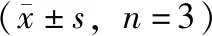
表2 SL提取物及其提取部位对腹腔巨噬细胞凋亡率的影响
注:与NC组比较,#P<0.05,##P<0.01;与Model组比较,*P<0.05,**P<0.01;DS组、DZ组与SL组比较,△P<0.05,△△P<0.01。
3.3 SL提取物及其提取部位对ox-LDL诱导的腹腔巨噬细胞Caspase-3活化的影响
细胞凋亡主要通过死亡受体介导的途径和线粒体途径共同调控Caspase-3来实现。本实验检测了Caspase-3的活性,与NC组相比,Model组和TM组均能显著上调Caspase-3的活性(P<0.01,P<0.01)。与Model组比较,DZ组、SL组均能降低Caspase-3的活性(P<0.01,P<0.05);DS组和C组并未有效降低Caspase-3的活性(P>0.05,P>0.05);其中DZ组的药效优于SL组(P<0.05)。提示,SL整方能够有效降低Caspase-3的活性,抑制巨噬细胞源性泡沫细胞凋亡,丹参脂溶性提取部位药效优于整方;而ERS能增加Caspase-3的活性,诱导巨噬细胞源性泡沫细胞凋亡。结果见表3。
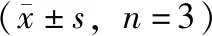
表3 SL提取物及其提取部位对ox-LDL诱导的腹腔巨噬细胞Caspase-3活性的影响
注:与NC组比较,#P<0.05,##P<0.01;与Model组比较,*P<0.05,**P<0.01;DZ组与SL组比较,△P<0.05,△△P<0.01。
3.4 SL提取物及其提取部位对ox-LDL诱导的腹腔巨噬细胞内钙离子浓度增加的影响
细胞内钙离子浓度的增加是内质网功能紊乱的直接体现。本实验通过检测细胞内钙离子水平,进一步研究SL对脂质吞噬引起的巨噬细胞内质网应激的影响和比较提取部位的活性差异。与NC组相比,Model组和TM组均能提高腹腔巨噬细胞内Ca2+水平(P<0.05,P<0.05)。与Model组相比,DZ组、C组、SL组均能显著降低腹腔巨噬细胞内Ca2+水平(P<0.01,P<0.01,P<0.01);DS组并未有效降低腹腔巨噬细胞内Ca2+水平(P>0.05);其中DZ组的药效优于SL组和C组(P<0.01,P<0.01),但SL组和C组之间的药效差异无统计学意义(P>0.05)。提示,SL整方能够有效减少腹腔巨噬细胞中Ca2+水平,缓解内质网应激,且丹参脂溶性提取部位的药效最优;而ERS能促进腹腔巨噬细胞内Ca2+水平增加。结果见图3、表4。

图3 SL提取物及其提取部位对ox-LDL诱导的腹腔巨噬细胞内钙离子浓度增加的影响
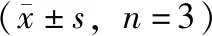
表4 SL提取物及其提取部位对ox-LDL诱导的腹腔巨噬细胞钙离子浓度增加的影响
注:与NC组比较,#P<0.05,##P<0.01;与Model组比较,*P<0.05,**P<0.01;DZ组与SL组比较,△P<0.05,△△P<0.01。
3.5 SL提取物及其提取部位对ox-LDL诱导的腹腔巨噬细胞casepase-12活化的影响
Caspase-12是一种直接介导ERS诱导凋亡机制的关键蛋白酶。本实验检测了Caspase-12的活化程度,与NC组相比,Model组和TM组剪切型的Caspase-12蛋白表达水平显著增加(P<0.01,P<0.05)。与Model组相比,DS组、DZ组、SL组显著降低剪切型的Caspase-12蛋白表达水平(P<0.01,P<0.01,P<0.01);C组并未有效降低剪切型的Caspase-12蛋白表达水平(P>0.05);但DS组、DZ组与SL组之间的药效差异无统计学意义(P>0.05,P>0.05)。提示,SL整方能够有效降低Caspase-12的活性程度,缓解内质网应激诱导的腹腔巨噬细胞凋亡,且与丹参各提取部位的药效相同;而ERS可上调Caspase-12的活化程度。结果见图4、表5。

图4 腹腔巨噬细胞casepase-12蛋白表达电泳

组别剂量/mg·L-1CleavedCaspase-12/β-actinNC00.45±0.14Model20.001.33±0.21##DS4.320.52±0.09∗∗DZ2.500.69±0.22∗∗C3.181.07±0.22SL10.000.78±0.10∗∗TM1.000.60±0.32#
注:与NC组比较,#P<0.05,##P<0.01;与Model组比较,*P<0.05,**P<0.01。
4 讨论
在As疾病发生发展过程中,同时存在着促炎和炎症消散两大调控体系,两种进程间彼此制约且相互转化[1,16]。其中,主要由巨噬细胞胞葬作用(efferocytosis)介导的脂质过氧化物清除是炎症消散过程的重要机制[17-18]。在生理状态下,有效的胞葬作用可以保证脂质过氧化物等炎症原在动脉内膜等病灶内的快速有效清除,能够改变促炎机制的相对激活水平,重塑斑块局灶的炎症促-抑平衡,进而保证斑块局灶内炎症反应在时空上的精确调控[19-20]。
在病理失衡状态下,巨噬细胞吞噬脂质后,引发内质网应激,诱导泡沫细胞出现生存障碍,导致脂质吞噬物的反复释放和坏死细胞碎片的大量出现[21-22]。这一病理障碍极大地降低了脂质过氧化炎症原的清除效率,同时将会引发更为剧烈且持续的炎症损伤,加速坏死核心和不稳定斑块的形成[18,23]。因此,ox-LDL诱导的巨噬细胞的泡沫化和病理性死亡不仅仅是急性心血管事件发病的重要诱导因素,也是AS疾病进展中炎症失衡调控具有代表性的体现。综上所述,巨噬细胞的清除效率和泡沫细胞的生存保护是从炎症的源头调控病理性炎症损伤高强度、长时程进行的关键要素,也形成了基于炎症消散进程的全新有效治疗靶点。最新研究表明,通过减少巨噬细胞的凋亡,维持有效的胞葬作用,对动脉粥样硬化疾病的综合治疗具有明确而积极的意义。
本课题组对SL提取物具有较为深厚的研究积淀和较为系统的药理学认识。目前研究成果主要集中在:1)物质组成和药物安全性评价(SL提取物5~40 mg·L-1在各个时间点均无明显细胞毒性[15]);2)对AS的干预活性和治疗价值(SL提取物能够减少AS斑块面积,调节血脂,阻断AS炎症反应[13-14]);3)基于抑制促炎反应的抗AS药理机制研究(SL提取物有效抑制NF-κB的活化,调节内源性促炎介质和炎症消散介质的再平衡而达到抑制AS炎症的作用[14])。上述研究虽然对SL治疗AS的主要药效活性和通过抑制炎症反应治疗AS的药理机制较为清楚和明确,但SL对炎症反应平衡调控,特别是对炎症消散反应的调节活性仍尚未得到清楚的科学阐释,同时对提取物中不同组分的活性比较和药效贡献度评价仍未涉及。基于此,本实验的目的是以巨噬细胞泡沫化形成和泡沫细胞的凋亡为切入点,明确SL提取物全方对AS炎症消散进程的影响和对脂质过氧化炎症损伤平衡的重塑;评价和比较SL提取物不同提取组分药效的贡献度和活性差异,为SL提取物组方科学性和优效性提供初步的研究提示和思路;揭示SL提取物在脂质摄取过程中内质网应激保护的药理机制。
在上述AS治疗的新思路和新靶点的指引下,本研究发现SL提取物整方可以显著减少脂质的积累。更为重要的是,我们在机制水平首次创新提出SL提取物能够通过对泡沫细胞内质网应激的调控,改善巨噬细胞吞噬脂质后的生存障碍,减少泡沫细胞的凋亡,有效搭建起脂质在斑块内动态的代谢链条,提高了巨噬细胞对脂质的清除效率。因此,本课题在巨噬细胞水平上,从炎症原(脂质过氧化物)和脂质沉积形成脂质坏死核心的整体角度,揭示了SL提取物促进炎症消散的药效和作用机制。
同时,在对SL提取物进行药效药理创新研究的基础上,我们还通过比较各提取部位之间的活性差异,初步从炎症消散和巨噬细胞对脂质摄取清除的角度,对SL提取物抗AS的成分基础进行了探索。实验中,我们发现,在整方活性可靠稳定的基础上,穿心莲脂溶性提取物减少脂质沉积的药效优于丹参各提取物部位;丹参脂溶性提取部位和丹参水溶性提取部位减少ERS介导的细胞凋亡的药效优于穿心莲脂溶性提取部位。上述各提取部位之间药效的差异可能成为SL复方配伍科学性的重要论据,为后续SL提取物配方优效性和物质基础研究提供初步的研究提示。本实验中设置了诱导内质网应激TM组,实验发现TM诱导的ERS可引起巨噬细胞脂质蓄积、钙离子浓度升高、Caspase-3活性增加、Caspase-12活化程度增加,诱导巨噬细胞源泡沫细胞凋亡。TM组实验结果与ox-LDL组诱导的巨噬细胞泡沫化和凋亡结果相符,进一步提示SL提取物减少脂质过氧化物诱导泡沫细胞凋亡的机制可能与ERS有关。
未来研究中我们将着力在分子水平开展SL提取物调控内质网应激的信号通路研究,论证其减少泡沫细胞凋亡的具体作用机制。特别是针对穿心莲脂溶性提取物减少脂质沉积的情况,我们将依据脂质炎症原在动脉粥样硬化病灶内“摄取-转化-流出”动态平衡调控的理论基础,从巨噬细胞胆固醇摄取、酯化和外排的角度进一步开展研究,探究其抑制泡沫细胞形成的具体作用机制。同时,我们还拟将进一步围绕“斑块局灶内脂质代谢的完整链条”,从炎症细胞迁出的角度,更加全面地揭示出SL提取物促进脂质过氧化病理性炎症消散的活性特征。
