咸味觉厌恶模型大鼠鼓索神经对味觉刺激的电生理反应特性*
2019-07-03李腊梅廖莹莹蒋恩社
李腊梅, 廖莹莹, 蒋恩社△
(1. 河南大学护理与健康研究所, 开封 475004; 2. 郑州大学附属郑州中心医院, 郑州 450007)
当动物摄食一种新的味觉物质,随后伴随着一种内脏不适或者疾病,那么动物就会记忆这种味觉并减少或拒绝再次摄入这种味觉物质,这种现象被称作条件性味觉厌恶(conditioned taste aversion, CTA)。经典的CTA模型可以通过口内给予大鼠 0.1%糖精溶液和随后腹膜内注射0.15 mol/L的氯化锂(LiCl)相结合建立起来。CTA是动物建立起来的一种学习与记忆的范式[1],是动物在自然界中形成的一种为了避免摄入有害物质而建立起来的一种适应性自我保护机制。CTA是一种经典的巴甫洛夫条件反射类型,但却具有其自身的特殊性:条件刺激(the conditioned stimulus, CS)和非条件刺激(the unconditioned stimulus, US)的联合学习仅结合一次就可以建立起对CS的CTA;CS和US之间的时间间隔可以长达几个小时;CS和US之间的联合学习在动物深麻状态下也可以进行[2]。CTA的形成机制目前研究最多的是中枢神经系统内味觉相关核团内神经元的变化,比如孤束核、臂旁核和杏仁核等[3-5]。在CTA形成的过程中,传导外周味觉信息到中枢神经系统的外周味觉神经在CTA形成中发挥什么样的作用?在CTA形成后,这些味觉传入神经对口内给予的味觉刺激是否会发生电生理反应的改变?是否是先有味觉传入神经对味觉信号编码发生了改变才导致大脑味觉皮层对味觉条件刺激的感受发生了由喜爱到厌恶的转变?这些问题目前尚不得而知,这也是本实验探讨的目的之一。
传递外周味觉信息到中枢神经系统的神经主要有鼓索神经(chorda tympani, CT)、舌咽神经和岩浅大神经,其中CT和岩浅大神经是面神经的分支。CT在动物对咸味觉的感知中发挥着重要的作用,味觉神经电生理实验表明,在CT对口内给予的五种基本味觉刺激溶液的反应中,NaCl溶液口内刺激诱发的CT反应最为强烈[6]。先前的研究表明,咸味觉大部分是由Na+作用于味蕾内味觉细胞顶端膜上的上皮钠离子通道(epithelial Na+channel, ENaC)受体介导产生的[7]。咸味觉信息通过支配舌前2/3味蕾的CT传导到中枢味觉信息的第一级换元站吻端孤束核。咸味觉信息在此加工整理后通过味觉其它核团进一步上传到味觉皮质,最终形成味觉。在味觉感觉的形成过程中,味觉信息会受到来自内环境和内脏信息等各种因素的调制,研究发现,在低钠饮食引起大鼠机体缺钠时,大鼠对口内给予NaCl刺激的电生理反应的特异性降低[8]。不适内脏信息也会通过与味觉信息在核团内的相互作用影响动物的味觉感受[9-11]。
CT作为咸味觉信息传入最主要的外周味觉神经,在大鼠条件性咸味觉厌恶建立后,其对口内给予的咸味觉刺激和其他四种基本味觉刺激的电生理反应特性是否会受到不适内脏信息的调制而发生改变,尚未见到有关报道。研究表明CT中含有两种类型的神经纤维,一种为阿米洛利(amiloride所抑制;此种纤维对口内给予NaCl刺激的反应可被ENaC受体阻断剂阿米洛利所抑制;另一种为非阿米洛利敏感性神经纤维[12]。CT的这些特征为我们研究大鼠在条件性咸味觉厌恶形成后,其对味觉刺激的电生理反应特性是否发生改变提供了有利条件。本实验利用CT在体电生理实验方法,探讨了大鼠CTA形成后,CT对口内给予的味觉刺激反应特性的改变情况。
1 材料与方法
1.1 实验动物
成年雄性SD雄性大鼠,体重250~300 g,由河南省实验动物中心提供,所有动物单笼饲养,室温为21~24℃,光暗周期为12∶12 h,实验前大鼠自由进食和饮用蒸馏水(distilled water, DW)。适应环境1周后。将两个带有刻度的100 ml饮水瓶放置饲养笼前,间隔约5 cm,给予大鼠双瓶供水。
1.2 实验分组与处理
动物适应环境后,对大鼠进行定时饮水习惯化训练,于每天10:00-10:30给予14只自由进食大鼠双瓶蒸馏水(distilled water, DW)饮食,并每天交换双瓶左右位置,18:00-18:30给予大鼠双瓶DW饮食以补充水分,其它时间禁水。4 d饮水训练后依体重将大鼠分为条件性咸味觉厌恶模型组(CTA)和对照组(Ctrl),每组7只。参照吕波等实验中的方法建立大鼠对0.1 mol/L NaCl的条件性味觉厌恶[13]。简言之,于实验第1日10:00-10:30给予大鼠30 min 的0.1 mol/L NaCl (条件刺激)饮食,随后给予CTA组大鼠2 ml 0.15 mol/L LiCl(100 mg/kg)腹腔注射一次,给予对照组大鼠2 ml生理盐水腹腔注射一次。于第2日和第3日10:00-10:30测量两组大鼠对0.1 mol/L NaCl和DW的饮用量。以上3 d中每天18:00-18:30给予双瓶DW饮食以补充水分。第4日10:00-10:30测量两组大鼠对0.1 mol/L NaCl和DW饮用量,计算两组大鼠对0.1 mol/L NaCl嗜好率。之后对成功建立CTA模型大鼠和Ctrl大鼠分别进行CT电生理记录实验,观察CT对系列浓度NaCl溶液、0.3 mol/L NaCl与0.1 mmol/L阿米洛利混合液和其他四种基本味觉刺激溶液的电生理反应。
1.3 鼓索神经电生理记录
大鼠用2%戊巴比妥钠(75 mg/kg体重)麻醉,行气管插管,将大鼠头部固定于大鼠头颈部手术头部固定仪上[14]。通过电子加热垫调节和维持大鼠体温于36~37℃。从大鼠左侧颌面部切口,移除颌面部肌肉,在手术显微镜下使用玻璃分针寻找并小心游离颌面深部的鼓索神经,于近鼓索神经进入鼓泡入口处剪断鼓索神经,并剥离鼓索神经断端大约2 mm的髓鞘。将鼓索神经断端置于铂铱记录电极上,将另一个无关电极置于大鼠面部肌肉组织内。详细的鼓索神经电生理记录参照Jiang E等[15]发表的研究论文。本实验采用成都泰盟软件有限公司生产的生物信号采集与分析系统(BL-420F)观察和记录大鼠鼓索神经对舌面部给予的不同味觉溶液的反应。
1.4 味觉刺激及反应记录程序
利用液体灌流系统ALA-VC8 (Scientific Instruments, USA )将不同的味觉刺激溶液递呈到大鼠舌面前部。给予大鼠两个味觉刺激序列,下列味觉刺激名称括号内为浓度大小,浓度单位为mol/L。一个刺激序列为: NH4Cl (0.5)、 NaCl浓度系列 (0.03、0.1、0.3)、NaCl (0.3) +阿米洛利 (0.0001)、NH4Cl (0.5);另一个味觉刺激序列为:NH4Cl (0.5)、盐酸奎宁 (0.03)、蔗糖 (0.5)、谷氨酸钠 (0.1)、柠檬酸 (0.1)、NH4Cl (0.5)。这些味觉溶液是味觉电生理研究中常用味觉刺激及适宜浓度。这里序列首尾给予的0.5 mol/L NH4Cl作为标准刺激,可以用来评估CT反应的稳定性,因为在文献报道中,口内给予0.5 mol/L NH4Cl刺激可以诱导CT产生强烈的反应。阿米洛利 (amiloride)是一种上皮钠通道(epithelial sodium channel,ENaC)阻断剂,可以强烈抑制CT对口内给予的NaCl的反应。所有溶液给予的速度为0.3 ml/s,每一个味觉刺激给予20 s,在每个刺激前后皆用蒸馏水冲洗20 s,之后停止给予任何刺激,让大鼠休息60 s,再开始下一个味觉刺激。序列首尾给予的NH4Cl诱发的CT反应的强度相差大于15%的数据舍弃,不进入统计分析。每种味觉刺激诱导的CT反应相对值按照以下公式进行计算:味觉刺激诱发的CT反应相对值=(前10 s味觉刺激反应值-味觉刺激前10 s水冲洗反应值)/平均NH4Cl净反应值,平均NH4Cl净反应值=[(第1个NH4Cl 前10 s反应值-味觉刺激前10 s水冲洗反应值) + (第2个NH4Cl 前10 s反应值-味觉刺激前10 s水冲洗反应值)]/2。
1.5 统计学处理
所有数据均以均数±标准误表示,采用统计软件SPSS 19.0进行统计分析。用重复测量的方差分析分析两组在不同浓度的NaCl之间的差别,用独立样本t检分析两组之间其他四种基本味觉的差异。
2 结果
2.1 大鼠条件性咸味觉厌恶模型建立
将大鼠对CS嗜好率小于40%作为大鼠CTA建立成功的标志,CS嗜好率=CS饮用量/(CS+DW)饮用量。我们的数据显示CS和US结合后第24小时、第48小时和第72小时, CTA组每只大鼠对0.1 mol/L NaCl的喜好率在10%~20%之间,而对照组每只大鼠对0.1 mol/L NaCl的喜好率皆大于40% (表1),提示CTA组大鼠条件性咸味觉厌恶模型建立成功。

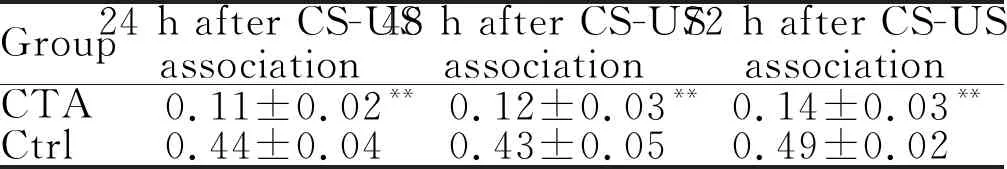
Group24 h after CS-US association48 h after CS-US association72 h after CS-US associationCTA0.11±0.02**0.12±0.03**0.14±0.03**Ctrl0.44±0.040.43±0.050.49±0.02
CTA: Conditioned taste aversion; Ctrl: Control; CS: Conditioned stimulus; US: Unconditioned stimulus
**P<0.01vsCtrl group
2.2 大鼠CT对不同浓度的NaCl电生理反应
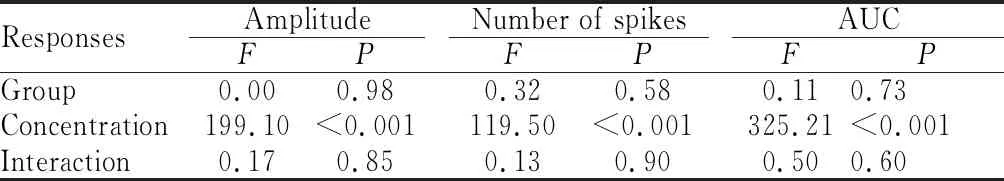
本实验以CT对于首尾两次给予0.5 mol/L NH4Cl反应的平均值作为标准参考值,求得CT对各种味觉刺激电生理反应的相对神经反应幅度、相对神经放电个数和相对神经反应曲线下面积,用这三个测量指标来代表大鼠CT对各种味觉刺激反应的强度,分析CTA组与Ctrl组大鼠CT对各种味觉刺激反应的差异。两组大鼠CT对口内给予的系列浓度NaCl反应的结果如图1所示,重复测量统计分析结果表明,在反映神经反应强度的三个指标(相对神经反应幅度、相对神经放电个数和相对神经反应曲线下面积)上,两组大鼠CT对于系列浓度的NaCl反应均具有很好的浓度反应依赖性(P<0.01),但是CTA组大鼠和对照组大鼠之间相比,CT对不同浓度的NaCl刺激的反应在三个反应指标上没有差异(P>0.05),并且分组和浓度两个因素之间没有交互作用 (P>0.05,表2)。这些结果说明,大鼠对NaCl味觉刺激是否产生条件性味觉厌恶,不影响CT对NaCl的反应大小,并且CT对NaCl反应的浓度依赖性不受分组因素的影响。

Fig.1The relative amplitude (A), number of spikes (B) and AUC (C) of CT electrophysiological responses to different concentrations of NaCl in the rat of CTA and Ctrl groups. Here the magnitude of CT responses to different concentration of NaCl was calculated relative to the CT response to 0.5 mol/L NH4Cl which was taken as the standard (n=7)
CTA: Conditioned taste aversion; Ctrl: Control; AUC: Area under the curve
Tab.2Summary of ANOVA results for CT responses to series of NaCl concentration across groups (n=7)
ResponsesAmplitudeFPNumber of spikesFPAUCFPGroup0.000.980.320.580.110.73Concentration199.10<0.001119.50<0.001325.21<0.001Interaction0.170.850.130.900.500.60
2.3 阿米洛利对大鼠口内给予0.3 mol/L NaCl 刺激诱发的CT反应的影响
阿米洛利是舌上皮Na+通道的特异性阻断剂,它可以显著抑制CT对口内给予的NaCl溶液刺激的反应。实验结果表明,两组大鼠口内给予0.3 mol/L NaCl和0.1 μmol/L 阿米洛利混合液可以显著抑制CT对口内给予0.3 mol/L NaCl溶液的反应强度 (包括相对神经反应幅度、相对神经放电个数和相对神经反应曲线下面积三个反应指标) (P< 0.01)。而在反映CT反应强度的三个指标上,两组大鼠CT对0.3 mol/L NaCl或0.3 mol/L NaCl + 0.1 μmol/L阿米洛利的反应强度都没有显著差异(图2)。这一方面说明本实验记录到的信号是CT对NaCl的反应信号,而不是对机械和温度等的反应,另一方面也说明CTA组大鼠对咸味觉的厌恶并没有影响到CT的电生理反应特性。

Fig.2The relative amplitude(A), number of spikes (B) and AUC (C) of CT electrophysiological responses to 0.3 mol/L NaCl with or without 0.1mM amiloride in the two groups of rats. Here the magnitude of CT responses to 0.3 mol/L NaCl or to 0.3 mol/L NaCl mixed with 0.1m mol/L Amiloride was calculated relative to the CT responses to 0.5 mol/L NH4Cl which was taken as the standard (n=7)
CTA: Conditioned taste aversion; Ctrl: Control; Ami, amiloride; AUC: Area under the curve
**P<0.01vs0.3 mol/L NaCl
2.4 两组大鼠CT对其他四种基本味觉刺激的反应
支配大鼠舌前2/3味蕾的CT不仅对口内给予的咸味觉刺激有较强的反应,而且对口内给予的其他四种基本的味觉刺激也都有强弱不等的反应,其中CT对0.1 mol/L的柠檬酸刺激反应较为强烈,其次是0.1 mol/L 谷氨酸单钠、0.5 mol/L蔗糖,CT对0.03 mol/L的奎宁反应较弱。图3是1只CTA组大鼠和1只对照组大鼠CT对系列浓度NaCl、0.3 mol/L NaCl + 0.1m mol/L amiloride、0.5 mol/L蔗糖、0.1 mol/L柠檬酸、0.03 mol/L奎宁和0.1 mol/L谷氨酸单钠的代表性反应曲线图。从反应CT对味觉刺激反应强度的三个指标上来看,两组大鼠CT对0.1 mol/L柠檬酸、0.5 mol/L蔗糖、0.03 mol/L奎宁和0.1 mol/L谷氨酸单钠没有显著性差异(P>0.05)。提示大鼠咸味觉厌恶形成后,CT对其他酸、甜、苦、鲜四种基本味觉刺激的电生理反应特性也没有发生改变(图4)。

Fig.3The representative traces of rectified and integrated CT responses to a series of NaCl concentration (A) and four basic taste stimuli (B) from 2 adult rats with one from CTA group and the other one from control group
CTA: Conditioned taste aversion; Ami: Amiloride; MSG: Monosodium glutamate; CA: Citric acid

Fig.4The relative amplitude (A), number of spikes (B) and AUC (C) of CT electrophysiological responses to the other four taste stimuli in the two groups of rats. Here the magnitude of CT responses to 0.5 mol/L sucrose, 0.1 mol/L CA, 0.03 mol/L quinine, and 0.1 mol/L MSG was calculated relative to the CT responses to 0.5 mol/L NH4Cl which was taken as the standard (n=7)
CTA: Conditioned taste aversion; Ctrl: Control; AUC: Area under the curve; CA: Citric acid; MSG: Monosodium glutamate
3 讨论
鼓索神经作为NaCl的优势反应神经,在咸味觉信息从外周到中枢的传递过程中发挥着重要作用。CT切除可以显著升高大鼠和小鼠对NaCl的觉察阈值[16,17],并削弱大鼠对NaCl和KCl的分辨能力[18]。然而在大鼠条件性咸味觉厌恶建立与维持过程中,传递外周咸味觉信息的CT扮演着什么角色至今还不清楚。阿米洛利是舌上皮味觉细胞膜钠离子通道阻断剂,可强烈抑制CT对NaCl刺激的反应。本研究结果发现,大鼠条件性咸味觉厌恶建立后,其CT对不同浓度的NaCl刺激诱发的反应依然具有浓度依赖性,并且阿米洛利可以强烈抑制CTA大鼠CT对NaCl刺激的反应。CTA大鼠CT对其他四种基本味觉刺激的反应特性也没有发生变化,本研究从另一个方面证明,在CTA形成过程中,外周味觉神经没有参与对味觉信息的编码,大鼠CTA形成主要发生在中枢神经系统。
CTA的建立是一个与动物记忆有关的联想学习过程。在此过程中,外周味觉神经仅仅起到了味觉信息的传递作用,更复杂的味觉信息和内脏不适刺激的相互作用发生在中枢神经系统。脑干孤束核和臂旁核是处理味觉信息和内脏信息的重要核团。神经元c-Fos蛋白表达是外周刺激诱发脑内神经元激活的生物标记物之一,味觉刺激和内脏刺激对脑内孤束核和臂旁核神经元c-Fos表达影响的研究表明,甜味觉刺激和不适内脏刺激在孤束核尾端内脏亚核和吻端味觉亚核可以相互减弱对方的作用[9];臂旁核的外部内侧亚核参与了味觉信息和内脏信息相互作用的处理过程[10]。核团损毁实验表明,PBN损毁大鼠不能形成CTA[19],这可能是因为PBN损毁后,味觉条件刺激和非条件刺激不能在此进行信息处理,大鼠不能进行联想学习的原因。前脑杏仁核也是动物处理味觉信息和内脏信息的重要核团,在CTA形成中,在大鼠对味觉条件刺激由喜爱到厌恶的情感转变过程中,发挥着重要的作用。有研究表明电损毁杏仁基底外侧核的大鼠不能建立CTA,提示杏仁基底外侧核在对CTA的记忆维持方面具有重要作用[5]。另外在味觉信息从外周到中枢的传递过程中,大鼠对摄入物质的味觉感受还受到众多因素的影响,味觉神经和味觉核团对味觉信息的编码会受到内环境因素和内脏信息的影响。例如,体内缺钠大鼠对口内给予NaCl刺激的电生理反应的特异性降低[8]。损毁大鼠杏仁中央核降低大鼠对NaCl、柠檬酸及盐酸奎宁溶液的摄入量,提示杏仁中央核可通过改变大鼠对味觉刺激欣快阈值的评估参与对味觉摄食的调控[20]。动物摄食后引发的内脏信息通过迷走神经传入中枢神经系统,并在中枢与味觉信息发生作用,迷走神经切除可显著降低大鼠对甜味觉溶液摄食[21],而且给予大鼠内脏不适刺激也显著影响大鼠对5种基本味觉溶液的摄食[11]。本研究发现, CTA大鼠在清醒状态下对0.1 mmol/L NaCl摄食量和嗜好率显著下降,即CTA大鼠对0.1 mmol/L NaCl发生了由喜爱到厌恶 (拒绝摄食) 的转变,而在麻醉状态下其鼓索神经对系列浓度的NaCl电生理反应特性没有发生改变,这提示在条件性味觉厌恶形成中,CTA大鼠外周味觉神经对味觉刺激的反应没有受到内脏不适刺激的影响, CTA大鼠对味觉刺激由喜爱到厌恶的转变主要是受到中枢神经系统活动的影响。中枢神经系统是如何参与CTA大鼠对味觉刺激由喜爱到厌恶的转变需要进一步的研究。这些结果从侧面证明了CTA形成机制发生在中枢,而外周神经作为味觉信息传入通路没有参与大鼠CTA的形成。然而CTA形成的机制及其复杂,中枢神经系统是如何参与CTA形成的,还有待进一步的深入研究。
鼓索神经作为咸味觉信号上传至中枢神经系统的主要传递通路,其功能的完整性是大鼠建立条件性咸味觉厌恶不可缺少的因素。在大鼠咸味觉厌恶建立的后,给予大鼠咸味觉刺激,大鼠对咸味觉溶液的摄食减少。由于大鼠CT对咸味觉刺激的反应特性没有发生改变,CT传递的仍是舌上皮味觉细胞产生的咸味觉信息,外周味觉神经并没有参与味觉信息编码的改变,大鼠感受到的仍旧是咸味感觉,但是大鼠对咸味刺激诱发的情感却由喜爱感受转变到厌恶感受,这种对味觉刺激复杂的情感转变主要发生在中枢神经系统。
