富氢燃气与空气低压补燃特性研究
2019-07-03杨进慧王朝晖许晓勇
杨进慧,王朝晖,田 原,许晓勇
(北京航天动力研究所,北京 100076)
0 引言
氢氧火箭发动机利用少量的氢和氧在燃气发生器内燃烧,产生一定温度的富氢燃气去驱动涡轮做功,然后经排气管排入大气。火箭飞行过程中环境压力一直下降,富氢燃气排放后与空气发生低压补燃,直接改变发动机周围的热环境,进而影响发动机各组件性能[1-2],为了保证发动机及火箭的正常工作,需开展氢燃气与空气的低压补燃特性研究。
国内外学者对气氢-空气在常压及高压下的可燃极限研究较多[3-5],但对于低压环境下的气氢燃烧特性研究很少。德国卡尔斯鲁厄理工学院的M.Kuznetsov开展了关于常温气氢-空气的可燃极限及火焰的扩展速度试验研究[6],研究表明对于常温氢气和空气的混合气,当初始压力低于8 000 Pa(电火花塞点火)或者低于2 500 Pa(电热金属丝点火)时,不论氢浓度为多少,都无法被点燃。文献[7]给出了20~60 kPa压力下气氢-空气不同比例混合气的最小点火能量,但未给出气氢与空气的可燃极限。
目前国内外对于富氢燃气与空气的低压补燃特性尚未有明确的认识,本文通过试验及仿真研究了低于标准大气压工况下不同燃气温度、燃气组分对于富氢燃气补燃特性的影响,为研究富氢燃气与空气的低压补燃边界提供了参考。
1 试验系统
采用气氢-气氧燃气发生器试验系统开展富氢燃气与空气低压补燃特性研究,试验系统主要由真空舱、燃气发生器、气氢气氧供应、调节控制系统、吹除系统、电火花塞以及压力、温度传感器等组成,如图1所示。

图1 试验系统示意图Fig.1 The experimental system
燃气发生器流量变化范围2~20 g/s,混合比变化范围0.5~1.4,在燃气发生器出口转接了一段引出管,引出管通径10 mm,长度120 mm,在引出管出口前方约80 mm正对位置设有热电偶用来测量燃气温度。
2 试验结果及分析
表1和图2为富氢燃气与空气低压补燃特性研究的试验工况及结果,图2(a)为明亮黄色火焰,认为其发生补燃,图2(b)为无色透明火焰,认为其不发生补燃。

图2 富氢燃气与空气补燃特性试验Fig.2 Recombustion experiment of hydrogen-rich gas and air
在常压空气状态,通过不断变化混合比调整富氢燃气温度,研究富氢燃气与常压空气发生补燃的温度边界,从表1可以看出,在富氢燃气温度高于932 K时发生补燃,低于877 K时不发生补燃。
保持富氢燃气温度高于950 K,逐步降低真空舱压力,从表1可以看出,当气压降至60 kPa时候,富氢燃气仍能够与空气发生补燃,但当气压继续降至30 kPa时,富氢燃气与空气不发生补燃。
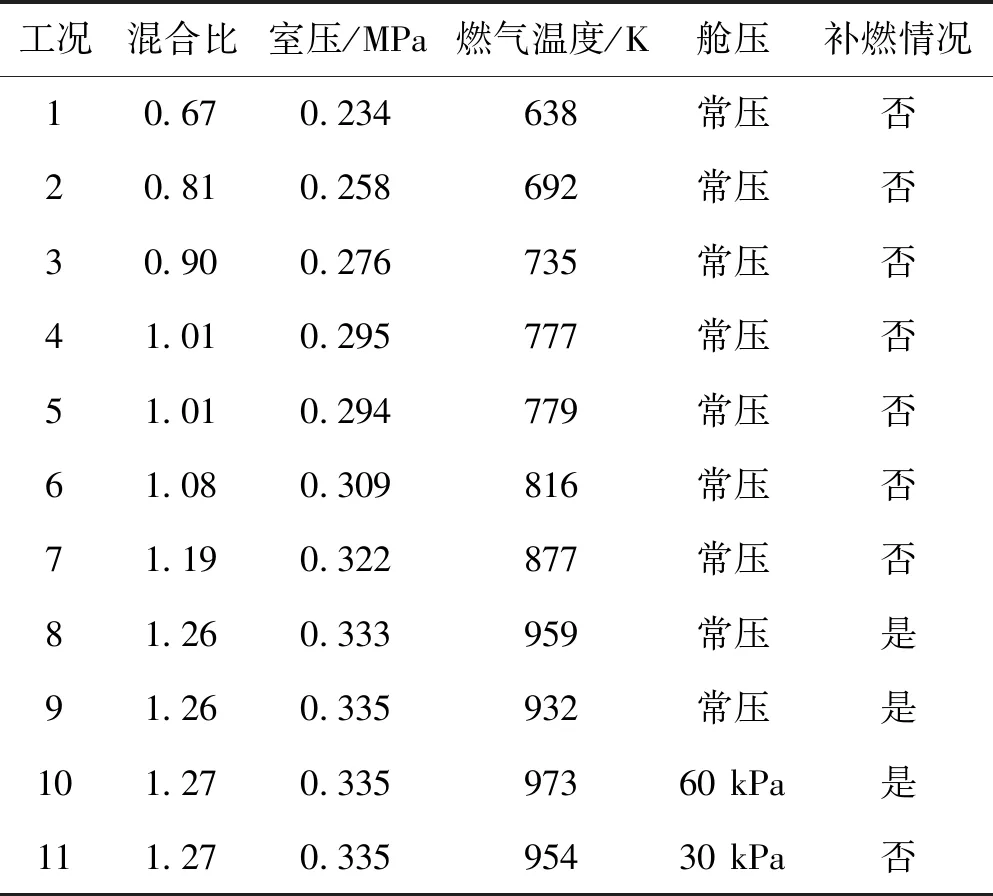
表1 富氢燃气与空气补燃特性试验结果Tab.1 Results of recombustion experiment for hydrogen-rich gas with air at sub-atmospheric pressures
3 数值仿真分析
3.1 理论模型
利用FLUENT商业软件,选用轴对称模型,通过求解使用k-ε湍流模型的Navier-Stokes方程组对富氢燃气与空气补燃特性进行数值模拟,仿真模型如图3所示。模型共划分结构网格5.9万个,在燃气出口及引出管壁面处对网格进行加密。入口边界采用质量入口,给定入口水力直径、湍流强度、燃气温度和组分;出口边界条件采用压力出口边界,壁面采用无滑移、绝热条件。
图3 数值仿真模型Fig.3 Numerical simulation model
火焰的自点火、熄灭等特征需要详细的化学反应机理对燃烧过程进行深入演绎,氢氧详细反应机理的研究与简化已经较为深入和广泛[8-12]。化学反应机理中包括了化学反应中主要组分和基元反应,本文选用8种组分、18个主要化学反应的有限速率模型,化学反应机理如下:
H2+O2=OH+OH H2+OH=H2O+H
H+O2=OH+O H2+O=OH+H
H+O2+M=HO2+M H+O2+O2=HO2+O2
OH+HO2=H2O+O2H+HO2=OH+OH
O+HO2=O2+OH OH+OH=O+H2O
H2+M=H+H+M O2+M=O+O+M
H+OH+M=H2O+M H+HO2=H2+O2
HO2+HO2=H2O2+O2H2O2+M=OH+OH+M
H2O2+H=HO2+H2H2O2+OH=H2O+HO2
其中M为第三载体。
有限速率化学机制通过组分浓度和化学反应动力学机理直接求解各组分生成和消耗速率,再经单独确定化学反应时间尺度计算时间步长内的组分浓度变化[13-14]。对于一个由NR个反应、总组分数为N的化学反应系统,组分i总的生成率
(1)
式中:Ri,r为第r个反应中组分i的Arrhenius摩尔生成率;Mw,i为组分i的摩尔质量。
第r个反应方程
(2)
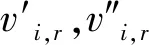
将质量作用定律用于每一个基元反应,对其求和,在第r个反应中,组分i的生成和消耗的摩尔速率
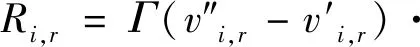
(3)
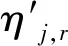
反应r的正向反应速率常数kf,r由Arrhenius公式计算
kf,r=AfTβfe-Ef/RT
(4)
式中:Af为指前因子;βf为温度指数;Ef为反应活化能;R为通用气体常数;T为介质温度。
逆向反应常数kb,r可以根据以下关系式从正向反应速率常数计算
(5)
式中Kr为化学平衡常数,按下式计算
(6)
其中
(7)
(8)
3.2 试验工况仿真分析
燃烧过程可以根据基元反应的化学状态的作用和顺序大致分成三类:起始反应、链式分支反应和终止反应。其中链式分支反应生成大部分自由基,主要有H,O,HO2和OH等,这些基元反应持续放热才能维持火焰传播或扩散时不会熄灭。H+O2=OH+O已被很多研究证实为氢氧燃烧中最活跃最重要的链式分支反应[9-10,15-16],故而本文通过比较不同工况下该反应的化学反应速率研究富氢燃气与空气的补燃特性。
针对试验工况,分别给定燃气温度600 K,800 K,950 K和1 200 K进行常压下的富氢燃气与空气补燃仿真分析。燃烧仿真选用FLUENT中层流有限速率模型/涡耗散模型计算反应速率,由Arrhenius公式可知燃气温度直接影响化学反应速率常数,如图4所示,燃气温度升高,燃气与空气的反应速率呈指数增长,且火焰面向上游移动,与试验中高温燃气才发生补燃现象规律相符。
保持燃气温度950 K不变,降低环境压力,分别计算101 kPa,60 kPa,30 kPa和10 kPa下的富氢燃气补燃情况。如图5所示,随着环境压力降低,氢氧浓度下降,燃气出口速度增大,故而化学反应速率下降,火焰面向下游移动,与试验中高背压环境下富氢燃气才发生补燃现象相符[17]。
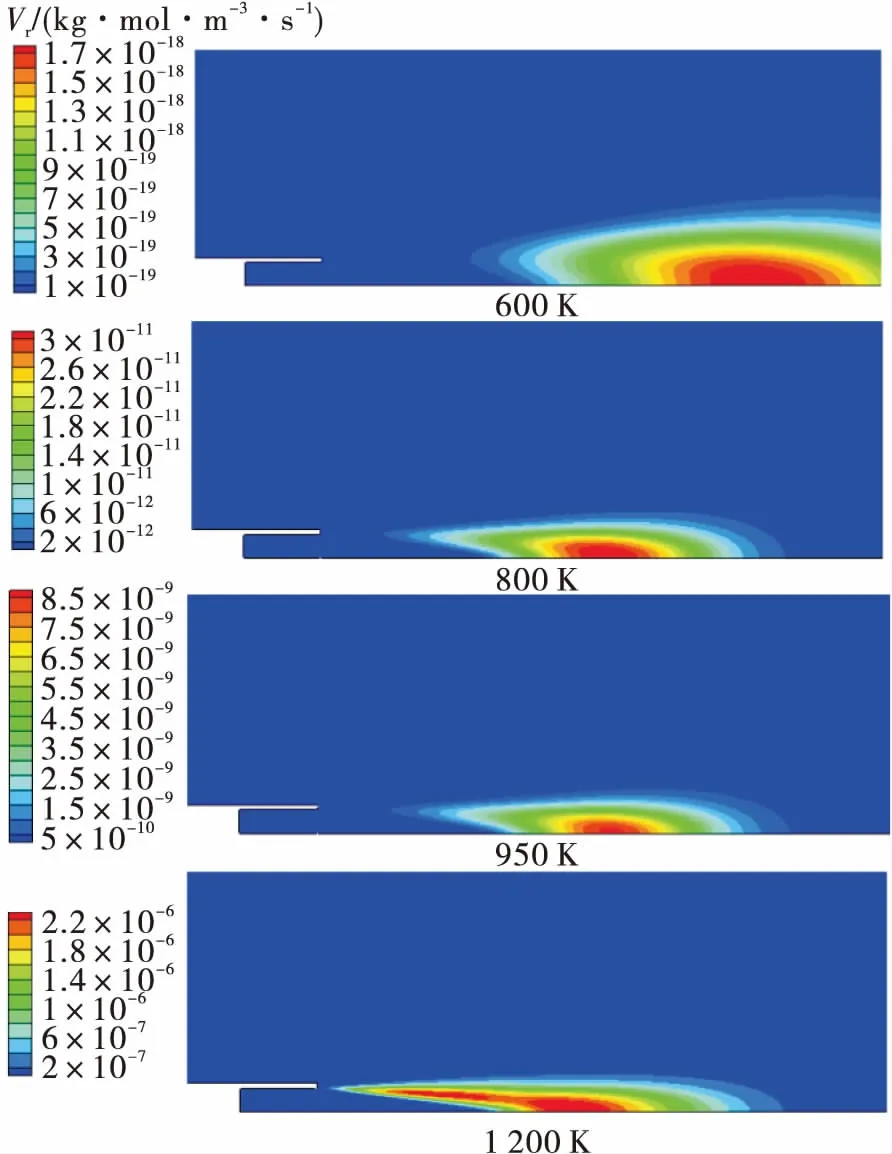
图4 不同燃气温度下的化学反应速率Fig.4 Reaction rate of hydrogen-rich gas under different temperatures
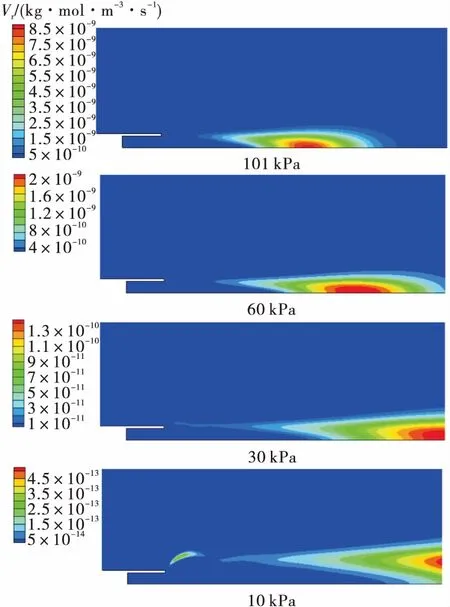
图5 不同环境压力下的化学反应速率Fig.5 Reaction rate at different sub-atmospheric pressures
综合对比图4、图5和表1可知,化学反应速率随燃气温度和环境压力变化剧烈,在最大化学反应速率超过10-9情况下比较容易观测到宏观的富氢燃气与空气的补燃现象,可以进一步通过H+O2=OH+O的最大化学反应速率研究不同燃气温度、氢气含量的富氢燃气在低压状态下与空气的补燃特性。
3.3 燃气温度对富氢燃气低压补燃特性的影响
保持燃气组分不变(燃气中氢气摩尔百分比87.4%),分别计算不同燃气温度在低压环境的燃烧流场,如图6所示。可以看出,随着环境压力增高,富氢燃气与空气的化学反应速率增大,当环境压力大于60 kPa时,反应速率增长减缓。燃气温度越高,其与空气发生补燃的临界压力越低,即1 200 K燃气补燃边界在10 kPa到30 kPa之间,950 K燃气需超过60 kPa,而800 K燃气在一个大气压下也不会发生补燃。

图6 燃气温度对富氢燃气低压补燃特性的影响Fig.6 Influence of gas temperature on recombustionproperties of hydrogen-rich gas with air at sub-atmospheric pressures
3.4 氢气含量对富氢燃气低压补燃特性的影响
由Arrhenius公式可知燃气中氢气与空气的当量比对化学反应速率有直接影响,保证燃气温度不变(950 K),分别计算不同燃气组分在低压环境的燃烧流场。如图7所示。
在氢含量较多时(燃气中氢气摩尔百分比87.4%),随着环境压力升高,氢气与空气更接近理论化学当量比,故而化学反应速率持续增大;氢含量较低(燃气中氢气摩尔百分比30%,50%)时,压力高于30 kPa后,氢气与空气比例变化不大,化学反应速率在10-11~10-10之间。通过分析,燃气中氢气含量低于87.4%工况下,无法在低于30 kPa环境下与空气补燃,燃气中氢气含量低于50%工况下在一个大气压下也不会发生补燃。

图7 氢气含量对富氢燃气低压补燃特性的影响Fig.7 Influence of hydrogen ratio on recombution properties of hydrogen-enriched gas with air at sub-atmospheric pressures
4 结论
通过试验与仿真研究了富氢燃气与空气的低压补燃特性,结论如下:
1)在常压空气状态,混合比约1.2,富氢燃气温度高于932 K时发生补燃,低于877 K时不发生补燃。
2)富氢燃气温度高于950 K,混合比约1.2,当气压降至60 kPa时候,富氢燃气仍能够与空气发生补燃,但当气压继续降至30 kPa时,富氢燃气与空气不发生补燃。
3)化学反应速率随燃气温度和环境压力变化剧烈,在最大化学反应速率超过10-9情况下比较容易观测到宏观的富氢燃气与空气的补燃现象。
4)燃气温度和氢气含量越高,其与空气发生补燃的临界压力越低,但当压力低于10 kPa时,燃气温度1200 K,氢气含量87.4%也无法与空气发生补燃。
