小麦内生耐盐菌株YN1的分离鉴定及其生物学特性研究
2019-07-02李星志王虹赵丹石运幸刘爱新
李星志 王虹 赵丹 石运幸 刘爱新

摘要:本试验从山东无棣县盐碱地健康小麦茎基部分离到1株内生细菌YN1,对其进行菌落形态观察和16SrDNA分子鉴定,并分析其固氮能力、产铁载体能力和产IAA能力,测定了150mmol/LNaCl胁迫下经菌株处理后小麦的耐盐能力。结果表明,该菌株为成团泛菌(Pantoeaagglomerans),具有固氮和产铁载体能力,其在0、100mmol/LNaCl条件下IAA产量分别为112.06、153.81μg/mL。与CKI相比,YN1处理的小麦幼苗在150mmol/LNaCl胁迫下株高、根长等显著增加,叶绿素、类胡萝卜素、脯氨酸含量分别提高77.23%、78.55%、47.90%,CAT、POD和SOD活性分别提高74.7%、27.1%和64.2%,而丙二醛含量下降35.3%,表明YN1处理可提高小麦的耐盐能力。
关键词:小麦;盐碱地;内生细菌;成团泛菌;耐盐能力
中图分类号:S476.1文献标识号:A文章编号:1001-4942(2019)05-0063-06
我国盐碱地面积大、分布广泛,仅环渤海地区就有266.7万公顷中低产田盐碱地和66.7万公顷盐碱荒地,农业生产潜力巨大,是我国今后农业科技开发的重要领域,也是保障国家粮食安全的重要发展区域。近年来研究人员在耐盐品种选育方面进行了大量研究,为开发利用盐碱地提供了可能[1,2]。
除培育抗、耐盐品种外,利用植物内生细菌提高其耐盐能力也越来越受到重视。许多盐碱地生长的植物内生细菌本身具有耐盐能力,对促进寄主植物生长发育、抵抗逆境等具有重要作用[3]。研究表明PGPR菌株除通过固氮、分泌铁载体和生长素(IAA)等方式促进植物根系发育[4],还可通过分泌信号调节物质或诱导植物产生抗逆代谢物质等提高抗逆性[5]。张磊等[6]证实某些PGPR(plantgrowth-promotingrhizobacteria)菌株可以促进植物对盐害的抵抗力。本研究从山东省无棣县盐碱地小麦健株中分离到一株耐盐菌株YN1,对其进行生物学特性研究,并分析其对小麦耐盐能力的影响,以期为盐碱地开发中利用该菌株提供参考。
1材料与方法
1.1材料
2016年4月,于山东省无棣县山东农业大学试验盐碱地小麦田采集小麦健株,用于耐盐菌株分离。供试小麦品种为山农22。
供试培养基:NA培养基用于细菌的培养;TSA培养基用于菌株的筛选;Hoagland半固体培养基用于小麦幼苗的培养;阿贝无氮培养基用于检测菌株的固氮能力;MSA培养基用于检测铁载体的产生。
1.2主要试剂
Salkowski试剂用于检测IAA含量;CAS染剂用于铁载体检测;抗氧化酶活性测定试剂盒,购自苏州科铭生物技术有限公司。
1.3试验方法
1.3.1菌株的分离及鉴定菌株分离:将小麦植株表面消毒,剪取茎基部1g研磨,用无菌水稀释至不同浓度,采用平板稀释法用TSA培养基进行分离。
菌落形态观察:将分离获得的菌株于NA培养基28℃培养48h,观察菌落形态、大小、颜色等。
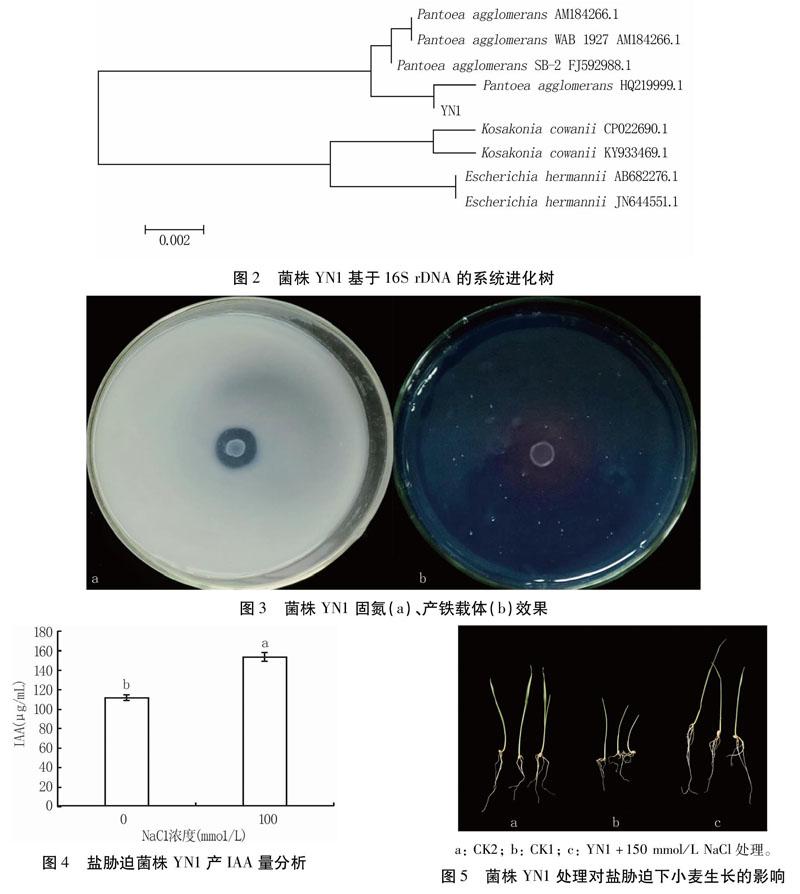
分子鉴定:菌株YN1于28℃、NB培养基中振荡培养至对数生长期,8000r/min离心收集菌体,CTAB法提取基因组DNA。用16SrDNA通用引物(27F:5′-AGAGTTTGATCCTGGCTCAG-3′;1492R:5′-GGTTACCTTGTTACGACTT-3′)进行PCR扩增,PCR产物送上海生工测序。用DNAMAN软件将测序结果进行拼接,與GenBank数据库中的细菌序列进行比对,使用MAGE5.0制作进化树,分析其所属类别。
1.3.2菌株固氮能力测定将菌株YN1(于NB培养基培养)用无菌水稀释至OD600=1.0,取10μL菌液滴于阿贝无氮培养基中央,于28℃培养5d后,根据透明圈的有无和大小,确定菌株的固氮能力[7]。重复3次。
1.3.3菌株产铁载体能力测定参照Chen等[8]的方法。将50mLCAS试剂与等量1mol/L磷酸缓冲液混合后,加入到200mLMSA培养基中,制成MSA平板。将培养的菌株YN1用无菌水稀释至OD600=1.0,取10μL菌液滴于MSA平板中央,28℃培养5d,观察菌株周围是否出现橘红色,以无菌水为对照。重复3次。
1.3.4菌株分泌IAA能力测定参照文献[9]的方法。菌株YN1用无菌水稀释至108cfu/mL,以3%(V/V)的接种量接种于含有50mLNB培养液的三角瓶中,培养液中NaCl浓度分别为0mmol/L和100mmol/L;随后向各瓶培养基中加入色氨酸,使瓶中色氨酸浓度达到10-4mg/L,28℃、180r/min振荡培养3d。菌液于8000r/min离心5min,取1mL上清液与1mLSalkowski试剂混合,避光静置30min,用紫外分光光度计于530nm处测定吸光度,根据标准曲线计算IAA量。重复3次。
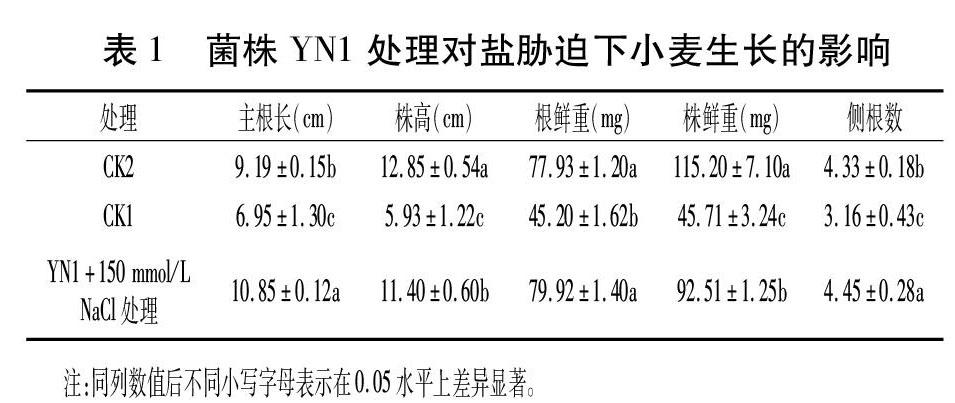
1.3.5菌株YN1对小麦的耐盐能力分析参照文献[10]的方法。小麦种子用5%次氯酸钠表面消毒后,于25℃催芽24h。菌株YN1先用无菌水稀释至108cfu/mL,后将催芽种子在菌液中静止放置4h。用无菌滤纸吸干种子表面多余液体,放入装有Hoagland半固体培养基的试管中,NaCl浓度为150mmol/L。于光照培养箱内(昼/夜温度为20℃/15℃,光/暗周期为16h/8h)培养12d后,测量小麦株高和根长,统计小麦地上部、根鲜重和侧根数。以无菌水+150mmol/LNaCl处理为CK1,无菌水处理为CK2。
1.3.6菌株YN1处理对小麦脯氨酸、丙二醛、叶绿素含量等的影响参照文献[11]的方法测定脯氨酸含量。采用1.3.5的方法培养小麦种子,取培养12d的小麦幼苗0.5g,按1/10(W/V)加入3%磺基水杨酸5mL,沸水浴10min,冷却过滤。取2mL滤液加入冰醋酸和酸性茚三酮溶液各2mL,沸水浴30min,冷却至室温,加入4mL甲苯,振荡器高速振荡30s,静置5min。取上层溶液测定520nm下吸光度,根据标准曲线计算脯氨酸含量。
丙二醛含量测定参照文献[12]的方法。取小麦幼苗0.5g,加入5%TCA溶液5mL,冰浴下研磨,3000×g离心15min,取2mL上清液与5mL0.5%硫代巴比妥酸溶液混匀,沸水浴10min,冷却至室温,3000×g离心15min。取上清液分别测定532、600、450nm下的吸光度。根据公式[6.452×(OD532-OD600)-0.559×OD450]×Vt/(FW×Vs),计算丙二醛含量。式中,Vt为提取液总体积,Vs为测定用提取液体积,FW为样品鲜重。
参照文献[13]的方法测定叶绿素和类胡萝卜素含量。称取小麦叶片0.5g,加入80%丙酮3mL,研磨至匀浆,16000×g离心5min,将上清液用80%丙酮定容至10mL。分别测定470、663、645nm下的吸光度,根据吸光度值分别计算类胡萝卜素、叶绿素a、叶绿素b、总叶绿素含量。以80%丙酮作为空白,以空白作为参比。重复3次。
1.3.7菌株YN1对小麦过氧化酶活性的影响参照酶活性测定试剂盒说明书制备粗酶液。称取0.5g小麦叶片,液氮研磨,按1/10(W/V)加入酶提取液,混匀,4℃、8000r/min离心15min,上清液为粗提液。
SOD活性测定:取90μL粗酶液,根据试剂盒说明书,按比例、顺序加入不同反应液,充分混匀,室温静置30min,于560nm测定吸光度值。参照试剂盒提供的公式计算SOD活性。
CAT活性测定:取35μL粗酶液与CAT检测工作液混合,室温下立即测定240nm下初始吸光度值和1min后的吸光度值,根据试剂盒提供的公式计算CAT活性。
POD活性测定:吸取15μL粗酶液,参照试剂盒说明书按比例加入不同反应液,混合均匀,记录470nm下30s时的吸光度值和1min后的吸光度值,参照试剂盒提供的计算式计算POD活性。
1.4数据分析
利用MicrosoftExcel2003进行数据整理和作图,利用DPSV3.01进行方差分析和差异比较。
2结果与分析
2.1菌株分离与鉴定
菌株YN1菌落形态特征:菌落为淡黄色,有光泽,表面光滑,粘稠、边缘整齐,无流动性(图1)。
用16SrDNA通用引物对菌株YN1的DNA进行PCR扩增,在1400bp左右扩增出单一条带。之后对PCR产物进行序列测定,并在NCBI数据库中进行BLAST比对,利用MEGA5.0软件分析系统进化关系。结果(图2)显示,菌株YN1与已报道的成团泛菌(Pantoeaagglomerans)菌株(基因登录号HQ219999.1)亲缘关系最近,相似性在99.9%,分在同一分支,确定该菌株为成团泛菌。
2.2菌株YN1生物学活性测定
对菌株YN1固氮能力、产铁载体能力和产IAA能力进行测定发现,YN1分别在无氮培养基上和CAS-MSA平板培养5d后,菌株周围分别出现透明圈和橘红色晕圈,表明YN1具有固氮能力(图3a)和产铁载体能力(图3b)。
由图4可知,菌株YN1可以产生生长素(IAA),在100mmol/LNaCl条件下,IAA产量为153.81μg/mL,比无NaCl时增加26.79%(112.06μg/mL)。表明盐胁迫可以提高菌株YN1的IAA产量。
2.3菌株YN1对小麦耐盐能力的影响
菌株YN1处理的小麦耐盐能力结果如图5、表1所示。盐胁迫(150mmol/LNaCl)下,YN1处理后的小麦幼苗株高、主根长、鲜重等均比CK1有显著提高,其中株高和侧根数分别增加92.2%和40.8%,植株鲜重增加102.4%。但与CK2相比,株高和植株鲜重明显降低,根长、侧根数明显增加。表明YN1处理提高了小麦幼苗的耐盐能力。
2.4菌株YN1对小麦抗逆代谢的影响
由图6可以看出,在150mmol/LNaCl胁迫下,经菌株YN1处理的小麦脯氨酸含量比CK1增加47.90%,叶绿素和类胡萝卜素含量分别增加77.23%和78.55%,MDA含量下降35.3%。表明在盐胁迫下,YN1处理增强了小麦的抗逆代谢。
2.5菌株YN1对小麦抗氧化酶活性的影响
由图7可以看出,盐胁迫下,与CK1相比,YN1处理的小麦植株的抗氧化酶活性均有明显提高,CAT、POD和SOD活性分别增加74.7%、27.1%和64.2%。表明菌株YN1可能通过提高小麦植株抗氧化酶活性增强耐盐能力。
3讨论与结论
经鉴定,本研究分离到的耐盐菌株YN1为Pantoeaagglomerans。该菌株具有产铁载体、固氮等特性,100mmol/L盐浓度可显著提高其产IAA能力。另外,該菌株可促进小麦在中度盐浓度(150mmol/L)下生长并显著提高小麦体内脯氨酸、叶绿素等含量和SOD、CAT等抗氧化酶活性。
植物在盐胁迫下主要表现为生长抑制。潘多锋等[14]发现,偃麦草苗期株高、成活率、生物量的降低均与盐浓度升高有关。PGPR菌株对提高植物的耐盐能力有重要作用。许芳芳等[15]发现小麦内生肠杆菌FYP1101能够显著提高小麦的耐盐能力和盐胁迫下小麦的生物量。Li等[11]也发现内生细菌Pantoea和Bacillus等在中高盐浓度下对象草(Pennisetumpurpureum)的生长有显著的促生作用。本研究证实菌株YN1可增加小麦在盐胁迫下的生物量,提高小麦的耐盐能力。
研究发现,脯氨酸、可溶性糖等代谢物和SOD、POD等抗氧化酶与植物抗逆密切相关。脯氨酸作为植物体内重要的渗透调节物质,通过调节胞内外渗透压提高植物抗逆境胁迫的能力,脯氨酸的积累可提高植物的耐盐能力[12-17]。SOD、POD等为植物体内主要的抗氧化酶,可清除植物体内活性氧,缓解过多活性氧对植物的损伤[13,18]。傅蕾等[12]发现,内生菌Pantoeasp.不仅提高盐胁迫下狼尾草种子发芽力,而且明显提高植株体内脯氨酸和可溶性糖含量,同时多种抗氧化酶活性也显著提高。本研究得出菌株YN1处理不仅提高小麦植株内脯氨酸含量和SOD等抗氧化酶活性,而且对叶绿素和类胡萝卜素含量的提高也较为明显。从耐盐能力看,菌株YN1处理可使小麦在中度盐浓度(150mmol/L)正常生长。这与已报道的菌株Kp120的耐盐能力相当[19]。
参考文献:
[1]陆启环,张弢,杨洪兵,等.两个小麦新品种的耐盐性分析[J].华北农学报,2017,32(2):151-156.
[2]杨真,王宝山.中国盐渍土资源现状及改良利用对策[J].山东农业科学,2015,47(4):125-130.
[3]王桂君,许振文,蒋秋花,等.不同程度盐碱化土壤对两种作物种子萌发及幼苗生长的影响[J].安徽农业科学,2013,41(21):8857-8859,8881.
[4]庞发虎,杜瑞卿,王坦,等.小麦内生细菌促生菌株的筛选及其影响小麦生长的因子的相关性分析[J].中国农业大学学报,2016,21(1):8-21.
[5]ChenC,XinK,LiuH,etal.Pantoeaalhagi,anovelendophyticbacteriumwithabilitytoimprovegrowthanddroughttoleranceinwheat[J].ScientificReports,2017,27(7):1-14.
[6]张磊,侯云鹏,王立春.盐碱胁迫对植物的影响及提高植物耐盐碱性的方法[J].东北农业科学,2018,43(4):11-16.
[7]赵斌,何绍江.微生物学试验[M].北京:科学出版社,2002.
[8]ChenC,XinK,LiM,etal.Paenibacillussinopodophyllisp.nov,asiderophore-producingendophyticbacteriumisolatedfromrootsofSinopodophyllumhexandrum(Royle)Ying[J].InternationalJournalofSystematicandEvolutionaryMicrobiology,2016,66(12):4993-4999.
[9]GlickmannE,DessauxY.AcriticalexaminationofthespecificityoftheSalkowskireagentforindoliccompoundsproducedbyphytopathogenicbacteria[J].AppliedEnvironmentalMicrobiology,1995,61(2):793-796.
[10]龚记熠,唐明,张习敏,等.Hoagland营养液对漂浮育苗辣椒的影响[J].分子植物育种,2017,15(8):3244-3253.
[11]LiX,GengX,XieR,etal.Theendophyticbacteriaisolatedfromelephantgrass(PennisetumpurpureumSchumach)promoteplantgrowthandenhancesalttoleranceofhybridPennisetum[J].BiotechnologyforBiofuels,2016,9:190-201.
[12]傅蕾,李霞,高璐,等.盐胁迫下泛菌属内生细菌对杂交狼尾草发芽及生理的影响[J].草业科学,2017,34(10):2099-2108.
[13]ChenL,LiuY,WuJ,etal.InducedmaizesalttolerancebyrhizosphereinoculationofBacillusamyloliquefaciensSQR9[J].PhysiologiaPlantarum,2016,158:34-44.
[14]潘多锋,申忠宝,王建丽,等.碱性盐胁迫对偃麦草苗期生长的影响[J].草业科学,2016,33(11):2276-2282.
[15]許芳芳,袁立敏,邵玉芳,等.肠杆菌FYP1101对盐胁迫下小麦幼苗的促生效应[J].微生物学通报,2018,45(1):102-110.
[16]LuoS,WanY,XiaoX,etal.IsolationandcharacterizationofendophyticbacteriumLRE07fromcadmiumhyperaccumulatorSolanumnigrumL.anditspotentialforremediation[J].AppliedMicrobiology&Biotechnology,2011,89(5):1637-1644.
[17]闫先喜,赵檀方,胡延吉.中度盐胁迫对大麦根尖细胞的影响[J].华北农学报,1994,9(增刊):61-64.
[18]杨晓慧,蒋卫杰,魏珉,等.植物对盐胁迫的反应及其抗盐机理研究进展[J].山东农业大学学报(自然科学版),2006,37(2):302-305,308.
[19]韩坤,田曾元,郭予琦.具有ACC脱氨酶活性的海滨锦葵(Kosteletzkyapentacarpos)内生细菌对小麦耐盐性的影响[J].植物生理学报,2015,51(2):212-220.
