一株小麦赤霉病拮抗菌的筛选鉴定及防治效果分析
2019-07-02周清舒宪王钰婷李明浩汤才国倪军赵薇薇黄胜威吴丽芳
周清,舒宪,王钰婷,李明浩,汤才国,倪军,赵薇薇,黄胜威,*,吴丽芳,*
1.中科院强磁场与离子束物理生物学重点实验室,国家林业局能源林研究中心,合肥 230031
2.中国科学技术大学,合肥 230026
3.安徽省环境毒理与污染控制技术安徽省重点实验室,合肥 230031
4.安徽省农业科学院蚕桑研究所,合肥 230001
0 前言
小麦赤霉病(Fusariumhead blight,FHB)主要由禾谷镰刀菌(Fusarium graminearum)引起,是我国小麦生产中的主要病害,也是世界性的小麦种植病害之一[1]。该病多发生在潮湿和温暖地区,给小麦产量造成严重损失的同时,还可以产生以脱氧雪腐镰刀菌烯醇(DON,呕吐毒素)为主的多种真菌毒素,严重危害人类和家畜的健康[2]。长期以来,我国小麦赤霉病的发生主要集中在长江中下游、华南麦区及东北春麦区。但近些年来,随着气候变化和耕作制度的改变,小麦赤霉病的发生区域也逐渐扩大,逐渐向北扩展蔓延。目前已成为制约我国小麦生产的一种重要病害,且呈逐年加重趋势,成为我国农业科技工作者高度关注的一类病害[3]。
对于小麦赤霉病的防治,现阶段仍然主要依靠化学农药。以多菌灵及其复配剂为主[3],其他制剂,如70%甲基硫菌灵WP[4]以及30%多·酮WP[5]等新型药剂用于防治小麦赤霉病也有报道。然而,长期使用化学杀菌剂,已经引起一系列问题,如农药残留,环境污染和导致病原菌抗药性增加[2-3]。由于目前尚无高抗赤霉病的小麦品种出现,因此生物防治成为化学防治之外防控小麦赤霉病的最佳选择,有着广泛的实践意义。目前,国内外赤霉病拮抗微生物的研究主要集中在芽孢杆菌和链霉菌等少数几种类群的细菌,如枯草芽孢杆菌Bacillus subtilis[6,7],解淀粉芽孢杆菌Bacillus amyloliquefaciens[8,9],多黏类芽孢杆菌Paenibacillus polymyxa[10],马来西亚链霉菌Streptomyces malaysiensis[11]等。关于其他生防微生物的研究相对较少,这也在一定程度上限制了拮抗微生物在小麦赤霉病防控方面的应用。
本文报道了从麦田土壤中分离到的一株对小麦赤霉病病菌有较强抑制效果的拮抗细菌-奇异变形杆菌Proteus mirabilis,并研究了该菌株对禾谷镰刀菌菌丝生长,孢子萌发的抑制以及在田间对赤霉病的拮抗效果,以期为小麦赤霉病的生物防治提供理论依据。
1 材料与方法
1.1 试验材料
供试病原菌禾谷镰刀菌(Fusarium graminearumSchw.)由本室分离保存。
PDA 培养基用于禾谷镰刀菌培养及拮抗菌对峙培养;NA 液体培养基、NB 固体培养基用于拮抗细菌培养观察。CMC 培养基(CMC 15 g·L-1,NH4NO3·7H2O 0.5 g·L-1,酵母提取物1 g·L-1,H2O 1000 mL)用于分生孢子培养。
1.2 试验方法
1.2.1 小麦赤霉病拮抗菌的分离与筛选
自小麦赤霉病发病田块采集表层土壤(10—15 cm处土壤)。过2 mm 不锈钢筛后,称取10 g 土壤样品,放入盛有90 mL 无菌水的三角瓶(底部盛有灭菌玻璃珠),200 rpm 震荡1 h,制成土壤悬液。吸取1 mL土壤悬液,采用灭菌水梯度稀释101—109倍。随后,分别吸取各稀释度土悬液0.1 mL,均匀涂布于NB固体培养基平板上,28 ℃恒温培养2—3 d。待菌落长出后,挑取不同形态的单菌落至NB 固体培养基平板上,划线培养,连续划线3—4 次,4 ℃保存待用。
拮抗细菌筛选采用平板对峙法[2]进行。将禾谷镰刀菌(指示菌)在PDA平板上活化,采用直径5 mm 的打孔器在菌落边缘制备菌饼,接种于空白PDA 平板中央,同时在其周围距中央25 mm 位置接种待测细菌菌株。每皿接种4 种待测细菌菌株,每个处理3 次重复。以单接禾谷镰刀菌为对照,28℃恒温培养,待对照禾谷镰刀菌充满培养皿后测量菌落直径,计算抑菌率。
抑菌率(%)=(对照菌落直径-处理菌落直径)/对照菌落直径×100。
选取抑菌率最高的细菌菌株,用于随后的进一步研究。
1.2.2 小麦赤霉病拮抗菌的鉴定
生理生化鉴定:参照《常见细菌鉴定手册》[12],对拮抗细菌进行革兰氏染色、运动性观察、接触酶反应、氧化酶反应、甲基红试验反应、吲哚反应、糖类发酵试验、酪氨酸水解试验、利用柠檬酸盐试验、丙二酸盐利用试验等生理生化指标测定。
分子生物学鉴定:拮抗菌株在NA 液体培养基中培养24 h,用EasyPure Bacteria Genomic DNA Kit(北京全式金生物技术有限公司,北京,中国)提取基因组DNA,用27F和1492R引物扩增16S rRNA基因片段。PCR 产物连接至pEASY-T1 载体,阳性克隆子送交生工生物工程(上海)股份有限公司进行测序。菌株16S rDNA 序列与NCBI(国家生物技术信息中心,www.ncbi.nlm.nih.gov)数据库中的已发表序列进行比对[13],并采用Mega 7.0 软件中的最大似然法分析分离拮抗菌株的16S rRNA 基因与相似种属的进化关系,Bootstrap 值设为1000[14]。同时,将菌株16S rDNA 序列提交到GenBank 数据库。
1.2.3 拮抗细菌对赤霉菌孢子萌发,菌丝生长及DON 产生的抑制
1) 孢子萌发抑制效果研究
采用 CMC 培养基培养禾谷镰刀菌(F.graminearumSchw.),获得孢子悬浮液。5000 rpm 离心3 min,收集孢子,然后分别加入拮抗细菌1 mL培养液、拮抗细菌无细胞上清液和拮抗细菌细胞内含物。接种1 mL 空白NB 培养基的处理作为对照。所有处理在25°C 下孵育72 h,检查计算孢子的发芽率。每个处理三次重复。
2) 菌丝生长抑制效果研究
将10 mL 空白NB 培养基、10 mL 无细胞上清、以及10 mL 拮抗细菌细胞内含物分别与90 mL 的PDA 混合,混匀后倒平板。采用直径5 mm 的打孔器在活化的禾谷镰刀菌(F.graminearumSchw.)菌落边缘打取菌饼,将直径5 mm 的菌丝体接种于培养皿的中央,28 ℃下培养5 天,然后测量禾谷镰刀菌菌落直径。采用下列公式计算抑制率:
抑制率(%)=(C-E)/C×100%,其中C为对照菌落直径,E为处理菌落的直径。
3) DON 产生抑制效果研究
选取10 g 健康干燥的小麦籽粒,装入250 mL 锥形瓶中,灭菌。处理组加入3 mL 拮抗细菌无细胞上清或3 mL拮抗细菌新鲜培养液,对照组加入3 mL空白NB 培养基。处理组和对照组均加入1 mL 禾谷镰刀菌(F.graminearumSchw.)分生孢子悬浮液(1×105CFU·mL-1),置于28℃下培养。培养20 天后,取出处理组和对照组小麦籽粒,液氮研磨,加入25 mL 84%的甲醇水溶液并剧烈震荡2 小时,12000 rpm 离心10 分钟,收集上清液。沉淀采用甲醇水溶液重新提取,合并两次上清液,0.22 μm 过滤器过滤。滤液采用高效液相色谱法(HPLC)检测DON 含量。色谱柱为Kromasil C18 色谱柱,流动相为80%甲醇水溶液,流速1 mL·min-1,检测波长218 nm,以峰面积计算抑制率。
1.2.4 拮抗细菌防治赤霉病田间试验
田间试验于2017年在中国安徽省合肥市蜀山区中国科学院合肥物质科学研究院技术生物与农业工程研究所试验田进行。试验小区面积6 m2(2×3 m),每个处理3 个重复,小区采用随机区组设计。
拮抗菌对温室中麦苗赤霉病防治效果测定参考王瑶等[14]方法进行。采用 PBS 缓冲液,制备F.graminearum分生孢子悬浮液和拮抗菌株DY05 菌悬液。在小麦扬花期,采用空气喷雾器,将200 mLF.graminearum分生孢子悬浮液(5×105CFU·mL-1)均匀喷施于小麦穗中间的小花中。处理组随后用200 mL 浓度为108CFU·mL-1的菌株DY05菌悬液喷洒小麦穗中间的小花中,对照组喷以200 mL 新鲜PBS 缓冲液。接种后,用塑料薄膜覆盖,72 h 后去掉塑料薄膜。处理21 天后,调查所有试验小区小麦,每小区选取300 个麦穗,统计发病严重度,计算FHB疾病发病率。其中,发病率=发病麦穗数/总麦穗数,发病程度=小麦病粒数/小麦总粒数,病情指数=发病率×发病程度/100。
1.2.5 拮抗细菌促生长特性试验
1) 室内实验
在28℃条件下,测定拮抗菌株的植物促生长能力,包括溶磷能力,产铁载体、产吲哚乙酸(IAA)、氢氰酸(HCN)和ACC 脱氨酶活性。溶磷能力测定采用NBRIP 培养基,参照Rodrigues 等[16]方法测定。 铁载体测定采用CAS 检测法[17],初步测定菌株合成铁载体的能力。溶液颜色变黄,表明有铁载体生成。生长激素IAA 测定参照Glickmann 和 Dessaux[18]介绍的方法,测定菌株分泌IAA 的能力。ACC 脱氨酶活性和HCN 产生能力测定参照文献[19]测定。
2) 盆栽实验
将健康饱满的小麦种子表面消毒(70%乙醇浸泡1 min,1%次氯酸钠浸泡5 min),然后用灭菌蒸馏水洗涤5 次。消毒后的种子转移至无菌烧杯中,用纱布保湿保温,放入37 ℃培养箱中继续培养2 d(注意补充水分,保持湿润)。种子露白后,挑选长势均一的小麦种子,进行下一步试验。
处理组选取30 粒萌发的小麦种子,用100 mL 浓度为108CFU·mL-1的拮抗菌株新鲜培养液浸泡24 h,对照组选取30 粒清洗过的小麦种子,采用100 mL新鲜空白NB 培养基浸泡24 h。随后,将对照组和处理组小麦种子栽培于花盆中(花盆规格:上口径17 cm,下口径11.7 cm,盆高14 cm,每盆装500 g 营养土,170 g 珍珠岩,100 mL 水),每盆6 粒,注意补足水分。在25 ℃的温室中,16:8 的昼夜光周期下培养30 d 后,测定小麦根长和株高,湿重,随后将小麦根、茎105 ℃杀菌30 min,于80 ℃烘干至恒重,称量干重。
1.3 数据处理
每组试验重复3 次,采用SPSS 17.0 对数据进行分析处理,并用单因素方差分析的LSD 法进行显著性分析(P< 0.05)。
2 结果与分析
2.1 拮抗细菌分离及鉴定
从田间采集的样品中共分离纯化出35 株细菌。将这35 株菌株分别接种到PDA 培养基上,同禾谷镰刀菌进行对峙试验。其中,菌株DY05 对禾谷镰刀菌具有明显拮抗作用(图1),靠近菌株DY05 菌落的禾谷镰刀菌菌丝体生长受到抑制,不能正常外延生长,出现明显的抑菌带。选取该菌株进行后续研究。
参照《常见细菌鉴定手册》,对拮抗菌株DY05进行生理生化鉴定,测定结果如表1所示。
为进一步确定菌株的分类地位,将扩增出的16S rDNA 片段测序。扩增片段序列长度为1504 bp,相应的序列提交至GenBank (登陆号MH050359) 。以16S rDNA 序列同源性为基础构建系统发育树,结果显示,DY05 与奇异变形杆菌Proteus mirabilis聚在同一分支,序列同源性高达99%。结合生理生化鉴定结果,菌株DY05 被鉴定为奇异变形杆菌P.mirabilisDY05。
2.2 拮抗细菌对禾谷镰刀菌孢子萌发,菌丝生长及DON 产生的抑制
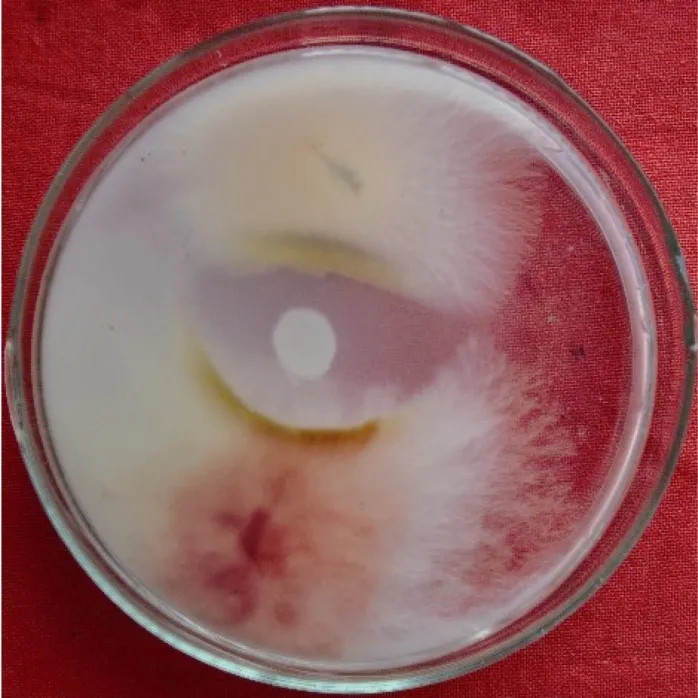
图1 拮抗株菌DY05 对禾谷镰刀菌的拮抗作用 Figure1 Antifungal activities of DY05 against F.graminearum in plate tests
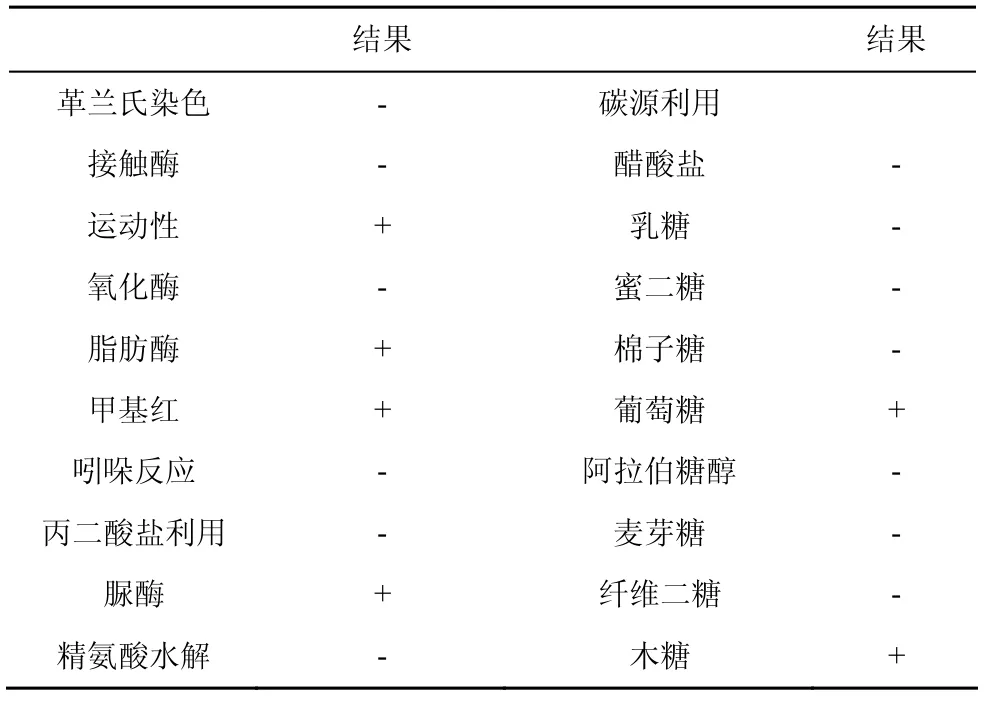
表1 菌株DY05 部分生理生化试验结果 Table1 Physiological and biochemical characteristic of the bacterial isolate DY05
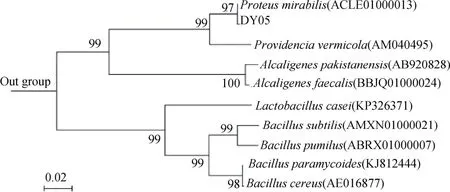
图2 基于菌株DY05 16S rDNA 序列的系统发育分析 Figure2 Phylogenetic tree of the strain DY05 based on 16S rDNA sequences
拮抗细菌P.mirabilisDY05 对禾谷镰刀菌孢子萌发,菌丝生长及DON 产生的抑制效果如表2所示。其中,P.mirabilisDY05 菌株培养液和无细胞上清液对禾谷镰刀菌的孢子萌发的抑制效果均达到100%,对菌丝生长抑制率也分别达到79.50%和 51.25%,表现出良好的生防潜力。与此同时,DY05 菌株细胞内含物对孢子萌发和菌丝生长的抑制效果相对较差,分别为19.7%和8.75%,表明该菌株起拮抗效果的物质主要存在于上清中而不是存在于胞内。
此外,DON 产生抑制试验结果表明,DY05 菌株培养上清液处理可以显著减少DON的产生,与对照组相比,DON 含量减少了82.82%。
2.3 拮抗细菌对麦苗赤霉病防治效果测定
由表3可知,菌株DY05发酵液处理可以显著降低赤霉病发病率和严重度。拮抗菌株DY05 处理后,小麦赤霉病的发病率为11.68%,与对照组的发病率24.40%相比,发病率降低了52.13% (p<0.05)。同时,菌株DY05 处理组小麦赤霉病病情指数与对照组相比,也降低了48.74%,差异显著。表明拮抗细菌DY05 发酵液原液对小麦赤霉病有较好的防治效果,能增强小麦的赤霉病抗性。
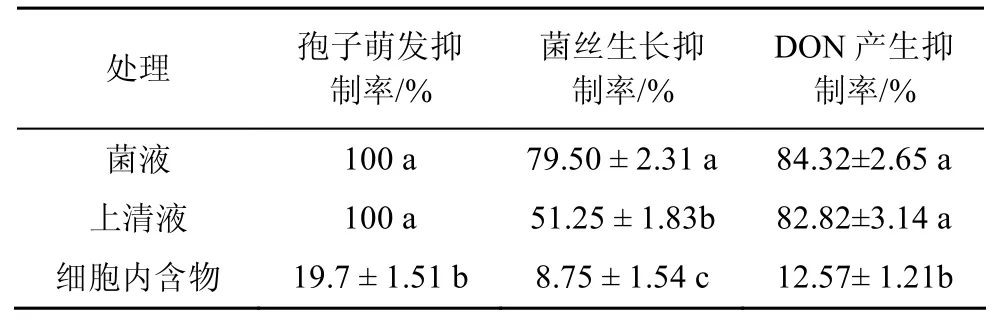
表2 菌株DY05 对禾谷镰刀菌孢子萌发和菌丝生长的抑制作用 Table2 Inhibition activity of culture supernatant,cell lysate and cells of strain DY05 on spore germination of F.graminearum
2.4 拮抗菌株促生长特性
菌株DY05 的促生长特性如图3所示。由图3可以看到,该菌株不能产生HCN,但是可以产生铁载体和IAA,并具有溶磷作用和ACC 脱氨酶活性,说明该菌株具有很好的促生长潜力。
盆栽试验结果显示,菌株DY05 对小麦植株生长具有显著的促进作用(表4)。与对照组相比,菌株DY05 处理可以显著提高小麦幼苗茎高、根长、鲜重和干重,其中茎高、根长、鲜重和干重分别提高了22.21%、26.41%、44.77%和26.53%。

表3 菌株DY05 对小麦赤霉病田间防治效果 Table3 Efficacy of DY05 on Fusarium head blight on winter wheat in field trial

图3 拮抗菌株DY05 的促生长特性(A:产铁载体能力试验;B:产IAA 能力试验;C:产HCN 能力试验;D:溶磷能力试验;E:ACC 脱氨酶活性试验) Figure3 Characterization of plant growth-promoting traits strain DY05 (A:siderophore synthesis test;B:test of IAA production ability;C:HCN capacity;D:phosphate solubilizing;E:ACC deaminase activity).

表4 盆栽试验中菌株DY05 对小麦幼苗生长的促进作用 Table4 Growth promotion effects of strain DY05 on wheat seedlings in pots
3 讨论
近年来,国内外研究者在小麦赤霉病拮抗菌分离鉴定及抗病特性研究等方面做了大量的工作,从各种生态环境中分离得到多株对禾谷镰刀菌等病原真菌具有拮抗作用的菌株。已获得的拮抗菌株中,以细菌居多,而研究最多的为芽孢杆菌和放线菌[15],如枯草芽孢杆菌(Bacillus subtilis)、解淀粉芽孢杆菌(Bacillusamyloliquefaciens)、贝莱斯芽孢杆菌(Bacillus velezensis)[20],微白黄链霉菌(Streptomyces albidoflavus)[21]。关于其他类群细菌对禾谷镰刀菌的拮抗作用的相关研究相对较少,有待进一步去发掘利用。本研究从土壤中分离出一株对禾谷镰刀菌具有拮抗作用的细菌,经鉴定属于奇异变形杆菌Proteus mirabilisDY05。奇异变形杆菌属于革兰阴性菌,没有荚膜和芽孢,有鞭毛和菌毛的,在自然界、动物粪便以及人和动物的肠道内广泛存在。目前,尚无该菌拮抗禾谷镰刀菌的报道。
孢子和菌丝生长抑制试验结果表明,拮抗菌株DY05 可明显抑制禾谷镰刀菌菌丝体生长和分生孢子萌发。陈亮等[9]研究发现,解淀粉芽孢杆菌(Bacillus amyloliquefaciens)可显著抑制禾谷镰刀菌菌丝体生长和分生孢子萌发,引起菌丝体畸形、细胞膜损伤。刘伟成等[22]研究了8 株芽孢杆菌对禾谷镰刀菌的拮抗作用,发现芽孢杆菌对病原菌分生孢子萌发抑制机理主要为抑制孢子萌发和芽管伸长,以及诱使分生孢子芽管顶端细胞膨大呈球状,失去生长能力。本研究中,拮抗菌株DY05 对禾谷镰刀菌的抑制作用,是否也是通过损伤禾谷镰刀菌细胞膜和孢子膜,从而导致菌丝体生长畸形,分生孢子萌发受到抑制,还有待进一步研究。同时,研究还发现,拮抗菌株DY05 产生的抑菌物质存在于发酵液中,其无细胞上清对禾谷镰刀菌有较强拮抗作用。宗英等[20]研究表明,贝莱斯芽孢杆菌JS25R 发酵液对禾谷镰刀菌菌丝生长和孢子萌发具有很好的抑制作用,推测起作用的活性物质可能为抗菌蛋白。李峰等[23]研究发现,多粘类芽孢杆菌(Paenibacillus polymyxa)的无菌发酵滤液对禾谷镰刀菌菌丝生长有明显抑制作用,导致菌丝生长发生畸形,出现原生质体凝集、菌丝断裂和细胞壁瓦解现象,且推测该菌产生的拮抗化合物可能是蛋白类或肽类物质。蔺国强等[24]研究发现,解淀粉芽孢杆菌X-42 发酵液中的脂肽类物质,能直接破坏禾谷镰刀菌菌丝结构,也能影响分生孢子萌发,导致菌丝及孢子局部膨大。拮抗菌株DY05 产生的抑菌物质是脂肽类物质,或者为抗菌蛋白,还有待进一步深入研究。
生物防治的关键是在田间条件下发挥作用,室内拮抗效果良好的菌株,受田间环境条件影响,其拮抗效果有可能会降低,因此,需要系统化进行田间试验,以验证菌株的实际生防效果。田间小麦赤霉病防治试验结果显示,DY05 在田间接种小麦赤霉菌孢子后施用,可以有效控制小麦赤霉病,为在小麦生产上应用DY05 防控赤霉病提供了理论依据。蔺国强等[24]应用解淀粉芽孢杆菌X-42 防治小麦赤霉病,发现接种小麦赤霉菌孢子前或接种后施用X-42,均可以有效控制小麦赤霉病发生,显示了良好的应用潜力。近些年来,小麦赤霉病已经成为我国长江中下游冬麦区和东北部春麦区最严重的流行病害之一[2]。喷施多菌灵,一直是生产上防治小麦赤霉病的主要措施。然而,越来越多的研究结果显示,多菌灵等化学农药可以诱导病原菌产生抗药性,并且能够促进DON 毒素的合成,导致我国赤霉病的状况愈发严重和广泛[25]。因此,开发环境友好,替代多菌灵的防控措施,已经成为摆在小麦赤霉病防控工作者面前一个亟待解决的难题。本研究筛选得到的拮抗菌株DY05,在室内菌丝生长抑制试验和田间小麦赤霉病防治试验中均表现出良好的防治效果,为进一步开发生物防控赤霉病菌剂提供了优良材料。
目前,关于禾谷镰刀菌拮抗细菌的研究,多集中在菌株分离鉴定,拮抗效应评价及活性组分分离纯化等方面,关于拮抗细菌的促生长效果研究较少。已有的研究结果显示,植物生长促进细菌(PGPB)或植物生长促进的根际细菌(PGPR),可以刺激植物生长,增加产量,减少病原体感染以及生物或非生物植物胁迫[26]。与促进植物生长相关的性质包括:IAA 和铁载体的产生,固氮,植物病原拮抗作用,氰化作用,磷酸盐的溶解以及氨基环丙烷-1-羧酸酯(ACC)脱氨酶活性的产生。促生长特性试验表明,拮抗菌株DY05 可以产生铁载体和IAA,并具有溶磷作用和ACC 脱氨酶活性,表明该菌株具有很好的促生长潜力。盆栽实验也显示,小麦的茎高、根长、鲜重和干重有明显的上升。这些研究结果表明,拮抗菌株DY05 具有拮抗病原真菌和促进植物生长的双重功能,从而能够在控制植物病害发生的同时,增加产量,具有开发成商业生物防治制剂运用于小麦生产的潜力。
