血清miRNA-10a 与IL-35 水平对脓毒症诱导急性肾损伤患者预后评估价值
2019-07-02朱先华
朱先华
脓毒症是一种严重危及生命、预后较差的临床危重症,短期预后死亡率近三分之一[1]。脓毒症患者由于全身炎性反应综合征,诱发多器官功能障碍综合征,最后导致多器官功能衰竭,其中脓毒症导致的急性肾损伤(acute kidney injury,AKI)最为多常见,也是导致患者预后结局不良的主要病因之一[2]。寻找有效、便捷的早期诊断及判断预后的血清学指标,对于临床有效阻止脓毒症诱导AKI 的发生,改善患者预后具有重要意义[3]。目前临床常用降钙素原(procalcitonin,PCT)、肾损伤分子1(kidney injury molecule-1,KIM-1)、胱抑素C(cystatin C,Cys-C)、序贯器官衰竭评分(sequential organ failure assessment,SOFA)等指标来早期评估脓毒症诱导AKI 发生,但是对于评估患者病情及预后的准确度较差,因此寻找更准确的血清指标仍是临床热点问题[4]。临床研究显示,微小RNA-10a(miRNA-10a)及白细胞介素-35(interleukin-35,IL-35)对于脓毒症病情评估具有一定的临床价值[5],但是血清miRNA-10a 及IL-35 水平对脓毒症诱导AKI 患者预后的评估价值尚未见报道,故本研究对此探讨。
1 资料与方法
1.1 临床资料 选取2016 年6 月—2018 年6 月在浙江省临海市第一人民医院ICU 住院治疗的脓毒症患者90 例作为研究对象,其中男44 例,女46 例,平均年龄(56.7±10.9)岁;所有研究对象按有无AKI 发生分为两组,观察组42 例,对照组48 例。本研究符合临床试验研究法规及赫尔辛基宣言,通过本院伦理委员会审核,未对研究对象造成有害或不利的损害,研究结果对患者诊疗有益,纳入研究过程完全尊重患者或其直系亲属及监护人的意见,研究过程中遵从自愿原则。患者直系亲属或监护人均书面签署知情同意书。
1.2 纳入、排除标准 纳入标准:(1)符合2001 年国际脓毒症释义会议确定的脓毒症诊断标准[6];(2)符合阿姆斯特丹AKI 合作研究会确定的AKI 诊断标准[7]。排除标准:(1)合并有自身免疫性疾病或接受免疫调节治疗;(2)合并恶性肿瘤晚期或严重脏器功能不全;(3)研究期内不能坚持随访,临床资料不完整者。
1.3 血清标记物检测 两组患者检查时间点选择为入院即刻、治疗后第3、7、14 及28 天,均于清晨空腹抽外周血3~5mL,应用2000r/min 转速离心10min,分离得血清采用酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测样本IL-35 以及PCT 浓度,测定IL-35 以及PCT 所用ELISA 试剂盒均购自美国BD 公司,操作流程依据ELISA 试剂盒说明书逐步进行。采用免疫比浊法测定血清Cys-C水平,采用双抗体夹心酶标免疫分析法测定血清KIM-1 水平,Cys-C 及KIM-1 测定试剂盒购自上海晶抗生物工程有限公司。血清肌酐(serum creatinine,Scr)浓度由检验科用全自动生化分析仪检测。
1.4 血清miRNA-10a 检测 采用实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)技术检测血清miRNA-10a 表达水平。两组患者均于入院即刻、治疗后第3、7、14 及28 天,抽取5mL 外周血样本,采用miRNA 检测试剂盒(购自美国Invitrogen 公司)提取血清miRNA,再采用逆转录试剂盒(购自美国Fermentas 公司)逆转录成cDNA 链,依据检测试剂盒说明书进行具体操作流程。内参为小核RNA U6(snRNA U6),上游引物:5’-CTCGCTTCGGCAGC ACA-3’,下游引物:5’-AACGCTTCACGAATTTGCG T-3’。miRNA-10a 上游引物:5’-GGAGGGGTACCAGAATCCCATTTTGGCCA-3’,下游引物:5’-GGAGG AAGCTTGCGGAGTGTTTATGTCAACT-3’。
PCR 反应体系和条件按照试剂盒说明书确定,具体为:预变性95℃、5min;95℃、10s 变性,60℃、20s退火,72℃、20s 延伸,40 个循环。以2-ΔΔCt 表示观察组miRNA-10a 相对于对照组的表达水平,ΔCt=Ct目标-Ct 内参。
1.5 序贯器官衰竭评分 两组均进行全身性感染相关性器官功能衰竭评分(sepsis related organ failure assessment,SOFA),主要分为呼吸(PaO2/FiO2、呼吸支持)、凝血系统(血小板)、肝功能(胆红素)、循环系统(平均动脉压、多巴胺、肾上腺素、去甲肾腺素、多巴酚丁胺剂量)、神经系统评分、肾脏系统(肌酐、24h 尿量)六部分组成,其中每项分值为0~4 分,总分值0~48 分,分数越高,预后越差。SOFA 评分由两名ICU专科副主任医师进行评估。
1.6 预后分析 所有纳入研究患者出ICU 后均通过电话询问方式随访3 个月,随访间隔1 个月。记录死亡例数以及各自死亡原因,其中死亡主要原因为多器官功能衰竭12 例、急性肾衰竭9 例、全身炎症反应8 例、DIC 5 例。根据患者随访期间预后结局分为两组,生存组56 例,死亡组34 例。
1.7 统计学方法 应用SPSS 21.0 统计软件。符合正态分布且齐性检验的计量资料以均数±标准差(±s) 表示,不同时间点血清指标动态水平比较采用重复测量数据的方差分析,生存组与死亡组治疗第1天血清miRNA-10a 与IL-35 水平比较采取成组t 检验。计数资料以频次或百分比表示,比较采用χ2检验。采用Pearson 相关分析分别评估血清miRNA-10a、IL-35 与PCT、Scr、KIM-1、Cys-C 及SOFA 评分间的相关性。应用多元Logistic 回归分析上述指标与生存率的相关性。应用受试者工作特征曲线(ROC)方法评估血清miRNA-10a 与IL-35 水平对患者预后的评估价值。P<0.05 为差异有统计学意义。
2 结 果
2.1 两组一般资料比较 观察组42 例,男20 例,女22 例,平均年龄(55.1±8.8)岁,体质指数(BMI,18.7±2.1)kg/m2;对照组48 例,男24 例,女24 例,平均年龄(57.7±11.3)岁,BMI(17.9±1.5)kg/m2。两组患者年龄、性别、体质指数等一般资料比较,差异无统计学意义(P>0.05)。

表1 两组脓毒症诱导急性肾损伤患者不同时间点血清指标动态水平比较(x±s)
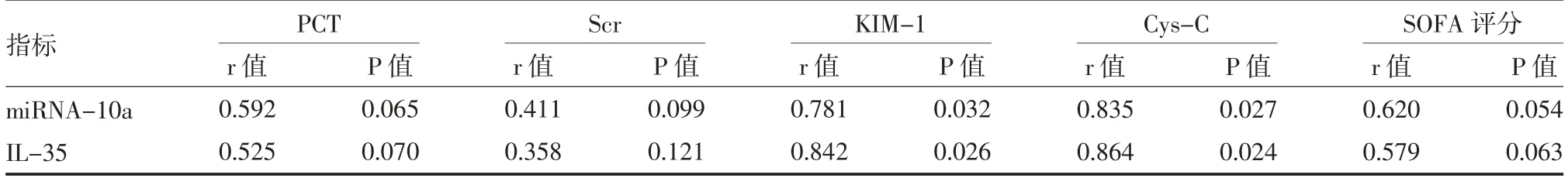
表2 脓毒症诱导AKI 患者各指标相关性分析
2.2 两组不同时间点血清指标水平比较 与入院即刻比较,对照组不同时间点间血清PCT 及SOFA 评分差异有统计学意义(P 均<0.05),血清miRNA-10a、IL-35、Scr、KIM-1、Cys-C 差异无统计学意义(P均>0.05);观察组不同时间点间血清miRNA-10a、IL-35、PCT、Scr、KIM-1、Cys-C 及SOFA 评分自治疗第3 天始随治疗时间延长逐渐降低(P 均<0.05);观察组与对照组各时间点血清miRNA-10a、IL-35、Scr、KIM-1 及Cys-C 水平差异有统计学意义(P 均<0.05),观察组各时间点血清PCT 水平、SOFA 评分与对照组比较,差异无统计学意义(P>0.05),见表1。
2.3 相关性分析 Pearson 相关分析显示,脓毒症诱导AKI 患者血清miRNA-10a、IL-35 分别与血清KIM-1、Cys-C 正相关(r=0.781,P=0.032、r=0.835,P=0.027;r=0.842,P=0.026、r=0.864,P=0.024),见表2。
2.4 生存组与死亡组指标比较 生存组血清miRNA-10a 与IL-35 水平显著低于死亡组(P 均<0.05),见表3。
2.5 与生存率相关因素多元Logistic 回归分析 以随访3 个月生存率为应变量,血清miRNA-10a、IL-35、PCT、Scr、KIM-1、Cys-C、SOFA 评分为自变量,应用全模型多元Logistic 回归分析方法进行回归分析,结果显示,血清miRNA-10a(OR=3.157,P=0.016)与IL-35(OR=2.426,P=0.027)为脓毒症诱发AKI 患者预后危险因素,见表4。

表3 生存组与死亡组治疗后第3 天血清指标比较(x±s)
2.6 血清miRNA-10a 与IL-35 联合诊断的ROC 曲线分析 应用ROC 曲线评估治疗第1 天血清miRNA-10a 与IL-35 预测脓毒症诱发AKI 患者的随访3 个月预后不良的价值,结果显示,血清miRNA-10a截断值为3.15,预测脓毒症诱导AKI 患者随访3 个月预后不良发生的曲线下面积(AUC)为0.783,P 值为0.042,灵敏度77.9%(95%CI:0.733~0.835),特异度82.6%(95%CI:0.793~0.854);血清IL-35 截断值为355pg/mL,预测随访3 个月预后不良的AUC 为0.806,P 值为0.037,灵敏度77.9%(95%CI:0.733~0.835),特异度90.1%(95%CI:0.733~0.835);血清miRNA-10a 与IL-35 联合检测预测脓毒症诱导AKI患者随访3 个月预后不良发生的AUC 为0.852,P 值为0.032,其预测短期预后不良的灵敏度为85.6%(95%CI:0.810~0.924),特异度为87.9%(95%CI:0.826~0.941),见图1。

表4 临床指标多元Logistic 回归分析比较
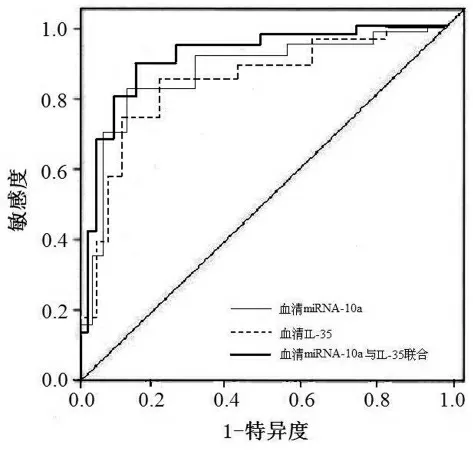
图1 治疗前血清miRNA-10a 与IL-35 水平预测脓毒症诱导AKI 患者预后的ROC 曲线
3 讨 论
脓毒症患者体内内毒素以及过量炎症介质破坏凝血-纤溶系统平衡,促使肾脏微血管内形成微血栓,降低肾小球灌注压及滤过率,导致AKI 发生[8]。脓毒症早期肾功能损害是可逆,但进展迅速,肾实质损害严重且不可逆,即便全面支持对症处理也不能改善患者预后,因此脓毒症诱导AKI 治疗的关键是早期预测、及早发现高危患者,在肾功能损害早期即予以充分有效治疗措施,能有效逆转肾功能,改善临床症状及短期预后[9]。
miRNA-10a 是调控脓毒症免疫应答水平的关键因子之一,其水平高低直接关系到患者病情发展及预后,且早期评估脓毒症病情及预后具有较好特异性和敏感性[9-10]。国外研究显示,miRNA-10a 能调节辅助性T 细胞比例,提高TNF-α 及IL-2 等炎性因子水平,调节整体免疫网络[11-12]。miRNA-10a 表达异常与脓毒症诱发AKI 的免疫失衡程度存在相关性,因此被认为是今后脓毒症诱发AKI 的重要治疗靶点[13]。IL-35 是机体免疫系统调节的重要细胞因子之一,能有效地改善多种炎症疾病病情,延缓进展。IL-35 能抑制机体炎症反应,平衡特异性免疫应答反应[14-15]。脓毒症患者循环IL-35 能抑制IL-2与IFN-γ 生成,上调IL-10 分泌及调节型T 细胞比例,对过度激活免疫系统起到抑制效应,因此被认为是脓毒症诱导AKI 治疗的重要血清标志物[16-18]。
本研究结果显示,在治疗后四个时间点,两组血清miRNA-10a、IL-35、Scr、KIM-1 及Cys-C 水平均存在差异,且观察组均高于对照组(P<0.05),提示血清miRNA-10a 与IL-35 水平能反映脓毒症患者可能发生AKI。随着治疗持续进行,各项血清指标水平也呈进行性降低,存在治疗时间的差异性,提示血清miRNA-10a 与IL-35 动态改变与脓毒症诱发AKI病情可能存在一定关系,这为监测两种指标水平变化来指导治疗方案提供临床依据[19]。目前临床评估AKI 病情的血清学指标多为KIM-1 及Cys-C,本研究直线相关分析显示,血清miRNA-10a 与IL-35 水平与血清KIM-1 及Cys-C 均呈正相关。因此血清miRNA-10a 与IL-35 对评估脓毒症诱发AKI 病情具有较好临床价值。Scr 与SOFA 评分两组患者无显著差异,同时与血清miRNA-10a 与IL-35 水平也无相关性,提示临床通过检测血清Scr 与SOFA 评分难以评估AKI 的发生[20]。
通过短期3 个月随访,生存组治疗后第1 天的血清miRNA-10a 与IL-35 水平低于死亡组,提示治疗早期血清miRNA-10a 与IL-35 水平与患者短期预后有相关性。血清miRNA-10a 与IL-35 被多元Logistic 回归分析证实是脓毒症诱发AKI 预后的危险因素,提示动态监测血清miRNA-10a 与IL-35 能早期评估脓毒症诱发AKI 患者生存状况。本研究也证实,单用血清miRNA-10a 或IL-35 预测脓毒症诱发AKI 患者的短期预后临床价值不理想,而两者联合检测的敏感性和特异性提高明显,因此诊断价值更高。
