肾衰Ⅱ号方对5/6肾切除大鼠残余肾组织凋亡相关蛋白表达的影响
2019-07-01王蒙杨柳易杨婧王琛
王蒙 杨柳易 杨婧 王琛
摘要:目的 觀察肾衰Ⅱ号方对5/6(ablation /infarction,A/I)肾切除慢性肾衰竭(CRF)大鼠残余肾组织凋亡相关蛋白表达的影响。方法 SD雄性大鼠采用5/6(A/I)肾切除术制备CRF大鼠模型,随机分为模型组、肾衰Ⅱ号方组、西药组,每组15只,另取15只大鼠作为假手术组。各组给予相应干预,60 d后Western blot检测凋亡相关蛋白p53、Bax、Cleaved-parp的表达,免疫组化检测p53、Bax蛋白的表达,透射电镜观察肾组织超微结构。结果 与假手术组比较,模型组大鼠肾皮质和肾髓质p53、Bax、Cleaved-parp蛋白表达明显升高(P<0.05);与模型组比较,各给药组大鼠肾皮质和肾髓质p53、Bax、Cleaved-parp蛋白表达明显降低(P<0.05)。免疫组化结果显示,p53、Bax蛋白表达主要位于肾小管,模型组大鼠炎性细胞浸润明显,蛋白表达较假手术组明显升高,各给药组较模型组炎性细胞浸润减轻,p53和Bax蛋白表达降低。透射电镜结果显示,假手术组大鼠肾皮质和肾髓质未见细胞凋亡,超微结构正常,模型组大鼠核固缩,细胞凋亡出现,超微结构紊乱,各给药组较模型组超微结构改善,少见细胞凋亡发生。结论 肾衰Ⅱ号方可抑制5/6(A/I)肾切除CRF大鼠细胞凋亡,其作用机制可能与下调p53、Bax、Cleaved-parp蛋白表达相关。
关键词:肾衰Ⅱ号方;慢性肾衰竭;肾间质纤维化;肾功能;凋亡;大鼠
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2019)05-0064-05
DOI:10.3969/j.issn.1005-5304.2019.05.014 开放科学(资源服务)标识码(OSID):
Abstract: Objective To observe the effects of Shenshuai Ⅱ Prescription (SSP) on the apoptosis-related protein expressions in the chronic renal failure (CRF) rats induced by 5/6 (ablation/infarction, A/I) nephrectomy. Methods SD male rats were induced CRF rat model by 5/6 (A/I) nephrectomy and were randomized into model group, SSP group and Western medicine group, with 15 rats in each group. Another 15 rats were recruited as sham-operation group. After 60 days of intervention, the apoptosis-related protein expressions of p53, Bax and Cleaved-parp were tested by Western blot, the protein expressions of p53 and Bax were tested by immunohistochemistry and renal tissue ultrastructure was observed by transmission electron microscope. Results Compared with sham-operation group, the expressions of p53, Bax, and Cleaved-parp in the renal cortex and the medulla increased significantly in model group (P<0.05). Compared with the model group, the protein expressions of p53, Bax and Cleaved-parp in renal cortex and renal medulla significantly decreased (P<0.05). The results of immunohistochemistry showed that the protein expressions of p53 and Bax were mainly located in renal tubules. The inflammatory cell infiltration was obvious in the model group, and the protein expressions were significantly higher than those in the sham-operation group. The inflammatory cell infiltration was reduced in the medicine-administered groups compared with the model group, and the protein expressions of p53 and Bax decreased. Transmission electron microscopy showed that there was no apoptosis in the renal cortex and renal medulla of the sham-operation group, the ultrastructure was normal, the model group was pyknosis, apoptosis occurred, and the ultrastructural disorder was disordered. The ultrastructure of each medicine-administered group was improved compared with the model group, and apoptosis was rare. Conclusions SSP can inhibit apoptosis in CRF rats induced by 5/6 (A/I) nephrectomy, which can be associated with down-regulation of protein expressions of p53, Bax, and Cleaved-parp.
Keywords: Shenshuai Ⅱ Prescription; chronic renal failure; renal interstitial fibrosis; renal function; apoptosis; rats
慢性肾脏病(chronic kidney disease, CKD)已经成为继心脑血管疾病、糖尿病,恶性肿瘤之后又一严重威胁人类健康的疾病。在低、中等收入国家,CKD患者的死亡率已达14.3%[1]。肾间质纤维化(renal interstitial fibrosis,RIF)是各种慢性肾脏病进展至终末期肾衰竭的共同通路和主要病理基础。随着对RIF病理机制的深入研究,发现细胞凋亡在其形成和进展中扮演着重要的促进作用。Xu等[2]发现,凋亡相关斑点样蛋白中通过内质网应激途径激活凋亡,促进RIF。Zhou等[3]报道,TAK1通过调节p38诱导的细胞凋亡促进了RIF的进展。因此,抑制凋亡可能是延缓RIF进展的有效策略。
肾衰Ⅱ号方是上海中医药大学附属曙光医院治疗慢性肾衰竭(chronic renal failure,CRF)的经验方。研究表明,肾衰Ⅱ号方能通过增加肾血流和改善氧耗,下调血管紧张素Ⅱ(AngⅡ)和上调神经型一氧化氮合酶(nNOS)蛋白的表达,保护肾功能,延缓RIF的进展[4-5]。本课题前期研究表明,肾衰Ⅱ号方能降低5/6肾切除CRF大鼠血肌酐(SCr)、血尿素氮(BUN)、血尿酸(UA)水平,升高内生肌酐清除率(CCr)[6],但肾衰Ⅱ号方是否对凋亡相关蛋白有调控作用尚不清楚。因此,本实验在前期研究基础上,观察肾衰Ⅱ号方对5/6(ablation/infarction,A/I)肾切除大鼠残余肾组织凋亡相关蛋白p53、Bax、Cleaved-parp的影响,进一步揭示本方延缓RIF机制。
1 材料与方法
1.1 动物
8周龄健康雄性SD大鼠,SPF级,体质量190~210 g,购于西普尔-必凯(上海)实验动物有限公司,动物许可证号SCXK(沪)2008-0016。饲养于上海中医药大学实验动物中心,温度(22±2)℃,12 h光照,相对湿度(55±2)%。饲料为市售固体普通饲料,饮用水为自来水,自由摄食饮水。
1.2 药物
肾衰Ⅱ号方(党参15 g,淫羊藿15 g,丹参15 g,当归15 g,制大黄15 g,黄连6 g,紫苏叶15 g,川芎15 g,桃仁15 g,虫草菌丝5 g),饮片购于上海康桥中药饮片公司。全方按临床常用剂量等比例配制,各药按一定比例配方后由上海中医药大学附属曙光医院制剂科制备成浓煎药液(6.09 g原药材/mL);氯沙坦钾片,杭州默沙东制药有限公司,批号20170414,蒸馏水制备混悬液(5.5 mg/mL)。
1.3 主要试剂及仪器
p53单克隆抗体(批号2524T)、Cleaved-parp单克隆抗体(批号9532S),美国Cell Signaling Technology公司;Bax单克隆抗体,英国Abcam公司,批号ab32503;Gapdh抗体,美国Proteintech公司,批号60004-1-Ig;HRP标记山羊抗兔或抗小鼠IgG(H+L),碧云天生物科技公司,批号A0208、A0216;电泳及转膜装置,美国BIO-RAD公司。
1.4 造模及分组
随机选取65只大鼠制备5/6肾切除CRF大鼠模型[7]。适应性喂养1周,2%戊巴比妥钠(0.2 mL/100 g)腹腔注射麻醉,固定于恒温手术台上,局部剃毛常规消毒,于左肋弓下0.5 cm、脊柱向左旁开1 cm處切开一垂直于脊柱长约1.5 cm切口。在无菌条件下经后腹膜选取左肾并暴露肾脏,将肾包膜分离后,把左肾动脉的2/3分支结扎(单个结扎后支及前降支),缝合,1周后摘除右肾。剔除造模失败和死亡大鼠后,造模成功存活45只,造模成功率为69%。将45只成模大鼠分为9笼,编号1~9,每笼5只,编号1~5。分别测量每只大鼠体质量,利用SPSS19.0软件建立数据库,录入笼号和编号,并以体质量作为变量,通过设定随机种子、产生随机数、对随机数编秩、对随机数秩次排列、随机确定等步骤确定1~15为模型组,16~30为肾衰Ⅱ号方组,31~45为阳性药组,每组15只。另取15只大鼠作为假手术组。
1.5 干预
按60 kg成人标准体质量常规用量的20倍给药,阳性药组予氯沙坦钾混悬液(5.5 mg/mL)灌胃,肾衰Ⅱ号方组予肾衰Ⅱ号方浓煎药液灌胃,药物灌胃剂量参照本课题组既往研究用量[5],给药体积2 mL。假手术组和模型组给予生理盐水2 mL灌胃。每日1次,连续60 d。干预期间自由摄食饮水。
1.6 检测指标
1.6.1 样本采集与处理
2%戊巴比妥钠(0.2 mL/100 g)大鼠腹腔注射麻醉,打开腹腔,下腔静脉采血,4 ℃、4000 r/min离心10 min,收集血清。摘取左肾,将左肾横切为二,一半取5块1 mm×1 mm×1 mm组织置于电镜固定液,剩余组织置于10%中性缓冲福尔马林液,固定24 h,石蜡包埋,切片(厚约3 μm),行免疫组化检测;一半沿皮髓交界线切开分离皮髓部,分装后放入液氮,置于-80 ℃冰箱保存,用于Western blot检测。
1.6.2 Western blot检测
每组随机选取6个样本,每20 mg组织加0.2 mL lysis buffer (RIPA∶PMSF=100∶1),每个2.0 mL EP管中加入1个直径5 mm钢珠,置于匀浆机充分裂解, 4 ℃、13 000 r/min离心10 min,将上清液转至1.5 mL EP管,4 ℃、13 000 r/min离心5 min,BCA法测定蛋白浓度,制备蛋白样品,100 ℃、5 min煮沸变性,置于-20 ℃冰箱保存。按30 μg/孔蛋白上样量,8%SDS-聚西烯酰胺凝胶电泳,120 V电泳,湿转法以100 V、120 min转膜,与5%脱脂奶粉室温封闭20 min,p53抗体(1∶1000)、Bax抗体(1∶1000)、Cleaved-parp抗体(1∶1000)、GAPDH抗体(1∶2000)与4 ℃摇床100 r/min过夜,HRP标记山羊抗兔或HRP标记山羊抗小鼠1∶1000室温100 r/min离心,孵育2 h,0.01%PBS-T清洗10 min/次,3次,ECL发光,暗室曝光。条带吸光度值以GAPDH作为内参照。
1.7 统计学方法
采用SPSS19.0统计软件进行分析。计量资料以±s表示,多样本均数两两比较采用方差分析,多重比较若方差齐则用LSD法,方差不齐者经对数转换,使方差齐后再用LSD多重比较。P<0.05表示差异有统计学意义。
2 结果
2.1 一般状况
干预60 d后,各组均有15只大鼠存活。假手术组大鼠反应灵敏,皮毛光泽,精力旺盛,一般状态良好;模型组大鼠精神萎靡不振,皮毛无光,活动、进食减少,体质量增加缓慢;肾衰Ⅱ号方组、阳性药组大鼠精神较前明显改善,食欲旺盛,活动量增多,体质量增加明显,肾衰Ⅱ号方组整体改善最为明显。
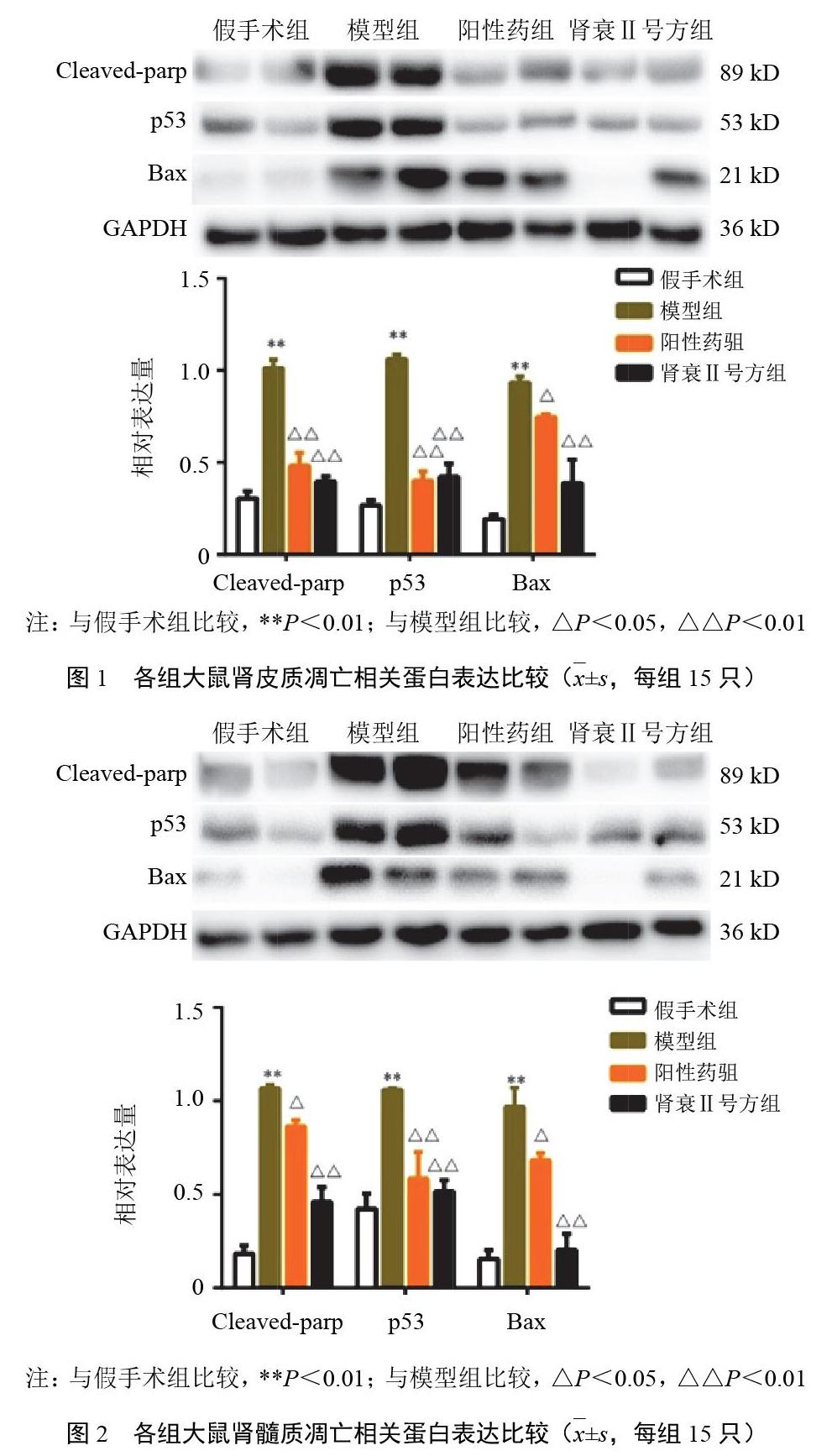
2.2 肾衰Ⅱ号方对模型大鼠残余肾组织凋亡相关蛋白p53、Bax、Cleaved-parp表达的影响
与假手术组比较,模型组大鼠肾皮质和肾髓质p53、Bax、Cleaved-parp蛋白表达明显升高(P<0.05);与模型组比较,各给药组大鼠肾皮质和肾髓质p53、Bax、Cleaved-parp蛋白表达明显降低(P<0.05)。结果见图1、图2。
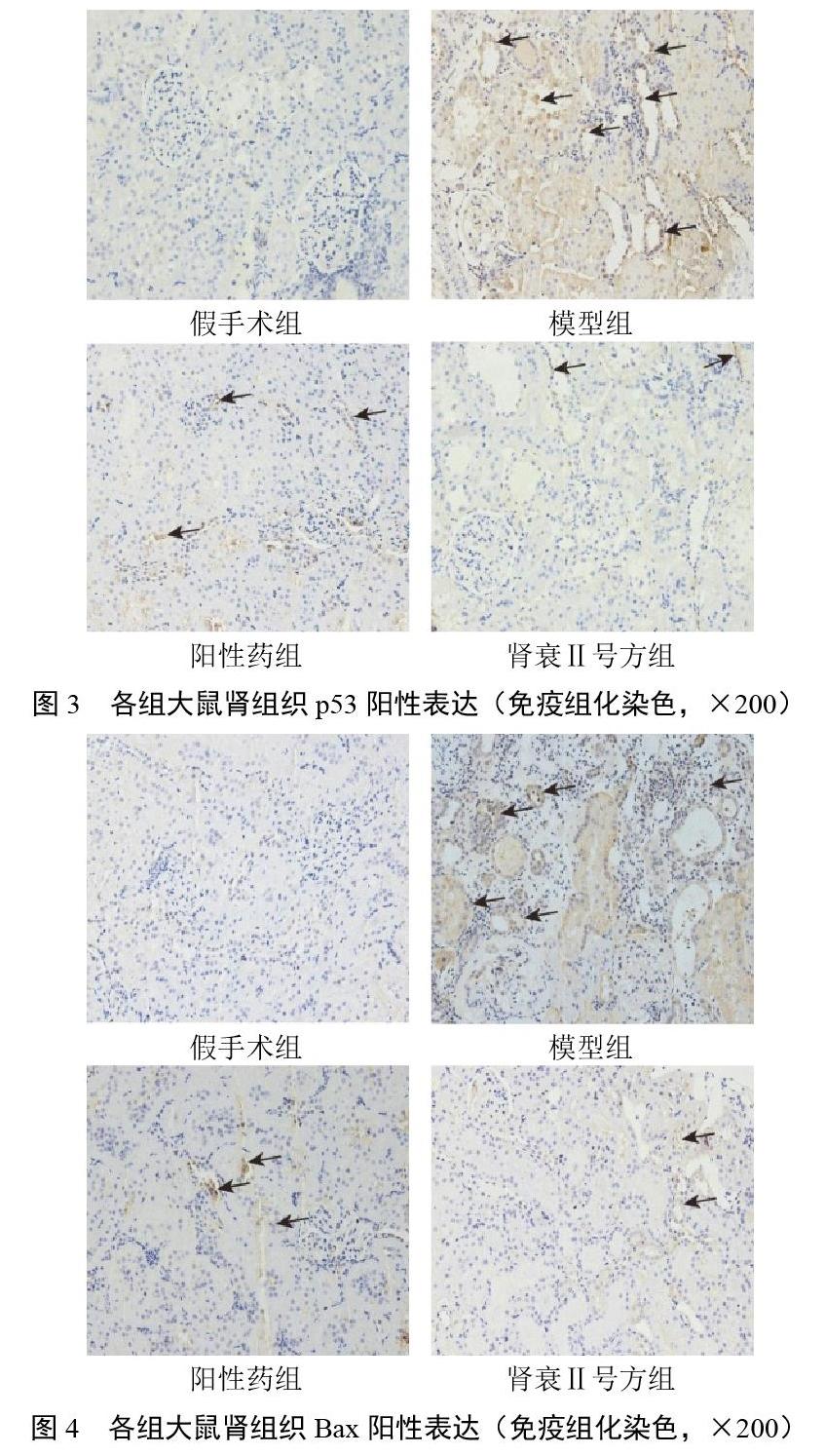
2.3 免疫组化染色结果
与假手术组比较,模型组大鼠肾组织p53、Bax高表达,主要位于肾小管,肾间质炎性细胞浸润明显;各给药组较模型组大鼠肾组织炎性细胞浸润明显减轻,p53和Bax表达明显减少。结果见图3、图4。
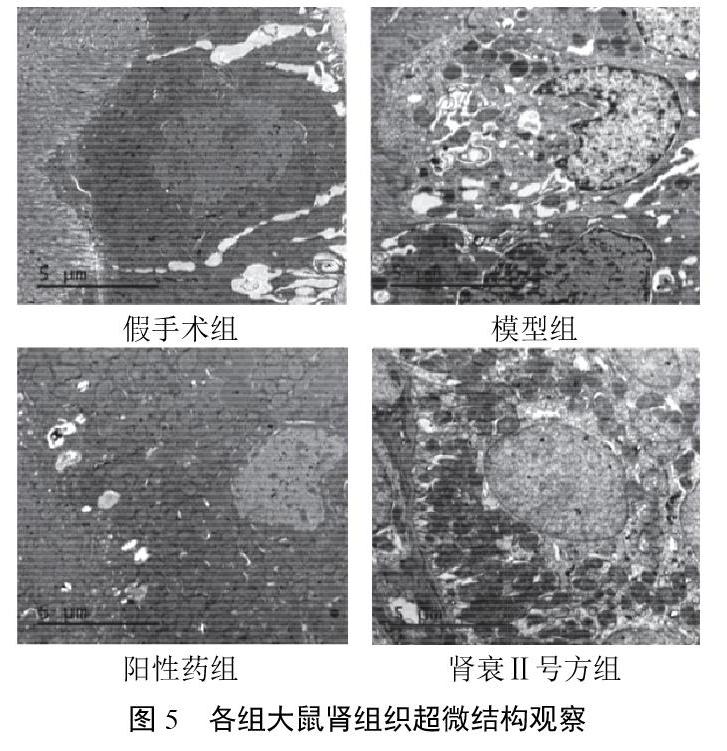
2.4 透射电镜观察结果
假手术组大鼠肾皮质和肾髓质交界处近端小管上皮细胞线粒体形态结构和线粒体嵴正常,肾小管、肾小球无明显病理改变;模型组核固缩,细胞凋亡出现,线粒体数量减少,细胞基质颗粒密度减少;阳性药组线粒体数量正常,少见细胞凋亡发生,未见线粒体嵴断裂紊乱;肾衰Ⅱ号方组线粒体数量正常,少见细胞凋亡发生,未见线粒体嵴断裂紊乱。结果见图5。
3 讨论
RIF是各种病因导致的慢性、进展性肾脏疾病的最终归宿,在各种慢性肾脏疾病的转归中起着主导作用。对RIF进展机制的研究是当今肾脏病领域研究的热点之一。研究表明,中药在抑制细胞凋亡、改善肾脏病理损害及延缓RIF方面有着独特优势。朱敏杰等[8]报道,葛根素能抑制肾脏缺血再灌注大鼠的细胞凋亡,改善肾功能;吴坚等[9]报道,健脾养正消癥方能通过PI3K/AKT信号通路减少细胞凋亡,抑制顺铂导致的肾毒性。本研究在前期研究的基础上,以凋亡为切入点,研究5/6(A/I)肾切除CRF大鼠残余肾组织凋亡相关蛋白p53、Bax和Cleaved-parp的表达及肾衰Ⅱ号方的干预作用。
肾衰Ⅱ号方突出了“扶正降浊”治疗CRF的思想,方中以党参、淫羊藿健脾温肾,温而不燥,取“少火生气”之意,共为君药;臣以虫草菌丝补命门之火,当归、丹参养血活血,化瘀而不伤正,佐制大黄、黄连、紫苏叶清热泄浊解毒;桃仁、川芎增强活血化瘀之力。全方寒温并用,攻补兼施,契合CRF病机。临床研究表明,肾衰Ⅱ号方能改善CKD患者的炎症状态,降低炎症因子的表达,改善患者的精神状态,保护肾功能[10-11]。
细胞凋亡是基因调控下的细胞程序性死亡过程,涉及一系列基因的激活和蛋白的表达[12]。生理状态下,细胞凋亡有利于清除异常细胞,维持组织器官功能的稳定,但过度凋亡会减退正常的生理功能,加重疾病进展。研究表明,p53的激活与肾纤维化的发生和进展密切相关。Wang等[13]报道,在糖尿病肾病模型中,p53的敲除或抑制可改善肾功能,减轻RIF。Rehman等[14]报道,在肾毒性模型中,Diosmin通过下调p53和Bax诱导的细胞凋亡,减轻肾损伤。p53可通过促进凋亡蛋白的活化参与线粒体介导的凋亡途径,p53能够与促凋亡蛋白Bax相互作用引起后者转位到线粒体,激活凋亡信號通路[15]。Cheng等[16]报道了氧化低密度脂蛋白能够上调p53而激活Bax,引起细胞色素C的释放和Caspase活化,诱导凋亡。Mei等[17]报道了肾近端小管细胞Bax的敲除能抑制凋亡和减轻RIF。因此,Bax对于凋亡因子的释放和激活起着重要的作用。PARP是DNA损伤的感受器,也是细胞凋亡时Caspase的切割底物,因此,PARP的活化是细胞凋亡的标志性事件[18]。本研究显示,与假手术组比较,5/6(A/I)肾切除大鼠肾皮质和肾髓质残余肾组织凋亡相关蛋白p53、Bax和Cleaved-parp表达升高,炎性细胞浸润明显,透射电镜结果表明,模型组细胞凋亡发生,线粒体数量减少,超微结构紊乱,说明在CRF大鼠模型中,凋亡被激活。肾衰Ⅱ号方能显著下调CRF大鼠残余肾组织p53、Bax和Cleaved-parp蛋白的表达,减少炎性细胞浸润,超微结构改善明显,说明肾衰Ⅱ号方可能通过抑制凋亡相关蛋白p53、Bax和Cleaved-parp的表达,起到了保护肾功能、延缓RIF进展的作用。
根据Brenner的理论,肾脏疾病主要起源于肾小球血流动力学的改变,但相关实验研究表明,小管间质的损害与肾功能的进展关系更加密切[19-21]。因此,肾小管间质功能的损伤可能是CRF进展的共同通路。本研究运用免疫组化检测分析p53和Bax蛋白的表达位置,结果显示p53和Bax蛋白的表达主要位于肾小管,由此认为肾衰Ⅱ号方可能通过改善肾内缺氧下调了p53、Bax的表达,但其具体机制需要进一步研究。
参考文献:
[1] ENE-IORDACHE B, PERICO N, BIKBOV B, et al. Chronic kidney disease and cardiovascular risk in six regions of the world (ISN-KDDC):a cross-sectional study[J]. Lancet Glob Health,2016,4:e307-e319.
[2] XU Y, LIU Y Q, GUO H L, et al. Apoptosis-associated speck-like protein containing a cARD deletion ameliorates unilateral ureteral obstruction induced renal fibrosis and endoplasmic reticulum stress in mice[J]. Mediators Inflamm,2018,2018:6909035.
[3] ZHOU J, ZHONG J Y, HUANG Z X, et al. TAK1 mediates apoptosis via p38 involve in ischemia-induced renal fibrosis[J]. Artif Cells Nanomed Biotechnol,2018,2018:1-10.
[4] 杨婧,王琛,邵命海,等.肾衰Ⅱ号方对5/6肾切除大鼠肾血流量和肾内氧耗影响及其作用机制[J].中国中西医结合肾病杂志,2011,12(7):578-581.
[5] 秦军燕,王琛,邵命海,等.肾衰Ⅱ号方对慢性肾功能衰竭大鼠肾组织AngⅡ及nNOS蛋白表达的影响[J].中国中西医结合杂志,2012,32(9):1280-1284.
[6] 程勤丽,徐亚赟,杨靖,等.益气养血祛瘀泄浊法对5/6(A/I)慢性肾衰竭模型大鼠蛋白尿及残余肾功能的保护作用[J].中国中西医结合肾病杂志,2017,18(7):570-573.
[7] DENG A H, TANG T, SINGH P, et al. Regulation of oxygen utilization by angiotensin Ⅱ in chronic kidney disease[J]. Kidney Int,2009,75:197-204.
[8] 朱敏杰,郝海英,陈洁,等.葛根素对肾缺血再灌注大鼠肾脏组织细胞凋亡的影响及其机制探讨[J].中国实验方剂学杂志,2016,22(23):127- 132.
[9] 吴坚,邹玺,刘沈林,等.健脾养正消癥方通过激活PI3K/AKT 信号通路减轻顺铂所致的肾毒性作用[J].中国实验方剂学杂志,2015,21(17):106-110.
[10] 杨婧,严睿俊,王琛.肾衰Ⅱ号方对慢性肾脏病患者肾功能及炎症因子的影响[J].中国中医药信息杂志,2014,21(12):15-18.
[11] 周圆,王琛,何立群,等.肾衰Ⅱ号方治疗CKD3-4 期患者的临床疗效观察[J].上海中医药大学学报,2011,25(4):37-40.
[12] YOGOSAWA S, YOSHIDA K. Tumor suppressive role for kinases phosphorylating p53 in DNA damage-induced apoptosis[J]. Cancer Sci,2018,109:3376-3382.
[13] WANG J, PANG J, LI H L, et al. lncRNA ZEB1-AS1 as suppressed by p53 for renal fibrosis in diabetic nephropathy[J]. Mol Ther Nucleic Acids,2018,12:741-750.
[14] REHMAN M U, TAHIR M, QUAIYOOM K A, et al. Diosmin protects against trichloroethylene-induced renal injury in Wistar rats:plausible role of p53, Bax and caspases[J]. Br J Nutr,2013,110:699-710.
[15] CHIPUK J E, KUWANA T, BOUCHIEⅡR-HAYES L, et al. Direct activation of Bax by p53 mediates mitochondrial membrane permeabilization and apoptosis[J]. Science,2004,303:1010-1014.
[16] CHENG J Z, CUI R, CHEN C H, et al. Oxidized low-density lipoprotein stimulates p53-dependent activation of proapoptotic Bax leading to apoptosis of differentiated endothelial progenitor cells[J]. Endocrinology,2007,148:2085-2094.
[17] MEI S Q, LIN L, WEI Q, et al. Double knockout of Bax and Bak from kidney proximal tubules reduces unilateral urethral obstruction associated apoptosis and renal interstitial fibrosis[J]. Sci Rep,2017,7:44892-44898.
[18] LIU X X, DENG Y F, XU Y F, et al. MicroRNA-223 protects neonatal rat cardiomyocytes and H9c2 cells from hypoxia-induced apoptosis and excessive autophagy via the Akt/mTOR pathway by targeting PARP-1[J]. J Mol Cell Cardiol,2018,118:133-146.
[19] BRENNER B M, MEYER T W, HOSTETTER T H. Dietary protein intake and the progressive nature of kidney disease:The role of hemodynamically mediated glomerular injury in the pathogenesis of progressive glomerular sclerosis in aging, renal ablation, and intrinsic renal disease[J]. N Engl J Med,1982,307:652–659.
[20] EDDY A A. Experimental insights into the tubulointerstitial disease accompanying primary glomerular lesions[J]. J Am Soc Nephrol,1994,5:1273-1287.
[21] NATH K A. Tubulointerstitial changes as a major determinant in the progression of renal damage[J]. Am J Kidney Dis,1992,20:1-17.
(收稿日期:2019-01-01)
(修回日期:2019-01-12;編辑:华强)
