鸦胆子苦醇对人乳腺癌MCF-7细胞凋亡的影响
2019-07-01崔玲娣刘凯
崔玲娣 刘凯


摘要:目的 观察鸦胆子苦醇(BRU)对人乳腺癌MCF-7细胞凋亡的影响,探讨其作用机制。方法 用BRU处理MCF-7细胞。采用CCK-8法和流式细胞术检测MCF-7细胞抑制率和凋亡率,Western blot检测线粒体凋亡通路和内质网应激(ERS)相关蛋白的表达,利用免疫荧光技术实现Nrf2和p53蛋白定位。结果 与对照组比较,BRU显著抑制MCF-7细胞增殖,110 nmol/L BRU诱导MCF-7细胞凋亡有时间依赖性。110 nmol/L BRU显著降低Nrf2及下游蛋白表达,显著增加GRP78、p-PERK/PERK、p-eIF2α/eIF2α、ATF4、CHOP、Apaf-1、Bax/Bcl-2、Cytochrome C、Cleaved-caspase3、p53和p21蛋白的表达(P<0.05,P<0.01,P<0.001),细胞核Nrf2蛋白含量减少、p53蛋白含量增加。结论 BRU通过诱发ERS,抑制Nrf2蛋白表达和核转移,破坏抗氧化作用,诱导MCF-7细胞凋亡。
关键词:鸦胆子苦醇;人乳腺癌MCF-7 细胞;内质网应激;细胞凋亡
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2019)05-0044-05
DOI:10.3969/j.issn.1005-5304.2019.05.010 开放科学(资源服务)标识码(OSID):
Abstract: Objective To investigate the effects of brusatol (BRU) on apoptosis of human breast cancer MCF-7 cells; To discuss its mechanism of action. Methods MCF-7 cells were treated with BRU. The inhibitory ratio and apoptotic ratio of MCF-7 cells was detected by CCK-8 assay and flow cytometry, respectively. Western blot was used to detect the expression of mitochondrial apoptosis pathway and endoplasmic reticulum stress (ERS)-related protein, and Nff2 and p53 protein localization were achieved by immunofluorescence technique. Results Compared with the control group, BRU could significantly inhibit the proliferation of MCF-7 cells, and 110 nmol/L BRU induced MCF-7 cells apoptosis in a time-dependent manner. 110 nmol/L BRU significantly decreased the expression of Nrf2 and downstream proteins, and significantly increased expression of GRP78, p-PERK/PERK, p-eIF2α/eIF2α, ATF4, CHOP, Apaf-1, Bax/Bcl-2, Cytochrome C, Cleaved-caspase3, p53 and p21 proteins (P<0.05, P<0.01, P<0.001). The content of Nrf2 protein decreased and the content of p53 protein increased. Conclusion Through inducing ERS, BRU inhibits Nrf2 protein expression and nuclear transfer, destroys antioxidant activity, and induces apoptosis in MCF-7 cells.
Keywords: brusatol; human breast cancer MCF-7 cell; endoplasmic reticulum stress; apoptosis
乳腺癌发病率已上升至女性恶性肿瘤第1位,成为妇女健康的最大威胁[1]。目前,临床上大多采用放疗和化疗来延长乳腺癌患者的生存期、缓解症状,但治疗有效率较低,毒副反应大。临床上,癌细胞抗药是目前癌症药物治疗难以解决的棘手问题,主要原因之一是核转录因子2(Nrf2)发挥的细胞保护作用。已有研究显示,腫瘤Nrf2异常激活,与癌症药物治疗和辐射抗性有关[2]。近年来,一种源于苦木科植物鸦胆子种子喹诺酮——鸦胆子苦醇(brusatol,BRU)引起研究人员的关注。有实验表明,BRU能通过抑制Nrf2表达,抑制多种癌细胞增殖,是潜在的天然抗肿瘤药物[3]。但BRU具体通过何种途径抑制Nrf2表达,至今尚未阐明。一些天然产物可诱发肿瘤细胞的内质网应激(ERS),进而促进肿瘤细胞凋亡[4],这为阐明BRU的作用机制提供了契机。ERS对维持细胞正常稳态起重要作用,细胞发生严重的ERS,诱导细胞凋亡[5]。因此,本实验从BRU可能诱发人乳腺癌细胞ERS这一推断出发,将ERS与Nrf2链接起来,探讨BRU通过诱发ERS激活p53,达到抑制Nrf2表达的作用,为人乳腺癌的药物治疗提供依据。
1 材料和方法
1.1 药物
BRU,美国Sigma公司,使用时用二甲基亚砜(DMSO)溶解,并使BRU的终浓度低于0.01 g/L。
1.2 主要试剂与仪器
CCK-8检测细胞增殖试剂盒、Annexin V-FITC/PI细胞凋亡检测试剂盒和DAPI,美国BD;Apaf-1、Bax、Bcl-2、Cytochrome C、Cleaved-caspase 3、Nrf2、HO-1、NQO-1、p53、MDM2、p21、PERK、p-PERK、GRP78、ATF4、eIF2α、p-eIF2α、CHOP及β-actin单克隆抗体,美国Abcam公司;辣根过氧化酶标记的羊抗兔、羊抗鼠二抗和FITC标记的荧光二抗,北京博奥森公司;RPM 1640培养基和胎牛血清,北京全式金生物技术有限公司。双人单面净化工作台(上海博讯实业有限公司),流式细胞仪(德国默克密理博公司),凝胶成像系统(美国Protein Sample),酶标仪(上海闪谱生物科技有限公司),电泳仪、电泳槽(美国Bio-Rad),激光共聚焦显微镜(德国Zessi)。
1.3 细胞培养
人乳腺癌MCF-7 细胞,购自美国模式培养物保藏所。细胞在含10%胎牛血清的RPMI1640培养液中,置于37 ℃、5%二氧化碳培养箱中培养。
1.4 细胞增殖抑制实验
取对数生长期MCF-7细胞,调整细胞密度为1.5×104个/孔,接种于96孔板。培养24 h后,加经培养液稀释的20、40、60、80、100 nmol/L BRU,继续培养12、24、48 h,收样。每组设3个复孔,分别加10 μL CCK-8,继续培养2 h。于波长450 nm处测定各孔吸光度(A),计算抑制率[(A对照-A给药)÷(A对照-A空白)×100%]。用GraphPad Prism5软件绘制增殖抑制率曲线。
1.5 细胞凋亡分析
根据细胞增殖抑制实验得出BRU的IC50,MCF-7细胞生长密度达70%时,加入IC50 BRU,培养12、24、48 h后收集细胞,弃细胞培养液,用预冷的PBS清洗3次,经0.25%胰酶消化1 min,用PBS悬浮细胞,调整细胞密度至5×104个/mL。按Annexin V- FITC/PI凋亡试剂盒说明书操作,流式细胞仪分析细胞凋亡率,计数1000个细胞,IDEAS软件分析实验数据,每组至少重复3次。
1.6 蛋白表达测定
MCF-7细胞生长密度达70%时,用10 ?mol/L阿霉素(Dox)处理细胞24 h,作为阳性对照。用IC50/2、IC50和2×IC50 BRU处理MCF-7细胞24 h,弃细胞培养液,用预冷的PBS清洗3次,加入100 μL蛋白裂解液,冰浴裂解20 min,经12 000×g离心10 min,收集上清液。经Bradford法定量后,用12%SDS-PAGE 凝胶电泳分离蛋白质,经转膜、封闭、一抗4 ℃过夜和二抗孵育,化学发光法显色,Protein Sample凝胶成像系统拍照记录,并用系统自带软件分析灰度值。
1.7 蛋白免疫荧光定位
将多聚赖氨酸处理过的盖玻片置于6孔板,调整MCF-7 细胞密度至5×104个/mL,接种细胞,当细胞生长密度达到70%左右时,用IC50的BRU处理MCF-7 细胞24 h,弃细胞培养液,用预冷的PBS清洗3次,用4%多聚甲醛固定,经室温干燥。用0.2%Triton X-100透化细胞10 min,PBS清洗3次,用5%BSA封闭细胞30 min,经一抗4 ℃过夜和荧光二抗孵育。用终浓度为0.5 ?g/mL的DAPI染色10 min,PBS清洗3次,将盖玻片置于载玻片,封片,用激光共聚焦显微镜观察拍照。
1.8 统计学方法
采用SPSS19.0統计软件进行分析。实验数据以±s表示。符合正态分布,组间比较用方差分析,方差齐用LSD法,方差不齐用Tamhane'T2法;不符合正态分布,采用非参数统计中多个独立样本Kruskal- Wallis H检验。P<0.05表示差异有统计学意义。
2 结果
2.1 鸦胆子苦醇对MCF-7细胞增殖、凋亡的影响
BRU对MCF-7细胞增殖的抑制作用具有时间和剂量依赖性。20~100 nmol/L BRU对MCF-7细胞生长有不同程度的抑制作用,在12、24、48 h的IC50值分别为157.2、109.5、108.2 nmol/L(见图1)。24、48 h 的IC50接近,这表明110 nmol/L BRU可显著抑制MCF-7细胞增殖。因此,选用该浓度作为后续实验的浓度。流式细胞术结果显示,110 nmol/L BRU作用MCF-7细胞12、24、48 h后,细胞凋亡率显著增加,表明BRU可时间依赖性地诱导MCF-7细胞发生凋亡(见图2),24 h细胞凋亡率已显著增加。因此,选取24 h作为后续实验的时间点。
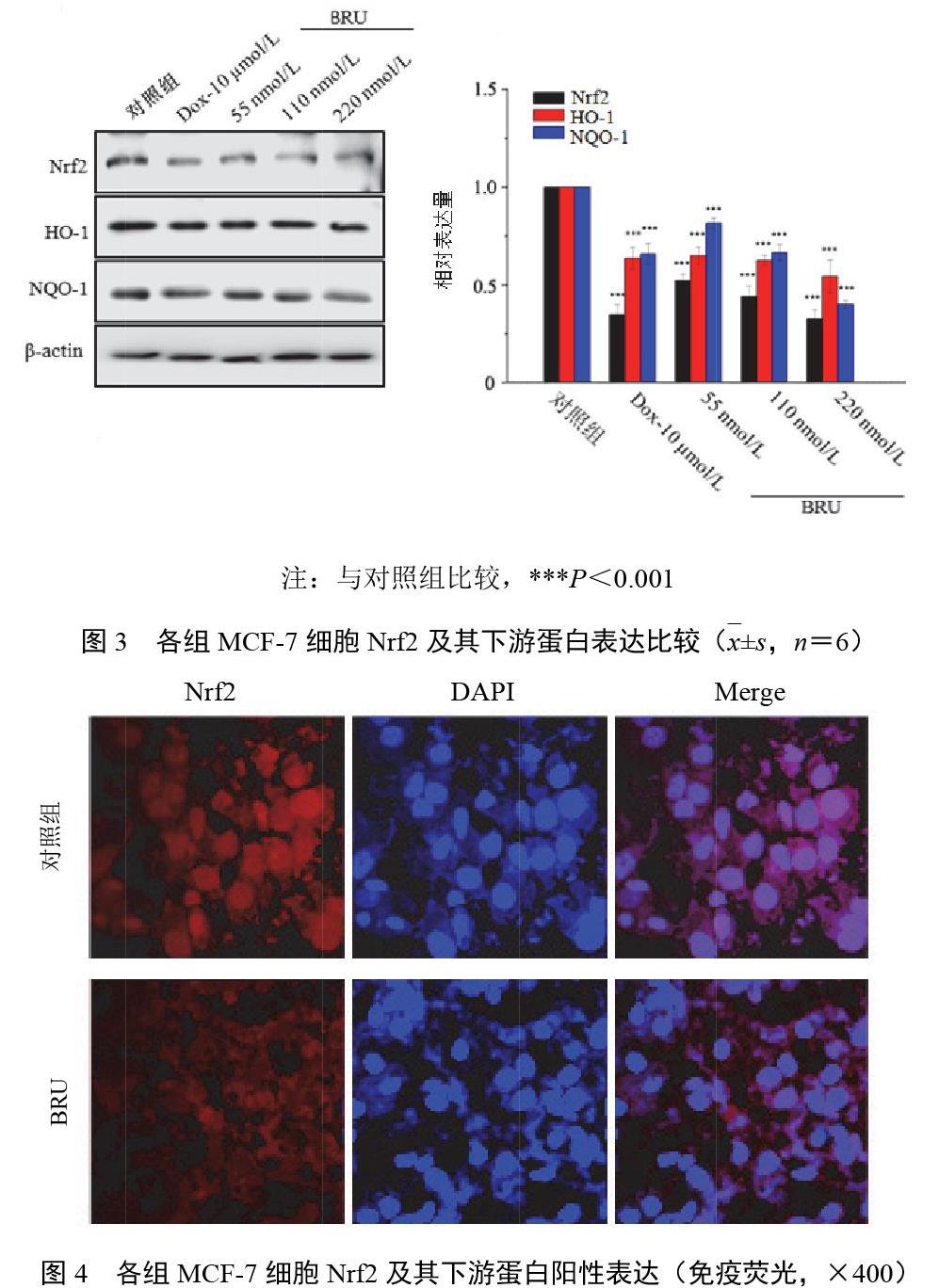
2.2 鸦胆子苦醇对MCF-7细胞核转录因子2及下游蛋白表达的影响
Western blot检测结果显示,BRU可降低Nrf2及下游蛋白的表达,见图3。细胞核Nrf2含量减少,见图4(红色荧光代表Nrf2蛋白,蓝色荧光代表细胞核)。提示BRU对MCF-7细胞Nrf2表达有抑制作用,BRU可破坏MCF-7细胞抗氧化,诱导细胞凋亡。
2.3 鸦胆子苦醇对MCF-7细胞内质网应激的影响
选取ERS标志蛋白GRP78和PERK/eIF2α/ATF4/ CHOP信号通路评判MCF-7细胞ERS状况。Western blot结果显示,BRU可增加GRP78、p-PERK/PERK、p-eIF2α/eIF2α、ATF4和CHOP表达,见图5。
2.4 鸦胆子苦醇对MCF-7细胞线粒体凋亡通路蛋白表达的影响
Western blot结果显示,BRU可增加Bax/Bcl-2、Apaf-1、Cytochrome C和Cleaved-caspase 3表达,见图6。
2.5 鸦胆子苦醇对MCF-7细胞p53和p21蛋白表达的影响
p53蛋白在细胞凋亡中起重要的调控作用,它可作为转录因子激活p21,阻滞细胞进程,引起凋亡。Western blot结果显示,BRU可显著增加p53、MDM2和p21的表达,见图7。细胞核中p53阳性表达增加,见图8(红色荧光表示p53蛋白,绿色荧光表示细胞核)。
3 讨论
近年来,从天然产物中筛选癌症治疗药物成为癌症预防和治疗研究的热点。临床试验表明,BRU可有效抑制乳腺癌、胃癌、前列腺癌和结肠癌细胞的增殖,是潜在的天然抗肿瘤药物[6]。虽然BRU可通过抑制Nrf2表达促进肿瘤细胞凋亡,但具体的信号转导途径尚不十分清楚。内质网对维持细胞正常生理功能有重要作用[7],ERS能促进内质网对蓄积在网腔内的错误折叠或未折叠蛋白质的处理,从而更好维持细胞的正常功能并使之存活。但是,发生持续严重的ERS可诱导细胞凋亡[8]。为探讨BRU引起的ERS与Nrf2表达的关系,本研究对Nrf2、PERK/eIF2α/ATF4/CHOP信号通路、p53表达和线粒体凋亡途径进行分析,以期揭示BRU抑制Nrf2表达的内在机制。
本研究结果表明,BRU可显著抑制MCF-7细胞生长。经110 nmol/L BRU处理MCF-7细胞24 h,流式细胞仪分析结果显示,BRU明显诱导MCF-7细胞发生凋亡。GRP78是位于内质网中的伴侣蛋白,当ERS发生时其表达显着增加[9],转录因子CHOP是ERS激活的细胞凋亡途径的关键参与者[10]。本研究发现,GRP78和CHOP蛋白过表达,表明BRU激活了ERS凋亡途径。ERS激活PERK,进而磷酸化eIF2α,抑制mRNA翻译成蛋白质,磷酸化的eIF2α也能激活ATF4表达,并导致CHOP表达升高[11]。BRU促进p-PERK、p-eIF2α、ATF4和CHOP的表达上调,表明BRU通过PERK/eIF2a/ATF4/CHOP信号通路激活ERS,导致MCF-7细胞凋亡。
本研究表明,ERS在BRU诱导MCF-7细胞中起核心调控作用。一方面,BRU通过诱发ERS,激活PERK,活化的PERK磷酸化eIF2α,使信使RNA翻译成蛋白质的功能被抑制,造成ATF4蛋白表达上调,ATF上调后能够促进读码框移位蛋白(alternative reading frame protein,ARF)与MDM2结合,使MDM2与p53解离,抑制p53的泛素化降解,稳定和激活p53。p53被激活后,发生核转移,与ARF的启动子区域結合,抑制Nrf2下游抗氧化蛋白NQO1和HO-1表达,使细胞活性氧含量升高,进而抑制Nrf2活性,诱导MCF-7细胞凋亡[12];p53被激活后,促进p21的转录,增加p21蛋白的表达,使MCF-7细胞发生G1/S期阻滞,进一步诱导凋亡[13]。此外,BRU通过诱发ERS,激活线粒体凋亡途径,ERS通过减弱bcl-2表达,激活CHOP并诱导MCF-7细胞凋亡[14];同时,ERS又能直接激活Caspase-3,加速MCF-7细胞凋亡[15]。
综上所述,BRU抑制MCF-7细胞的Nrf2表达、诱导凋亡是通过诱发ERS完成,ERS在这一过程起核心调控作用,这为BRU抑制Nrf2表达的机制研究提供了依据。此外,与传统抗癌药物相比,较低剂量BRU可显著促进MCF-7细胞凋亡,具有一定的剂量优势。
参考文献:
[1] STEWART B W, WILD C P. World Cancer Report 2014[M]. Geneva:World Health Organization,2014:185-260.
[2] BAI X, CHEN Y, HOU X, et al. Emerging role of NRF2 in chemoresistance by regulating drug-metabolizing enzymes and efflux transporters[J]. Drug Metab Rev,2016,48(4):541-567.
[3] SUN X, WANG Q, WANG Y, et al. Brusatol enhances the radiosensitivity of A549 cells by promoting ROS production and enhancing DNA damage[J]. Int J Mol Sci,2016,17(7):E997.
[4] LI X H, HE X R, ZHOU Y Y, et al. Taraxacum mongolicum extract induced endoplasmic reticulum stress associated-apoptosis in triple-negative breast cancer cells[J]. J Ethnopharmacol,2017, 206:55-64.
[5] ZEESHAN H M, LEE G H, KIM H R, et al. Endoplasmic reticulum stress and associated ROS[J]. Int J Mol Sci,2016,17(3):327.
[6] REN D, VILLENEUVE N F, JIANG T, et al. Brusatol enhances the efficacy of chemotherapy by inhibiting the Nrf2-mediated defense mechanism[J]. Proc Natl Acad Sci USA,2011,108(4):1433-1438.
[7] CAO S S, KAUFMAN R J. Endoplasmic reticulum stress and oxidative stress in cell fate decision and human disease[J]. Antioxid Redox Signal,2014,21(3):396-413.
[8] LIU M Q, CHEN Z, CHEN L X. Endoplasmic reticulum stress:a novel mechanism and therapeutic target for cardiovascular diseases[J]. Acta Pharmacol Sin,2016,37(4):425-443.
[9] PARK K W, EUN KIM G, MORALES R, et al. The endoplasmic reticulum chaperone GRP78/BiP modulates prion propagation in vitro and in vivo[J]. Sci Rep,2017,7:44723.
[10] YANG Y, SUN M, SHAN Y, et al. Endoplasmic reticulum stress-mediated a apoptotic pathway is involved in corpus luteum regression in rats[J]. Reprod Sci,2015,22(5):572-584.
[11] LIU X, WANG M, CHEN H, et al. Hypothermia protects the brain from transient global ischemia/reperfusion by attenuating endoplasmic reticulum response-induced apoptosis through CHOP[J]. PLoS One,2013,8:e53431.
[12] YI S, SHI W, WANG H, et al. Endoplasmic eticulum stress PERK-ATF4-CHOP pathway is associated with hypothalamic neuronal injury in different durations of stress in rats[J]. Front Neurosci,2017,11:152.
[13] VILLENUVE N F, SUN Z, CHEN W, et al. Nrf2 and p21 regulate the fine balance between life and death by controlling ROS levels[J]. Cell Cycle,2009,8(20):3255-3256.
[14] ADAMS J M, CORY S. Bcl-2-regulated apoptosis:mechanism and therapeutic potential[J]. Curr Opin Immunol,2007,19(5):488-496.
[15] LIN C C, KUO C L, LEE M H, et al. Wogonin triggers apoptosis in human osteosarcoma U-2 OS cells through the endoplasmic reticulum stress, mitochondrial dysfunction and caspase-3- dependent signaling pathways[J]. Int J Oncol,2011,39:217-224.
(收稿日期:2018-09-13)
(修回日期:2018-10-27;編辑:华强)
