浅谈基于化学核心素养的教学设计思路
——以《Fe2+与Fe3+的转化》为例
2019-07-01
随着新课程改革的逐步推进,课堂教学模式也逐步由旧的填鸭式、一味地讲授式向多形式的教学模式转化,学生由被动接受知识向主动探究学习进步。本文基于化学核心素养,以《Fe2+与Fe3+的转化》为例,谈谈教学设计的思路。
一、对常规教学设计的反思
1.常规教学设计的不足
《Fe2+与Fe3+的转化》 是以Fe2+与Fe3+之间的转化为主,兼带铁及其化合物性质的一节归纳总结课。对这节课,传统的教法是教师通过以前的知识积累,直接教授哪些物质可以实现二者之间的转化,辅以一些典型的实验帮助学生加深印象,再补充一些新的例子,拓展学生的视野,最后通过书写一些化学方程式来巩固所学知识。学生是被动接受,很多同学上课学会了这几个化学方程式的书写,过段时间就忘了,或稍微变形却又傻眼了,对于新情境下的化学方程式书写,仍然不知所措。
2.需要解决的问题
面对新一轮教学改革,以及势在必行地对学生化学核心素养培养的背景下,如何让学生提升关于知识、技能、情感、态度、价值观等多方面要求的综合能力,在传统教学中都不能得到很好地解决。笔者认为应从如下几个方面入手:
(1)激发学生的学习兴趣,让学生从被动接受化学方程式到主动探究物质变化的转化。
(2)将已学过的知识主动熟练应用于解决新知识的问题中。
(3)将宏观物质之间的转化关系,用微观的化学微粒间的变化来解释。
(4)将所学知识与实际应用联系起来。
二、基于化学核心素养《Fe2+与Fe3+的转化》的教学设计的思考
1.理论思考
以“全面发展的人”为目标的核心素养,包括文化基础、自主发展、社会参与这三大层面及人文底蕴、科学精神、学会学习、健康生活、责任担当、实践创新这六大素养。化学核心素养包含五个维度:①宏观辨识与微观探析,②变化观念与平衡思想,③证据推理与模型认知,④科学探究与创新意识,⑤科学精神与社会责任。“有人说,什么是素质?”当你把在学校学的知识都忘掉的时候,剩下的就是素质。今天孩子在课堂里学化学,不是让他成为化学家,我们关注的是,毕业以后,作为一个公民,学过化学和没学过化学有什么差异?化学能留给他终身受用的东西是什么?这就是核心素养。因此,在本教学设计上,应该考虑更多的是,学生真正能够收获什么。
鉴于《Fe2+与Fe3+的转化》是在学生掌握铁的氧化物的基本性质、Fe2+和Fe3+的检验的基础上,利用已学的氧化还原反应、离子反应的基础知识,来进一步学习Fe2+和Fe3+的转化,深入思考如何解决之前的一系列问题。
2.原因探析与方案构想
(1)创设情境,激发学生的求知欲。原有教学模式下,先以回顾Fe2+和Fe3+的转化规律作为本节课的开场白,难以激发学生的兴趣。与Fe2+和Fe3+的转化相关的生活情境有很多,如印刷电路板的制作、补血剂的作用、切开的苹果久置会变黄、利用维生素C去除布料上粘有蓝黑墨水污渍等。基于这些生活中的情景素材,创新设计魔术实验“‘茶水’变‘墨水’”,则让学生耳目一新,顿生兴趣与求知欲。其原理是:茶水中含有大量的鞣酸,遇到FeSO4中的Fe2+立即生成鞣酸亚铁,鞣酸亚铁性质不稳定,易被氧化成鞣酸铁的络合物,呈蓝黑色。加入维生素C后,Fe3+被还原成Fe2+,溶液又恢复茶水的颜色。由此说明Fe2+和Fe3+之间是可以转化的。

突出“科学探究与创新意识”的设计思路
(2)以氧化还原反应知识储备解决学习中的新问题。引导学生用氧化还原反应原理的模型认知,从化合价的角度分析,Fe3+向Fe2+转化,需要加入的试剂是还原剂;Fe2+向Fe3+转化,需要加入的试剂是氧化剂。学生很自然地就会往下思考:符合条件的还原剂及氧化剂究竟有哪些呢?列举出的还原剂与Fe3+反应确实可以发生吗?如何去证明呢?在氧化剂与Fe2+反应中存在同样的疑问。为了便于观察,老师建议选择现象变化明显的实验进行验证。在Fe3+向 Fe2+转化, 加入的还原剂可以是 Cu、Fe、KI、SO2等。选择用I-与Fe3+反应,同时又出现了新的问题:如何验证氧化产物及还原产物。借以巩固前面所学Fe3+及Fe2+的检验。选取先将无色的KI溶液加入到浅黄色的FeCl3溶液中,溶液变成黄褐色。将此溶液分成两份,分别加入淀粉溶液、铁氰化钾溶液。前者得到蓝色溶液,说明反应后有I2生成,后者得到蓝色沉淀,说明反应后有Fe2+生成。从而实现了Fe3+向Fe2+转化。实现Fe2+向Fe3+转化,加入的氧化剂可以是 Cl2、H2O2溶液、酸性 KMnO4溶液、HNO3溶液等。现以选择酸性KMnO4溶液为例,实验过程中将FeSO4溶液滴加到酸性KMnO4溶液中,溶液的紫红色褪去。已知在酸性溶液中,MnO-4被还原成Mn2+,验证氧化产物同样是利用已学知识。如何设计实验中还有没有其他微粒参加反应,为下一步探究预设伏笔。
(3)从宏观现象的变化到微观本质的分析深入学习新知识。通过学习并掌握这种分析方法,寻求陌生环境下氧化还原反应方程式的书写技巧,有助于继续深入学习氧化还原反应知识。为能更加直观地研究反应本质,采用了手持技术,即pH传感器测定反应前后H+的浓度变化,以确定H+是否参加反应。实验前需要控制实验条件:酸性KMnO4溶液和FeSO4溶液的pH相同,避免因溶液混合引起的pH变化。实验开始时,将pH传感器浸泡在酸性KMnO4溶液中,连接好电脑、数据采集器、pH传感器,设置好需要采集的数据及图像的横纵坐标参数,再逐滴滴加FeSO4溶液至溶液红色褪去,同时引导学生观察pH数据及图像中pH的变化。通过实验,我们会发现pH数据变大了,反映pH数据的线的走势呈上升状态。据此分析得出H+参与反应的结论,而且生成了H2O。确定好反应物及生成物之后,再利用已学的氧化还原反应中的得失电子守恒、电荷守恒、原子个数守恒,学生不难写出反应的离子方程式与化学方程式。上述设计既是对前面所学知识的巩固,又让学生克服恐惧心理,提升了陌生情境下的化学方程式的书写技能。
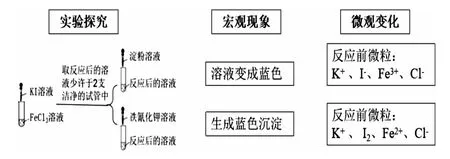
突出“变化观念与平衡思想”的设计思路
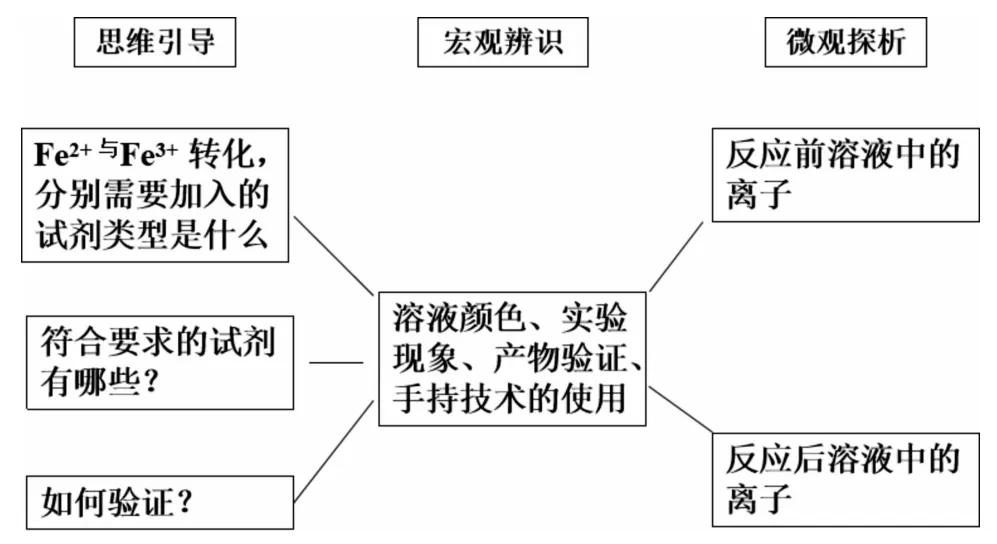
突出“宏观辨识与微观探析”的设计思路
(4)理论联系实际、学以致用。学习完以上知识,学生便不难解释生活情境:印刷电路板的制作、补血剂的作用、切开的苹果久置会变黄等现象,知晓其实质就是Fe2+与Fe3+的转化,呼应本节课开头的情境,此外还可以解决一些实际问题。如在实验室,FeSO4溶液需不需要特殊的保存方法?为什么?
三、对以上设计的评价
本教学设计,是在前一章氧化还原反应、离子反应的基本原理和规律之后的新课,将既抽象又有深度和难度的两块内容的学习贯穿整个高中,实现难度螺旋式上升,符合学生认知特点和规律,具有适切性。
本教学设计中的实验探究,选取的都是现象非常明显的案例,引导学生从宏观现象的变化,探析微观粒子变化的本质,体现了化学核心素养中“宏观辨识与微观探析”“科学探究与创新意识”“变化观念与平衡思想”几个维度,具有一定的深入性。
笔者认为以上两个探究任务的方案构想,现象明显、直观,操作简单,且可重复,具有一定的有效性。
