颞叶胶质瘤非共面三维适形放射治疗与调强放射治疗的剂量学对比研究
2019-07-01高山宝李双双
高山宝 李双双 刘 娟 侯 震 闫 婧*
三维适形放射治疗(three-dimensional conformal radiotherapy,3D-CRT)一直是胶质瘤术后放射治疗应用的主要治疗技术,特别是当靶区临近危及器官(organ at risk,OAR)时,非共面3D-CRT照射技术是合适的选择[1]。随着放射治疗设备的更新,调强放射治疗(intensity modulated radiotherapy,IMRT)和容积旋转调强放射治疗(volumetric modulated arc therapy,VMAT)等也开始应用于脑胶质瘤的治疗当中。在设计颞叶胶质瘤治疗计划时,考虑到靶区临近脑干、晶体及视神经等重要器官,特别是对脑干形成半包围结构,剂量师往往选择IMRT或者VMAT等易于形成凹型剂量分布的治疗技术,同时计划设计也相对简单[2-3]。虽然有研究表明在调强技术设计脑胶质瘤治疗计划时加入非共面野可以改善剂量分布并减少OAR受照量,但是这种计划设计会延长治疗时间,增加放射治疗工作人员的工作强度[4-6]。3D-CRT技术由于机器输出跳数最少,治疗时间短,加入少量非共面照射野后治疗时间依然少于共面IMRT技术,所以在脑胶质瘤的计划设计中仍然被广泛采用。但是这样的选择与共面IMRT技术比较哪种治疗技术更适合临床使用,为此,本研究对比颞叶胶质瘤患者术后在非共面3D-CRT和共面IMRT放射治疗计划之间的剂量学差异,评价不同放射治疗计划的差别。
1 资料与方法
1.1 临床资料
选择2015年4月至2018年6月南京鼓楼医院肿瘤中心收治的13例经术后病理确诊为胶质瘤患者,其中男性9例,女性4例,年龄40~61岁,平均年龄(46±6.4)岁。对每例患者分别设计非共面3D-CRT与共面IMRT计划,并将其定义为3D-CRT组和IMRT组。13例患者病理分级提示Ⅱ级1例,Ⅲ~Ⅳ级12例。肿瘤均位于颞叶。
1.2 仪器设备
采用Brilliance 6排螺旋CT模拟定位机(荷兰飞利浦公司);Elekta Precise加速器(瑞典医科达公司)。
1.3 CT扫描方法
患者均取自然仰卧位,头部以热塑面模固定,采用Brilliance 6排螺旋CT模拟定位机行平扫和增强扫描,扫描层厚为3mm,扫描范围由颅顶至第2颈椎下缘。将平扫和增强两套CT图像通过局域网传输到治疗计划系统Pinnacle 3。
1.4 靶区和OAR勾画
靶区定义依据ICRU50号和62号报告,肿瘤靶区(gross tumor volume,GTV)为术后残腔及增强病灶。临床靶区(clinical target volume,CTV)为Ⅱ级GTV外放1.5 cm,Ⅲ~Ⅳ级GTV外放2 cm,外放后不能超出颅骨,距离脑干和视神经>3 mm,同时要求包括术前及术后的水肿区。计划靶区(planning target volume,PTV)为CTV外放5 mm区域,外放后不能进入脑干和视神经3 mm范围。因靶区位于单侧,OAR包括双侧晶体、患侧视神经和脑干。考虑到患者认知功能的受损情况和放射治疗的远期毒副作用,增加了健侧海马及靶区外正常脑组织的勾画。
1.5 计划设计
采用Pinnacle310.0治疗计划系统,治疗设备为Elekta Precise加速器,6 MV的X射线照射,处方剂量为60 Gy/30 f。①3D-CRT为正向计划设计,以PTV中心为照射野中心,以射野中心为剂量参考点,用一个非共面照射野避开脑干,其他照射野为共面照射,所有照射野均不得通过眼晶体,共5~6个照射野;②IMRT为逆向计划设计,以PTV中心为照射野中心,根据靶区形状选择角度将照射野布于患侧,共6~7个共面照射野。因PTV紧邻脑干部分无法达到处方剂量,所以在PTV临近脑干5~8 mm区域设置剂量过渡区,其余PTV部分要求95%靶体积剂量(D95)为处方剂量(DPres),最大剂量(Dmax)<110%。OAR剂量:脑干Dmax<54 Gy,晶体Dmax<8 Gy,视神经Dmax<54 Gy。所有病例的计划均需满足上述条件并为临床可接受与执行。
1.6 评价指标
(1)比较两组的均匀性指数(homogeneity index,HI),其HI计算为公式1:

式中D2为2%靶体积受照剂量;D98为98%靶体积受照剂量;DPres为处方剂量。
(2)比较两组的适形度指数(conformity index,CI),CI计算为公式2:

式中Vt,ref为处方剂量所覆盖的靶体积;Vt为靶区体积;Vref为处方剂量所覆盖的体积。
(3)比较两组计划中双侧晶体、患侧视神经及脑干的最大剂量Dmax以及健侧海马的最大剂量Dmax、平均剂量Dmean和靶区外脑组织所受照的平均剂量Dmean。
1.7 统计学方法
采用SPSS 19.0对数据进行统计分析,各参数结果以(x-±s)表示,进行配对t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 靶区适形度和均匀性
在靶区紧邻脑干的条件下,IMRT组的HI为0.119±0.027,3D-CRT组为0.144±0.029,IMRT组优于3D-CRT组,其差异有统计学意义(t=4.348,P<0.05);IMRT组的CI为0.853±0.022,3D-CRT组为0.847±0.016,IMRT组虽优于3D-CRT组,但差异无统计学意义(t=-1.237,P>0.05),见表1。
两种放射治疗计划剂量分布见图1,两组计划的剂量体积见图2。
2.2 OAR的受照剂量
3D-CRT组的双侧晶体、患侧视神经的最大剂量均小于IMRT组,且差异有统计学意义(t=-3.839,t=-3.485,t=-2.567;P<0.05);3D-CRT组脑干的最大剂量低于IMRT组,但差异无统计学意义,见表2。
2.3 海马区和靶区外脑组织的受照剂量
在对海马区认知功能的保护上,3D-CRT组的最大值及平均值均低于IMRT组。虽然Dmax的参考指标比较无统计学意义,但是3D-CRT组的Dmean优于IMRT组,其差异有统计学意义(t=-4.155,P<0.05)。对于靶区外正常脑组织的受照平均剂量Dmean,3D-CRT组低于IMRT组,但差异无统计学意义,见表3。
表2 3D-CRT组与IMRT组的OAR参考指标比较(Gy,±s)

表2 3D-CRT组与IMRT组的OAR参考指标比较(Gy,±s)
注:表中3D-CRT为三维适形放射治疗;IMRT为调强放射治疗。
组别 例数 右侧晶体最大剂量Dmax 左侧晶体最大剂量Dmax 患侧视神经最大剂量Dmax 脑干最大剂量Dmax 3D-CRT组 13 3.573±1.449 3.772±1.508 41.726±15.649 51.863±2.941 IMRT组 13 4.960±0.602 5.051±0.652 44.772±13.761 52.221±1.726 t值 -3.839 -3.485 -2.567 -0.611 P值 0.002 0.005 0.025 0.553
表3 3D-CRT组与IMRT组的海马区和正常脑组织参考指标比较(Gy,±s)

表3 3D-CRT组与IMRT组的海马区和正常脑组织参考指标比较(Gy,±s)
注:表中3D-CRT为三维适形放射治疗;IMRT为调强放射治疗。
组别 例数 海马最大剂量Dmax 海马平均剂量Dmean 靶区外脑组织平均剂量Dmean 3D-CRT组 13 44.464±12.625 26.692±8.791 25.739±6.881 IMRT组 13 48.158±11.594 32.618±10.054 26.801±7.064 t值 -1.814 -4.155 -1.230 P值 0.095 0.001 0.242
表1 3D-CRT组与IMRT组的HI和CI指标比较±s)
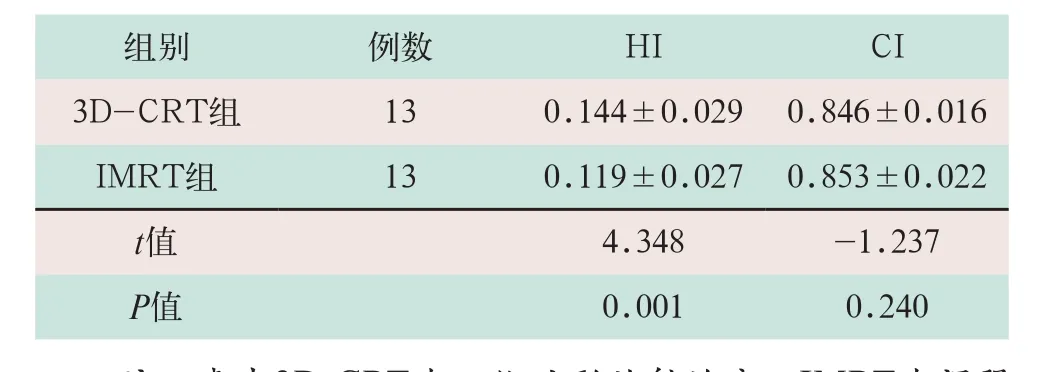
表1 3D-CRT组与IMRT组的HI和CI指标比较±s)
注:表中3D-CRT为三维适形放射治疗;IMRT为调强放射治疗;HI为均匀性指数;CI为适形度指数。
组别 例数 HI CI 3D-CRT组 13 0.144±0.029 0.846±0.016 IMRT组 13 0.119±0.027 0.853±0.022 t值 4.348 -1.237 P值 0.001 0.240
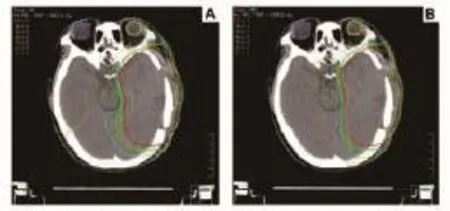
图1 放射治疗计划剂量分布图

图2 两组计划的剂量体积直方图
3 讨论
随着放射治疗理念和技术的发展,新型放射治疗策略不断涌现,如IMRT、图像引导放射治疗(imageguided radiotherapy,IGRT)、VMAT、螺旋断层放射治疗(tomotherapy,TOMO)和立体定向消融放射治疗(stereotactic ablative radiotherapy,SABR)等。随着以上放射治疗软硬件的不断革新,放射治疗迅速进入精准放射治疗时代,疗效不断提高的同时,正常组织的放射损伤也不断减少[3]。但是对某些周围型靶区(如肝癌,肺癌)计划设计的研究表明,非共面3D-CRT计划在正常组织的保护上并不比共面的IMRT和VMAT计划差[7-11]。
颞叶部位的胶质瘤属周围型靶区,同时范围较大,邻近脑干、晶体及视神经等重要器官,在计划设计上与上述病例类似。本研究对13例颞叶脑胶质瘤患者进行3D-CRT和IMRT计划设计,在两组计划都满足靶区剂量要求且OAR均在剂量限制范围内的情况下,比较非共面3D-CRT与IMRT的剂量学差异,为后续计划设计与优化提供参考。本研究结果表明,非共面3D-CRT组虽然在剂量均匀性上劣于IMRT组,但是在OAR以及海马和靶区外脑组织受照剂量的比较上,非共面3D-CRT计划组优于IMRT组。随着肿瘤综合治疗手段的进步,胶质瘤患者的生存期延长,放射治疗的远期毒副作用日益受到重视,特别是对患者认知功能的保护在生活质量的提高上有特别重要的意义[12-13]。
众多的研究中已证实,患侧布野的调强效果与VMAT类似,虽然设备的更新换代使得计划设计变得更加容易,但是非共面3D-CRT这一技术在脑胶质瘤计划设计中依然有存在的价值,并且更有利于对正常组织的保护[14-17]。究其原因,非共面3D-CRT技术在设计头颈部肿瘤计划时有很大的空间自由度,从头顶处斜入射的照射野可以避开晶体、脑干和对侧海马。而共面的IMRT照射野会直接穿过正常组织,虽有多叶准直器的遮挡,但是叶片间的漏射线及散射线都会增加正常组织的受照剂量[18-19]。本研究所设计的非共面3D-CRT计划中,非共面照射野只有一个,充分考虑到实际治疗当中的执行效率,并且就剂量学而言,非共面3D-CRT计划在适形性和均匀性方面劣于IMRT计划,但更加能够保护周边重要器官。
因此,在临床工作中计划设计者应充分考虑脑胶质瘤和正常组织在三维空间中的位置关系,选择合适的治疗方式,从而使患者获益。
