一体化PET/MR不同衰减校正方式定量准确性分析及图像质量评估*
2019-07-01田德峰杨宏伟庄静文崔碧霄严汉民
田德峰 杨宏伟 庄静文 崔碧霄 马 杰 严汉民 卢 洁*
在医学成像中,成像系统的性能需要定期测试和评估,以确保正常的功能和最佳的图像质量。对于正电子发射计算机断层显像(positron emission tomography,PET)扫描仪,美国国家电气制造商协会(National Electrical Manufactures Association,NEMA)制定了评估PET系统性能的标准[1]。当引入新系统时,这种图像质量控制测量还用于PET/MR成像中PET性能的测量,且在评估PET/MR成像性能的临床研究中比较依赖于NEMA IQ体模测量[2-4]。Drzezga A等[5]提到PET/MR图像的剂量优化研究也依赖于NEMA IQ体模测量,所有这些研究均建立在体模精确的衰减校正(attenuation correction,AC)基础上。
为了获得定量准确的PET图像,用质量控制体模来确定扫描仪的性能参数,需要对所采集的PET数据进行校正,以减弱由扫描对象以及系统的硬件造成的光子衰减[4,6]。在PET/CT成像中,关于被扫描物体衰减特性的信息是从CT扫描本身获得;在PET/MR成像中,应用基于MR的衰减校正方法来校正由人体组织引起的衰减[7-8]。但是,体模成像的准确性和适用性还需要系统全面的量化。目前,基于MR的AC(MRAC)只考虑液体模中的溶液,其提供了足够的MR信号,但在PET中其不适用于体模外壳中常用的塑料或玻璃材料,因为这些材料在MR成像中无信号。因此,本研究将预先获得的基于CT模板的μ-map与NEMA IQ体模结合使用,并将μ-map安装在PET/MR系统上进行NEMA IQ体模质量控制实验并与之对比,评估基于MR-AC的定量效果及图像质量的影响。
1 材料和方法
1.1 设备及体模
(1)GE SIGNA TOF PET/MR。主磁场B0为3.0T,系统配备了专用的MR成像协议,用于采集和生成μ-map(MR-AC)以及NEMA IQ体模专用的体模方案(CT-AC)。
(2)NEMA IQ体模。外壳为丙烯酸玻璃材料,衰减系数μ~0.118 cm-1,由6个小球和中心肺部插件组成,小球内径分别为10 mm、13 mm、17 mm、22 mm、33 mm和37 mm,厚度约为1 mm;位于体模中心的肺部插件的平均密度为(0.3±0.1)g/ml[1,9]。
1.2 实验方法
(1)体模制备。NEMA IQ体模的背景和10 mm、13 mm、17 mm及22 mm的球体填充有18F-氟代脱氧葡萄糖(18F-flurodeoxyglucose,18F-FDG)与纯水混合,使用NEMA指定的4∶1球体-背景活性浓度比[1,3,8-9]。测量开始时的示踪剂活性浓度:体模背景为(5.3±0.053)kBq/ml;10 mm、13 mm、17 mm及22 mm小球为(21.2±0.05)kBq/ml。33 mm、37 mm的球体装满水。
(2)MR-AC。GE SIGNA PET/MR系统的MR-AC采集执行3D射频扰相梯度回波(spoiled gradient recalled,SPGR)序列(LAVA-FLEX)轴向定位,从同相和反相图像中导出水和脂肪图像,然后将MR数据集分成4个组织类别,即空气、肺、脂肪和软组织,脂肪和软组织的衰减系数为0.086/cm-1的0.095/cm-1[7-10](见表1)。
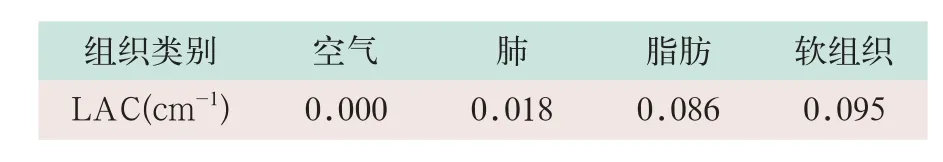
表1 四类组织类别的衰减系数
(3)CT-AC。GE SIGNA PET/MR系统为NEMA IQ体模应用基于CT的模板—从经过AC的PET图像中提取NEMA IQ体模的定位信息,利用预定义的方法将体模基于CT的衰减图导入并与测量所得的数据进行配准[8-9]。
(4)PET图像重建。在有序子集最大期望值算法(ordered subsets expectation maximization,OSEM)条件下进行不同的方法重建PET图像,包括重建矩阵192×192,256×256;迭代次数为2,3,4次迭代,重建滤波器均选用高斯4 mm半高宽(full width at half maximum,FHWM)。是否使用飞行时间(time off light,TOF)技术。
2 结果
2.1 图像数据分析
使用MATLAB编程读取了13×13的μ-map图像矩阵,并显示其像素值,PET图像反映的是γ射线透射组织的投影信息,像素值与线性衰减系数是一一对应的线性关系。
(1)使用MR-AC方案时,MR-AC μ-map中并未显示体模外壳以及各小球外壳的信号,而是把这些玻璃材料分配给了背景溶液(见图1)。

图1 基于MR的衰减校正图
(2)GE SIGNA PET/MR系统将肺插入物的衰减系数按照人体解剖结构定义为肺的衰减系数(0.018 cm-1)。将NEMA IQ体模中的水和18F-FDG的混合物视为脂肪及其他组织,其中体模边缘定义的脂肪为0.085 cm-1和0.086 cm-1,因此分别指定了不正确的衰减系数[9](见表2)。
(3)使用CT-AC方案时,CT-AC μ-map中清晰的显示出体模外壳以及各小球外壳的信号,而不是把这些玻璃材料分配给背景溶液(见图2)。

图2 基于CT的衰减校正图
(4)使用体模专用的CT-AC方案时,肺部插件及水和18F-FDG的溶液被分配了正确的衰减系数:0.032 cm-1和0.095 cm-1(见表3)。
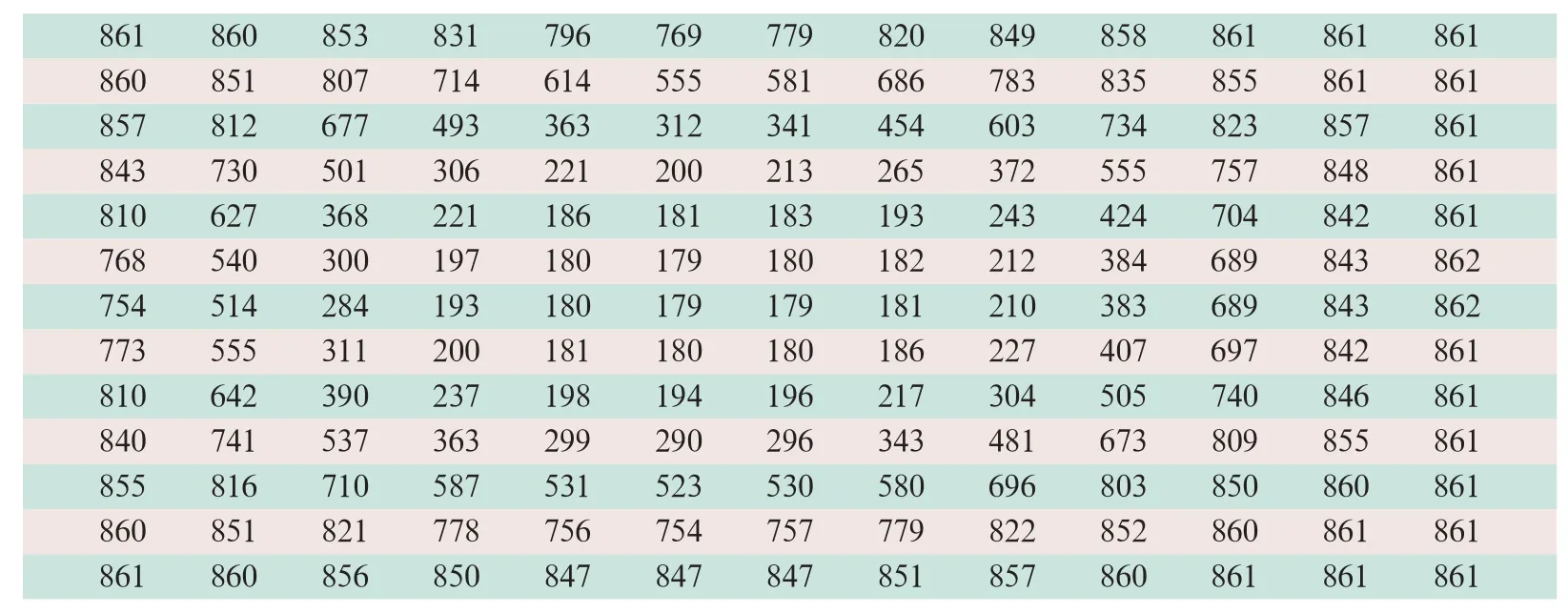
表2 MATLAB软件读取的MR-AC衰减图像素值

表3 MATLAB软件读取的CT-AC衰减图像素值
2.2 图像质量对比
在两种AC方法条件下分别对比了重建矩阵(192×192,256×256)、迭代次数(2,3,4次迭代)以及是否使用TOF(TOF和NOTOF)的图像质量。
(1)在使用重建矩阵为192×192时,CT-AC条件下的NEMA IQ放射性球体的SNR比使用MR-AC时分别高出5.9%、12.4%、23.6%和33.6%;重建矩阵为256×256时,CT-AC条件下的NEMA IQ放射性球体的SNR比使用MR-AC时分别高出3.1%、9.2%、17.0%和26.5%(见图3)。

图3 MR-AC和CT-AC图像在不同重建矩阵下的SNR曲线图
(2)迭代次数为2次时,CT-AC条件下的NEMA IQ放射性球体的SNR比使用MR-AC时分别高出6.9%、13.1%、22.9%和27.4%;迭代次数为3次时,放射性球体SNR分别高出5.9%、12.4%、23.6%和33.6%;迭代次数为4次时,放射性球体SNR分别高出0.6%、12%、22.8%和33.4%(见图4)。

图4 MR-AC和CT-AC图像在不同迭代次数下的SNR曲线图
(3)使用TOF技术重建时,CT-AC条件下的NEMA IQ放射性球体的SNR比使用MR-AC时分别高出12.6%、27.0%、44.2%和83.7%(见图5)。
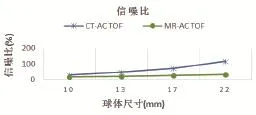
图5 MR-AC和CT-AC图像使用TOF技术时的SNR曲线图
3 讨论
在一体化PET/MR数据采集期间,处于在PET视野中的人体组织和硬件组件,如体模或射频线圈会衰减PET光子,为了获得定量PET图像,需要执行AC[9]。CT数据反映的是物质的电子密度分布信息,CT图像中的CT值可以直接计算出物质的衰减系数,其光子能量可以通过双线性插值的方法调整到511 keV的光子能量,获得511 keV的线性衰减系数可以直接对PET发射数据进行AC,因此CT-AC具有更加准确的定量性能。MR数据反映的是物质的弛豫时间和质子密度分布信息,PET衰减的组织信号需要从MR数据中导出,执行专用的MR序列对物质进行组织分割,然后分配给每类组织固定的衰减系数,因此MR-AC在定量准确性上还存在诸多挑战,且MR-AC是基于临床的人体解剖标准,不能直接进行体模成像[2,8]及相关质量控制实验。
质量控制实验只有在各种系统准确和可再现的情况下才有效[11]。本研究的主要目的是为了使用具有MR-AC和CT-AC方案的NEMA IQ体模,评估PET/MR中的质量控制实验,其研究结果表明,MR-AC的方案用在PET/MR进行PET质量控制实验时,由于无法获取体模外壳以及各插件材料的MR信号,不能对这些材料进行AC,而系统会按照预定义解剖结构的衰减信息分配给体模衰减图,生成错误的μ-map,导致重建的PET数据存在显着偏差[9,12-13]。因此,这样的QC实验不能作为PET的定量标准。SIGNA PET/MR系统上,专门为NEMA IQ体模提供的AC方案是基于CT的AC方法,获得实质上更准确的μ-map。
对于GE SIGNA PET/MR系统,临床MR-AC已经将肺部插件分类为肺组织,在这种情况下,穿过插入物的响应线(line of response,LOR)的AC准确度将会更低,这会在PET的重建数据中导致更大的偏差。
4 结语
本研究通过对一体化PET/MR系统应用基于CT的AC来评估PET图像质量,并与使用基于MR的AC结果进行比较,验证用于进行PET质量控制实验的临床MR-AC方案导致不准确的结果,以及基于CT-AC的必要性和优越性。使用基于CT的方法评估图像质量参数其结果表明,与基于CT的AC相比,基于MR的AC导致定量不足及图像质量下降。
