3株传染性支气管炎病毒蛋鸡源河南株的S1基因序列分析
2019-06-28吴倩倩陈钦玺阚云超姚伦广王新卫
吴倩倩,许 鑫,陈钦玺,阚云超,姚伦广,王新卫,冀 君
(1.南阳师范学院 南阳市兽医生物工程技术研究中心/河南省伏牛山昆虫生物学重点实验室,河南 南阳 473061; 2.河南农业大学 牧医工程学院,河南 郑州 450002)
鸡传染性支气管炎(Infectious bronchitis,IB)是由传染性支气管炎病毒(Infectious bronchitis virus,IBV)引起的鸡的一种急性、高度接触性传染病[1]。IB在肉鸡临床上多以呼吸道症状和肾肿为特征,会引起高达30%的死淘率;蛋雏鸡感染IB后,除可引起死亡外,还会造成母鸡生殖系统的永久不可逆性损伤,表现为输卵管和卵巢发育不良或输卵管、子宫大量积水囊肿,最终造成“假母鸡”,出现无产蛋高峰、产蛋数量及蛋品质下降现象。此外,IB还有“腺胃型”、“肌肉损伤型”和其他复杂的临床症状,除了能够引起由鸡的生产性能下降所导致饲料报酬降低外,当其与大肠杆菌、支原体以及其他病毒性疾病等混合感染时还会加大临床观诊难度,从而造成巨大的经济损失并威胁养鸡业的健康发展[2]。
IBV属于冠状病毒科冠状病毒亚科的Gamma冠状病毒,病毒基因组为不分节的单股正链RNA,全长约27.6 kb,编码小膜蛋白(E)、膜蛋白(M)、核衣壳蛋白(N)和纤突蛋白(S)等4种主要结构蛋白[3-4]。纤突蛋白(S)与宿主细胞膜上的病毒受体结合后被宿主细胞的蛋白酶裂解为N端的S1蛋白和C端的S2蛋白[5]。其中,S1蛋白与IBV的感染性、致病性及组织嗜性密切相关,能诱导机体产生中和抗体、血凝抑制抗体及细胞介导的免疫应答[6-8],它也是决定IBV血清型特异性抗原决定簇的主要蛋白质[9-10]。由于IBV复制依赖RNA聚合酶,而RNA聚合酶缺乏校正能力[11],因此,病毒在复制过程中极易发生变异或重组。且随着疫苗的使用,会进一步加快IBV的基因变异。由于IBV不同毒株间S1基因变异较大,而S1基因序列会随着IBV毒株的进化发生差异累积,导致IBV毒株间的交叉保护程度减弱甚至完全丧失[12-13]。S1基因核苷酸序列的插入、缺失、点突变或重组可直接导致众多血清型或基因型的出现[14]。因此,基于S1基因的序列差异分析是IBV分子流行病学调查内容中的重点[15-17]。
本研究于2017年春季和秋季从河南省不同发病鸡场采集的疑似IB发病蛋鸡病料中分离到3株IBV,对其S1基因进行克隆、测序和序列分析,以期了解河南省IBV的流行情况,为有效防控IB提供理论依据。
1 材料和方法
1.1 材料
1.1.1 供试病料与鸡胚来源 供试病料为采集自南阳、信阳和安阳市鸡场疑似IBV感染的病死蛋鸡的气管、肺脏和肾脏等;9日龄SPF鸡胚购自北京梅里亚维通实验动物技术有限公司。
1.1.2 主要耗材与试剂 pMD18-T载体、大肠杆菌Top10感受态细胞、DNA分子质量Marker购自大连TaKaRa公司;EasyPure Viral DNA/RNA Kit、TransScript One-Step RT-PCR SuperMix购自北京全式金生物公司;DNA纯化、回收试剂盒购自美国OMEGA公司。
1.2 IBV的分离与鉴定
将疑似感染IBV的病死蛋鸡的气管、肾脏等组织浸泡液氮并研磨成细粉,再加入5倍体积的冷冻PBS缓冲液(含200 U/mL青霉素和200 μg/mL链霉素)后混匀,反复冻融3次,5 000×g离心10 min,收集上清液后通过0.2 μm滤膜进行过滤。取0.2 mL滤液接种于9日龄SPF鸡胚尿囊腔,于37 ℃孵育48 h后收取鸡胚的尿囊液,如此重复盲传3代。抽提盲传3代后的鸡胚尿囊液病毒总RNA,采用M基因和3′UTR的检测引物,进行RT-PCR检测。检测引物参考尚辉琴等[18]的研究,即用于扩增M基因的上游引物序列为5′-CCTAAGAACGGTTGGAAT-3′,下游引物序列为5′-TACTCTCTACACACACAC-3′,扩增目的条带长度为290 bp;用于扩增3′UTR保守基因片段的上游引物序列为5′-GGAAGATAGGCATGTAGCTT-3′,下游引物序列为5′-CTAACTCTATACTAGCCTAT-3′,扩增目的条带长度为740 bp。
1.3 IBV分离株S1基因的克隆与测序
根据GenBank中公布的IBV的基因序列,利用Primer Premier 5.0设计S1基因引物(上游引物为5′-AAGACTGAACAAAAGACCGACT-3′,下游引物为5′-CAAAACCTGCCATAACTAACATA-3′)。参照TransScript One-Step RT-PCR SuperMix试剂盒中的说明书,以提取的鸡胚尿囊液病毒总RNA为模板,进行RT-PCR扩增,扩增体系为20 μL:总RNA 0.5 μL,R-Mix 10 μL,E-Mix 0.3 μL,上、下游引物各0.6 μL,ddH2O补加至20 μL。RT-PCR程序:45 ℃ 30 min,95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,循环30次;72 ℃延伸10 min。电泳后回收RT-PCR产物,将其连接至pMD18-T载体并转化入大肠杆菌Top10感受态细胞中。最后将筛选出的阳性菌液,送至苏州泓迅生物科技有限公司测序,并对测序鉴定正确的IBV分离株进行命名。
1.4 IBV分离株S1基因序列的同源性分析
将获得的测序鉴定正确的IBV分离株S1基因序列用DNASTAR 7.1软件包中的“Seqman”进行拼接,并以NCBI下载的50株IBV的S1基因序列为参考进行同源性比较分析(表1)。使用MEGA 5.05软件中的“Clustal W”先进行多序列比对,再采用Neighbor-Joining方法,对IBV分离株和参考株的S1基因构建系统发育进化树,参考LI等[19]研究中对IBVS1基因的分型方法。根据系统发育进化树,得知核苷核序列和氨基酸序列的同源性。使用SimPlot 3.5.1和RDP 4.36软件进行IBVS1基因遗传重组分析。
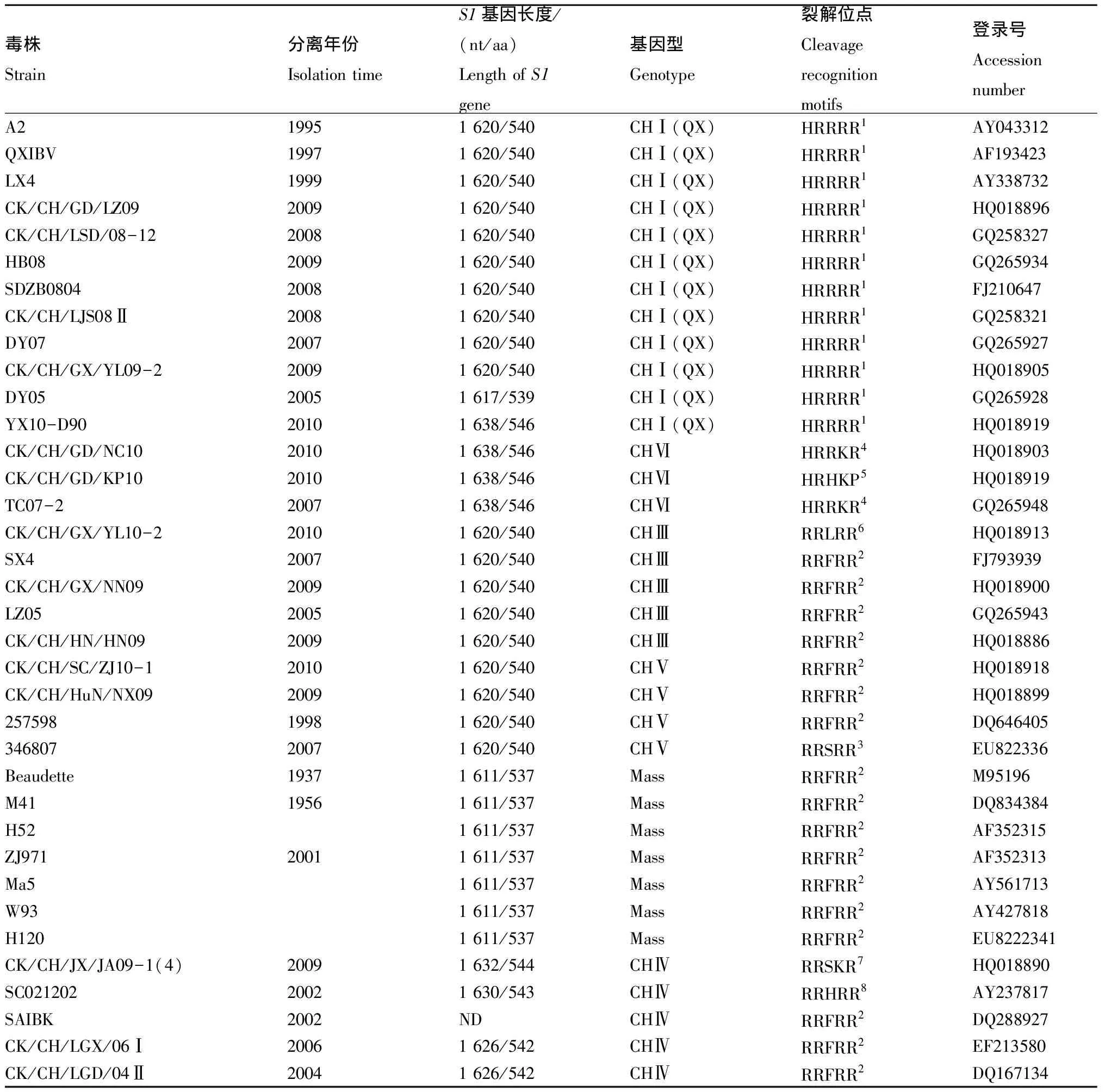
表1 50株IBV参考毒株Tab.1 50 IBV reference strains
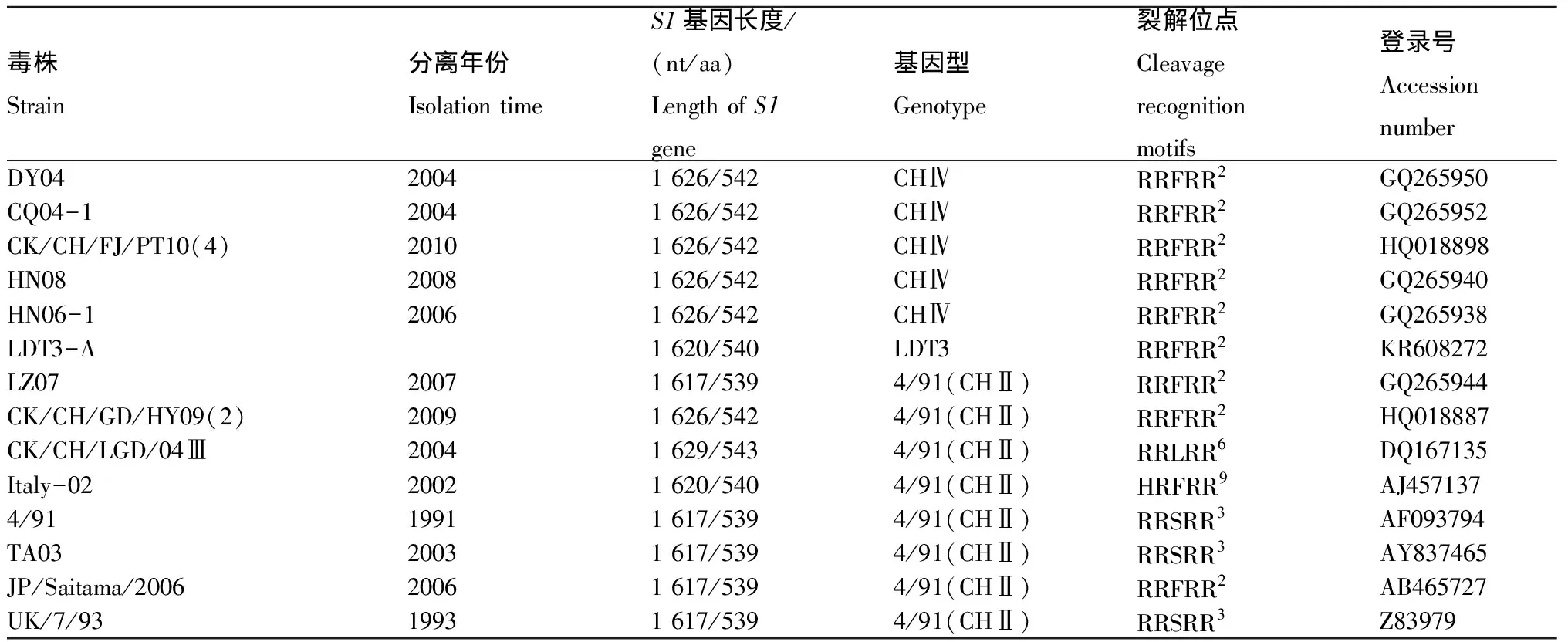
续表1 50株IBV参考毒株Tab.1(Continued) 50 IBV reference strains
注:ND表示没有记录。裂解位点分别为HRRRR1:His-Arg-Arg-Arg-Arg;RRFRR2:Arg-Arg-Phe-Arg-Arg;RRSRR3:Arg-Arg-Ser-Arg-Arg;HRRKR4:His-Arg-Arg-Phe-Arg;HRHKR5:His-Arg-His-Lys-Arg;RRLRR6:Arg-Arg-Leu-Arg-Arg;RRSKR7:Arg-Arg-Ser-Phe-Arg;RRHRR8:Arg-Arg-His-Arg-Arg;HRFRR9:His-Arg-Phe-Arg-Arg。
Note:ND means no documentation.Cleavage recognition motifs were HRRRR1:His-Arg-Arg-Arg-Arg;RRFRR2:Arg-Arg-Phe-Arg-Arg;RRSRR3:Arg-Arg-Ser-Arg-Arg;HRRKR4:His-Arg-Arg-Phe-Arg;HRHKR5:His-Arg-His-Lys-Arg;RRLRR6:Arg-Arg-Leu-Arg-Arg;RRSKR7:Arg-Arg-Ser-Phe-Arg;RRHRR8:Arg-Arg-His-Arg-Arg;HRFRR9:His-Arg-Phe-Arg-Arg.
2 结果与分析
2.1 IBV病毒的分离与鉴定
如图1所示,以鸡胚尿囊液中提取的病毒总RNA作为模板,利用M基因和3′UTR的检测引物通过RT-PCR方法进行检测,结果表明,分别扩增出290 bp与740 bp的条带,与预期目的条带大小一致,表明疑似感染IBV的病死鸡确实有IBV感染。
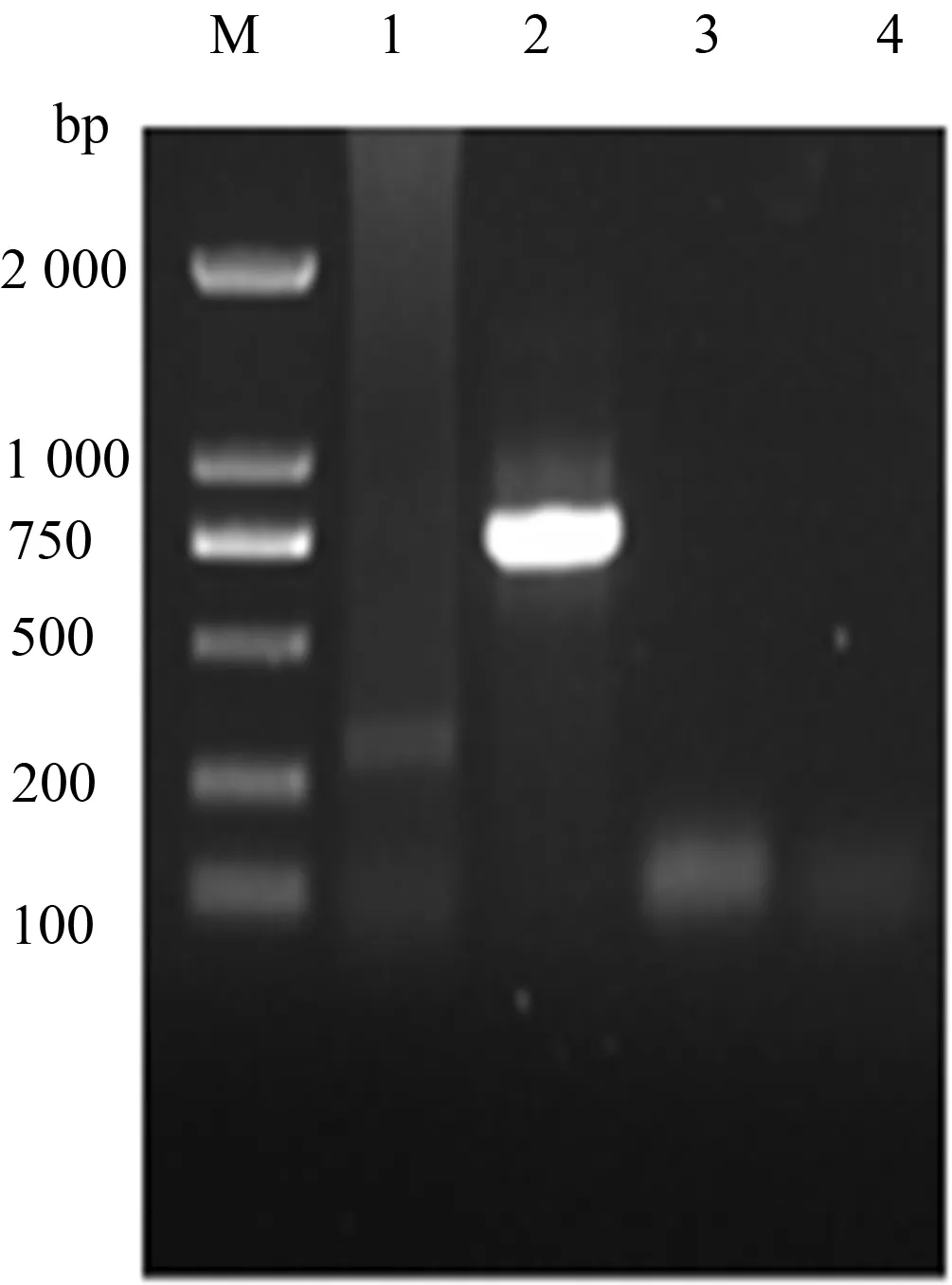
M:DL2000 DNA Marker;1、2:M和3′UTR基因的RT-PCR产物;3、4:阴性对照
2.2 IBV分离株S1基因的克隆与测序
如图2所示,以鸡胚尿囊液中提取的病毒总RNA作为模板,对IBV分离株的S1基因进行RT-PCR扩增,结果表明,扩增出的条带与预期目的条带大小一致,约为1 700 bp。测序结果正确的3个IBV分离株分别被命名为CK/CH/HN/NY1206/2017、CK/CH/HN/XY911/2017和CK/CH/HN/AY119/2018,其S1基因全长均为1 617 nt,编码539 aa。
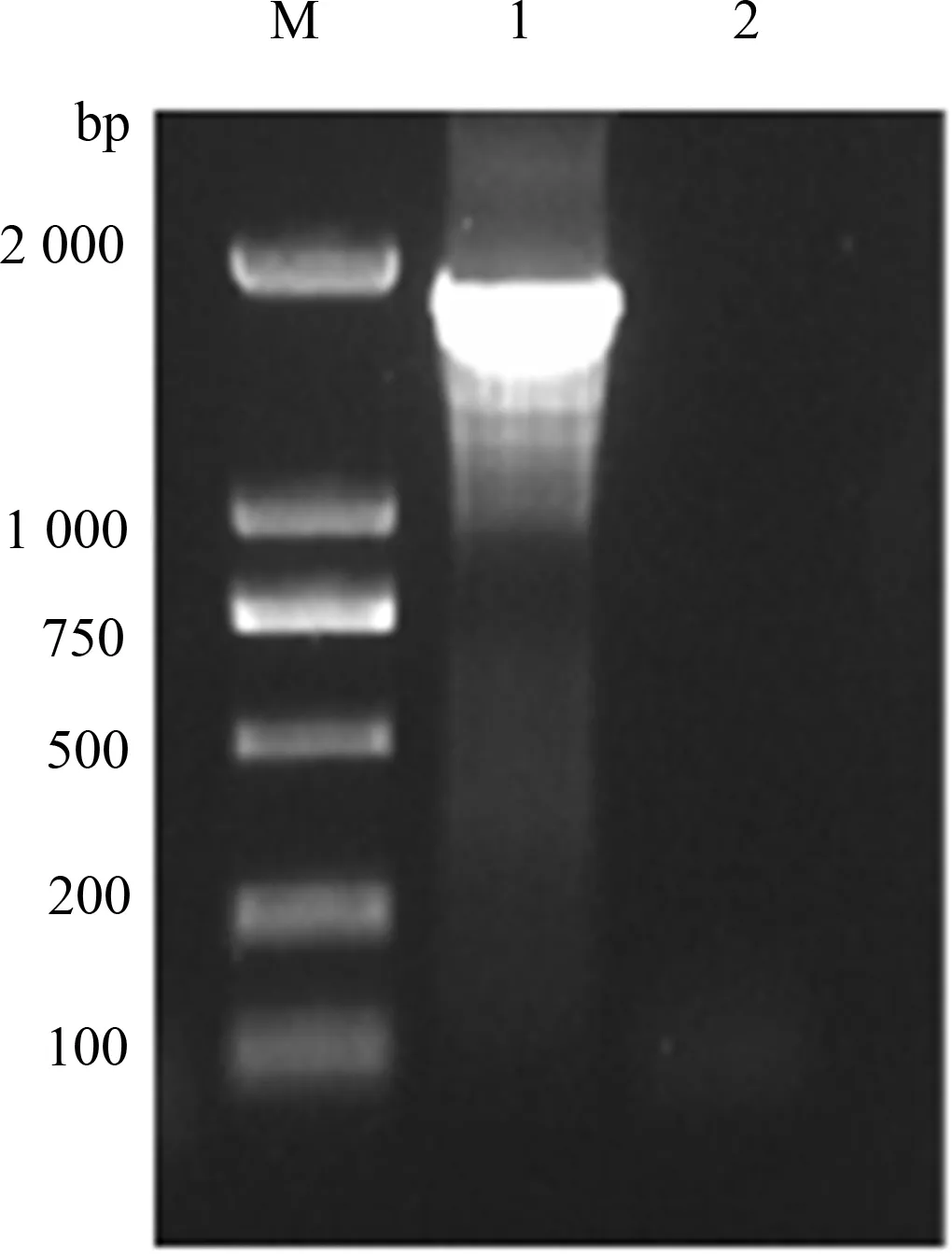
M:DL2000 DNA Marker;1:S1基因的RT-PCR产物;2:阴性对照
2.3 IBV分离株S1基因的遗传进化、同源性和裂解位点分析
如图3所示,根据IBVS1基因绘制的遗传进化树显示,3个IBV分离毒株与所有参考毒株主要分成CHⅠ(QX)、4/91(CHⅡ)、CHⅢ、CHⅣ、CHⅤ、CHⅥ、Mass等7个不同的进化分支(基因型),IBV分离株CK/CH/HN/NY1206/2017、CK/CH/HN/XY911/2017和CK/CH/HN/AY119/2018均属于4/91(CHⅡ)基因型。如图4和图5所示,核苷酸序列和氨基酸序列同源性分析表明,3个IBV分离毒株间的核苷酸和氨基酸的同源性较高,核苷酸和氨基酸同源性分别为94.4%~98.7%和93.5%~97.8%;CK/CH/HN/NY1206/2017与CK/CH/HN/XY911/2017核苷酸和氨基酸同源性高达98.7%和97.8%;CK/CH/HN/NY1206/2017与CK/CH/HN/AY119/2018核苷酸和氨基酸同源性分别为94.9%和94.2%;CK/CH/HN/XY911/2017与CK/CH/HN/AY119/2018核苷酸和氨基酸同源性分别为94.4%和93.5%。3个分离株的核苷酸序列及其推导的氨基酸序列,与位于同一基因型的参考毒株间同源性较高,与我国使用的Mass型常规疫苗H120和H52毒株的核苷酸和氨基酸同源性最低,分别仅为78.3%~78.4%和74.8%~75.4%,与4/91(CHⅡ)型疫苗4/91毒株的核苷酸和氨基酸同源性较高,分别达到94.7%~99.3%和93.9%~98.1%。推导的氨基酸序列显示,CK/CH/HN/NY1206/2017与CK/CH/HN/XY911/2017基因裂解位点为RRSRR,CK/CH/HN/AY119/2018为RRFRR,与基因型4/91(CHⅡ)分支中参考毒株裂解位点一致。
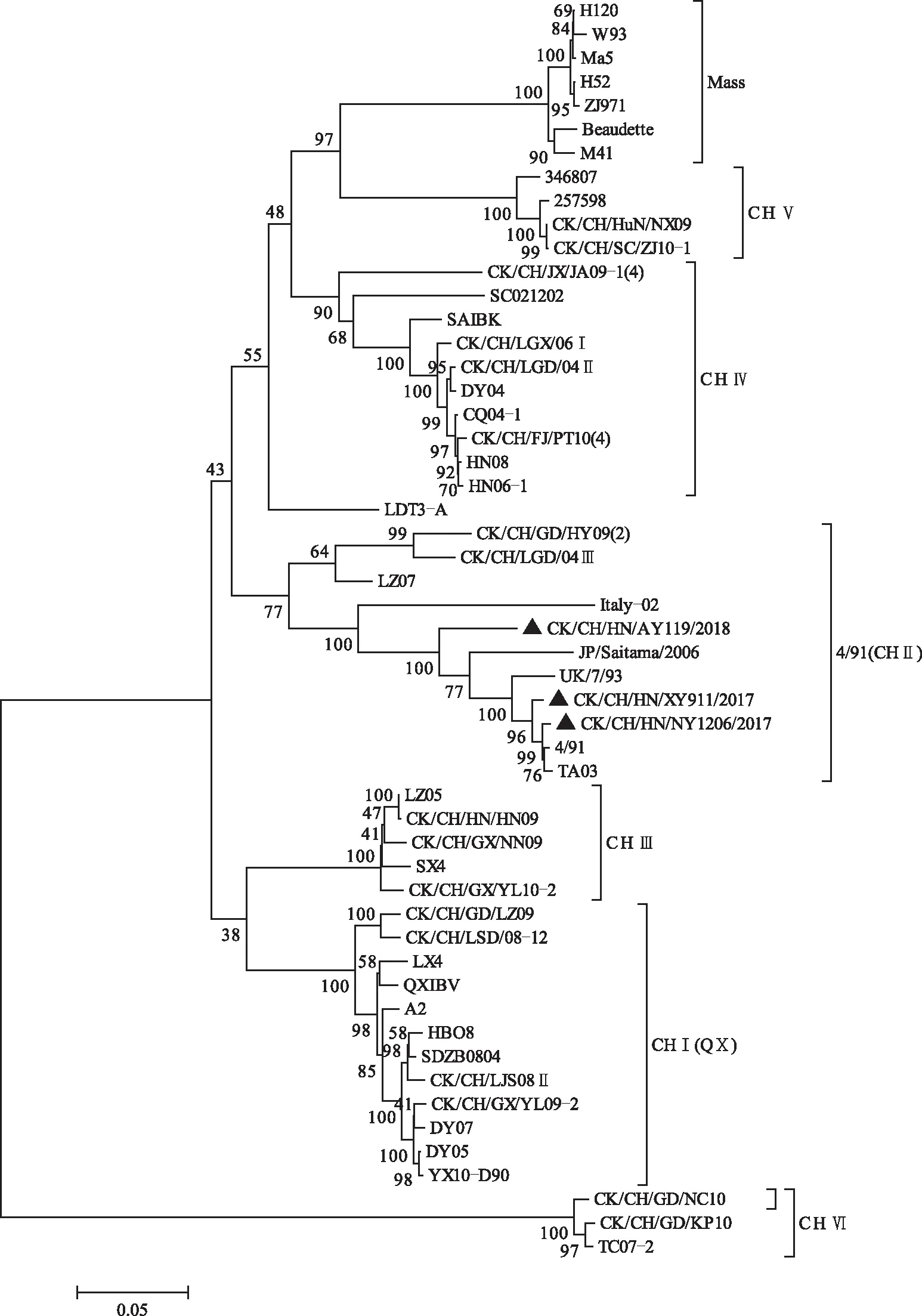
图3 IBV分离株与参考毒株S1基因进化树Fig.3 Phylogenetic trees constructed based on S1 gene from IBV isolates and reference strains

图4 IBV分离株与参考毒株核苷酸序列同源性
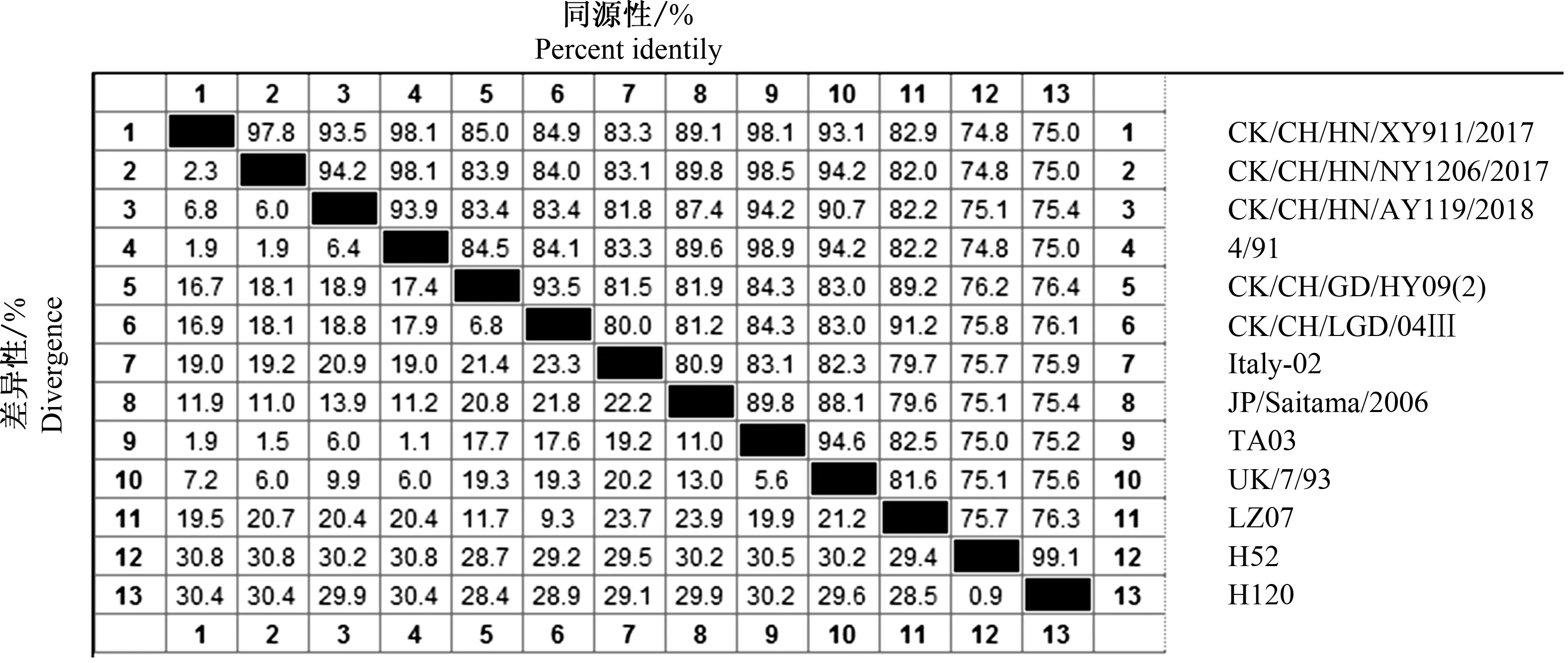
图5 IBV分离株与参考毒株氨基酸序列同源性
2.4 IBV分离株S1基因的遗传重组分析
如图6所示,利用SimPlot 3.5.1和RDP 4.36对IBV分离株的S1基因进行遗传重组分析发现,毒株CK/CH/HN/NY1206/2017与CK/CH/HN/XY911/2017均存在序列交叉,提示可能有重组事件发生。由表2可知,CK/CH/HN/NY1206/2017与CK/CH/HN/XY911/2017均是由基因型为4/91(CHⅡ)的IBV毒株JP/Saitama/2006和LZ07在S1基因处发生重组而产生的新毒株。CK/CH/HN/XY911/2017核苷酸序列796—1 340 nt与推测的亲本毒株LZ07高度同源,相似性达98.9%,其他S1基因核苷酸序列与推测的亲本毒株JP/Saitama/2006相似性达91.8%,RDP 4.36软件分析计算的P值为8.534×10-14。CK/CH/HN/NY1206/2017核苷酸序列797—1 339 nt与推测的亲本毒株LZ07高度同源,相似性达98.9%,其他S1基因核苷酸序列与推测的亲本毒株JP/Saitama/2006相似性达92.4%,RDP 4.36软件分析计算的P值为1.312×10-14。
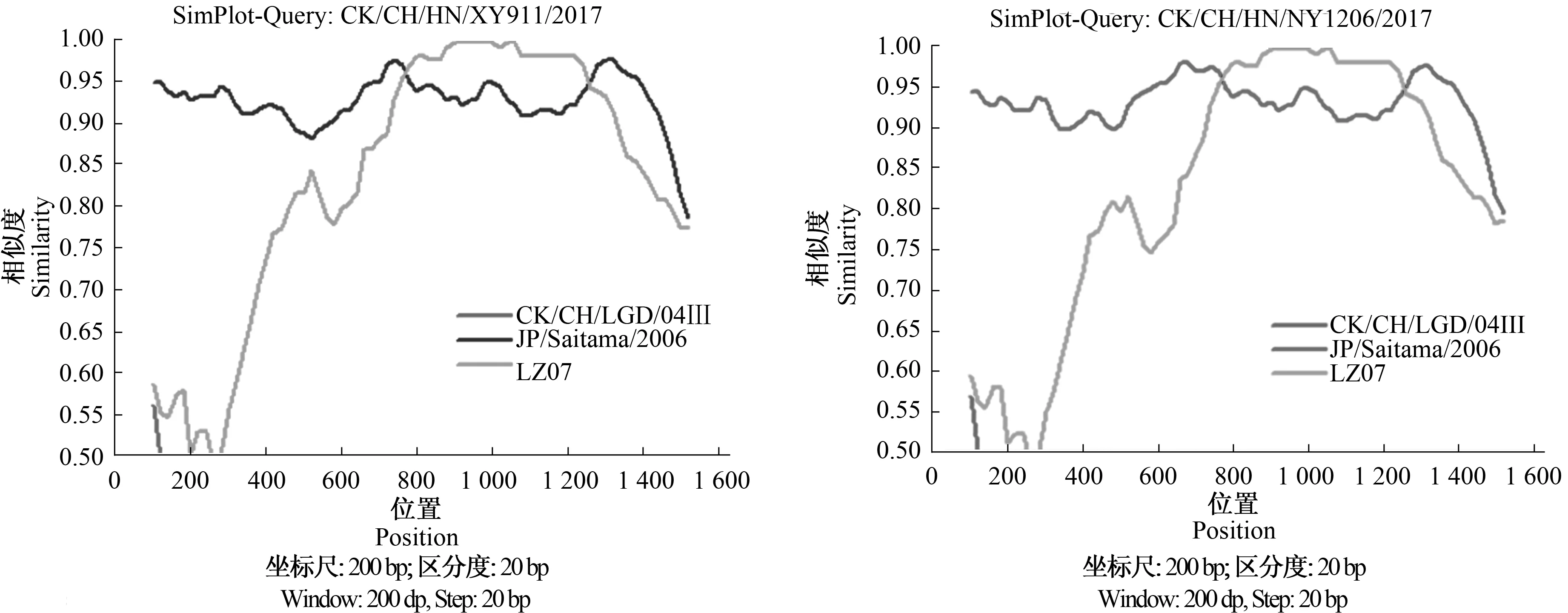
图6 SimPlot 3.5.1软件检测IBV分离株的S1基因遗传重组结果Fig.6 Results of detecting recombinant S1 gene of IBV isolates by SimPlot 3.5.1 software
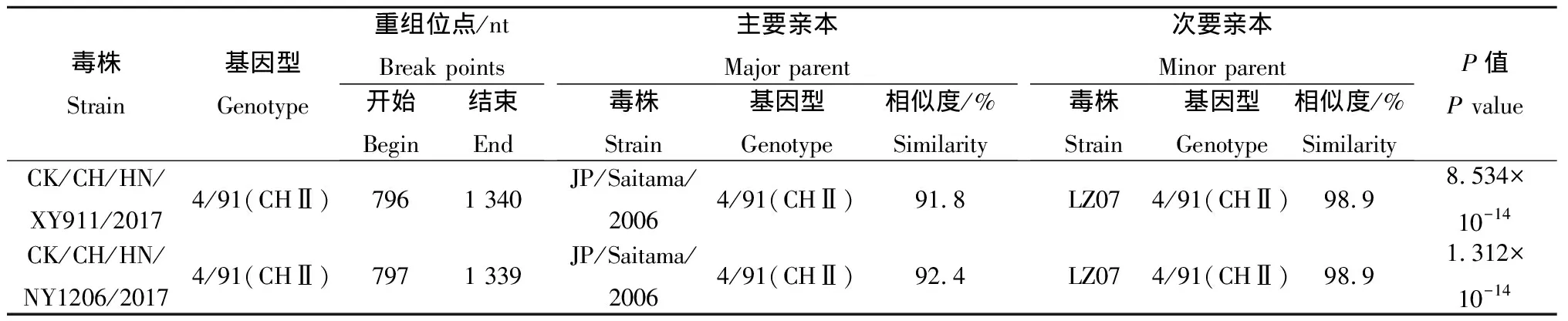
StrainGenotype/nt Break pointsBeginEndMajor parentStrainGenotype/%SimilarityMinor parentStrainGenotype/%SimilarityPP valueCK/CH/HN/XY911/20174/91(CHⅡ)7961 340JP/Saitama/20064/91(CHⅡ)91.8LZ074/91(CHⅡ)98.98.534×10-14CK/CH/HN/NY1206/20174/91(CHⅡ)7971 339JP/Saitama/20064/91(CHⅡ)92.4LZ074/91(CHⅡ)98.91.312×10-14
3 结论与讨论
IB是一种对家禽养殖业具有重要影响且全球分布的传染性疾病。苗立中[20]对山东地区分离的48株IBV进行鉴定,结果显示,有46株属于CHⅠ(QX)基因型,2株属于Mass基因型,表明CHⅠ(QX)基因型已成为山东地区IBV流行的优势基因型。XU等[4]研究发现,近年来,TW Ⅰ型病毒在中国的流行呈上升趋势,除此之外,GI-19型和常用的4/91(CHⅡ)型疫苗之间发生了重组事件,从而产生了不同的IBV分离株。
本研究参照LI等[19]建立的分型方法,基于S1基因的遗传进化树进行分型,得到3株IBV分离株CK/CH/HN/NY1206/2017、CK/CH/HN/XY911/2017和CK/CH/HN/AY119/2018,它们均属于4/91(CHⅡ)基因型。其中IBV分离株CK/CH/HN/NY1206/2017与CK/CH/HN/XY911/2017核苷酸及推导出的氨基酸同源性较高,可能与地理位置距离较近有关。有研究表明,4/91(CHⅡ)基因型毒株主要具有4个裂解位点(RRFRR、RRSRR、RRLRR、HRFRR)[19],本研究中IBV分离株CK/CH/HN/NY1206/2017与CK/CH/HN/XY911/2017基因裂解位点为RRSRR,CK/CH/HN/AY119/2018为RRFRR,裂解位点并未产生新的突变。
推测本研究中IBV分离株CK/CH/HN/NY1206/2017、CK/CH/HN/XY911/2017为发生S1基因遗传重组的毒株,通过SimPlot 3.5.1和RDP 4.36软件对分离株进行基因遗传重组分析,发现上述2株分离毒株均是由4/91(CHⅡ)基因型毒株LZ07和JP/Saitama/2006重组产生的新毒株。目前,我国鸡场使用的IBV免疫疫苗主要有Mass型(H120、H52、W93和Ma5)和LDT3型[13]。本研究中,IBV毒株CK/CH/HN/XY911/2017和CK/CH/HN/NY1206/2017与使用的Mass型常规疫苗H120和H52株的核苷酸和氨基酸同源性最低,仅为78.3%~78.4%和74.8%~75.4%,与4/91(CHⅡ)型疫苗4/91株的核苷酸和氨基酸同源性较高,达到94.7%~99.3%和93.9%~98.1%。本研究表明,河南省致蛋鸡产蛋下降的IBV流行基因型相对统一,使用4/91(CHⅡ)型疫苗应可提高蛋鸡抗IBV的保护率。但是由于IBV极易发生基因变异和重组,因此,持续性分子流行病学监控对防控IB具有重要的意义。
