移栽对黄瓜秧苗次生代谢物的影响
2019-06-28郭晓阳何太学代丹丹余彦鸽理向阳江海东郭红霞
郭晓阳,何太学,代丹丹,胡 颖,余彦鸽,理向阳,江海东,郭红霞
(1.河南省农业科学院 经济作物研究所,河南 郑州450002; 2.创世纪种业有限公司,广东 深圳 518048; 3.南京农业大学,江苏 南京 210095)
黄瓜作为我国蔬菜生产中主要的蔬菜种类之一,在国民经济中占据重要地位。农业生产过程中,黄瓜一般采取的是穴盘育苗后移栽定植,这种生产方式导致移栽后幼苗出现缓苗期,且时间较长,从而影响黄瓜的产量。针对作物移栽后出现缓苗期的现象,之前很多学者围绕着土壤温度不适[1]、根系受到破坏[2]等方面进行了大量的研究。
生物体受到刺激或干扰后,小分子代谢物的组成和含量会发生变化。这些内源代谢物对植物的正常生长及发育起到极为重要的作用,种类包括对植物生命活动所必需的初生代谢物,以及种类更为广泛、数量更为巨大的次级代谢产物。在生长发育过程中,任何外界因素的变化,包括育苗移栽以及炎热、寒冷、干旱、洪涝等气候变化,作物体内所产生的相关小分子代谢物质会有所不同;即使对同一种植物而言,在不同的生长时期或者发育阶段,代谢产物的种类及含量也会发生变化[3-4]。代谢组学是继基因组学和蛋白组学之后新近发展起来的一种组学技术。利用代谢组学的手段,对豆科植物百脉根(Lotusjaponicus)进行了代谢物质分析,从代谢水平上明确了百脉根的抗旱机制[5]。KUSANO等[6]对正常野生型拟南芥以及黄酮或者芥子酰基苹果酸合成途径异常的突变体拟南芥进行了代谢组学比较分析研究,对这2种不同基因型的样品在紫外辐射条件下进行光照24、96 h处理,结果表明,短期光照处理(24 h)的拟南芥可以分泌一些次级代谢产物来吸收紫外辐射产生的代谢产物。代谢组学研究包括指纹图谱、气质联用(GC-MS)、液质联用(LC-MS)以及核磁共振等方法。KATI等[7]利用超高液相色谱-单四级杆-飞行时间质谱仪检测手段对草莓的花瓣、花蕊、花萼、花托进行了无目标性的代谢指纹图谱分析,结果显示,一些花青素类、黄酮类、萜类等次级代谢产物及其派生物在各个器官组织中分布规律不同,明确了次级代谢产物的产生种类与功能性器官之间的对应关系。植物代谢组学在拟南芥、马铃薯、番茄、烟草、大豆、花生、大麦、莴苣上的研究都集中在水分胁迫、温度胁迫方面[8-12]。针对农业生产上由于育苗移栽引起的缓苗期现象,目前尚未发现从体内小分子代谢物的角度进行研究的报道。鉴于此,从代谢组学的角度研究不移栽与移栽处理黄瓜叶片中代谢产物种类及数量的变化,筛选出不移栽与移栽相比差异较大的生物标记物,从代谢组学水平对缓苗期出现的原因进行探索,为调控缓苗期研究提供理论依据。
1 材料和方法
1.1 试剂与仪器
主要试剂:乙腈、甲醇(质谱纯,Fisher Scientific,USA)、甲酸(色谱纯,Fisher Scientific,USA)。
主要仪器:超高液相色谱-单四极杆-飞行时间质谱仪(UPLC-QTOF)(Xevo G-2,Waters,USA)、Masslynx 工作站(Version 4.1,Waters,USA)、色谱柱(C181.7 μm,2.1 mm×100 mm,Waters,USA)、超声波提取机(KQ-3200DE,昆山市超声仪器有限公司)、纯化水系统(Milli-Q,Milli-Q INC., USA)、高速离心机(MULTIFUGE X1R,Thermo Scientific,USA)、电子天平(FA2004B,上海科佑仪器仪表有限公司)。
1.2 供试材料
将50孔育苗盘铺上基质[V(草炭)∶V(蛭石)=1∶3],基质相对湿度为70%,然后将市售黄瓜种子单粒播种于育苗盘中,上面再铺满基质,共播种20盘,放置于光照培养箱中进行培养,光照/黑暗条件为28 ℃/18 ℃,16 h/8 h,培养至二叶一心期。10盘黄瓜幼苗不移栽,继续在育苗盘中进行生长,另10盘黄瓜幼苗移栽至营养钵中,模拟大田环境培养。针对移栽处理和不移栽处理,分别于移栽后的1、3、5、7 d 取黄瓜叶片,贮存于-80 ℃备用。样品采集方法见表1。
1.3 样品前处理
把黄瓜叶片从-80 ℃冰箱取出后,迅速放入预冷的研钵中,加入液氮快速研磨成粉末状,准确称量50 mg磨碎后的粉末放入2 mL离心管中,加入含千分之一甲酸的40%甲醇混合液,配置成溶质溶液比为1∶30的溶液。超声提取30 min,于4 ℃在12 000 r/min条件下离心30 min,取上清液,用0.22 μm PTFE 滤膜(美国Sigma公司)过滤,取1 mL滤液进行高效液相色谱(HPLC)分析。提取液一式3份供上机检测及后续分析,为了监测仪器分析的稳定性和可重复性,质量控制(QC)样本由所有样本中各吸取10 μL混合均匀而成。每采集5个样品后,采集1针QC样本,随时监测仪器的状态。
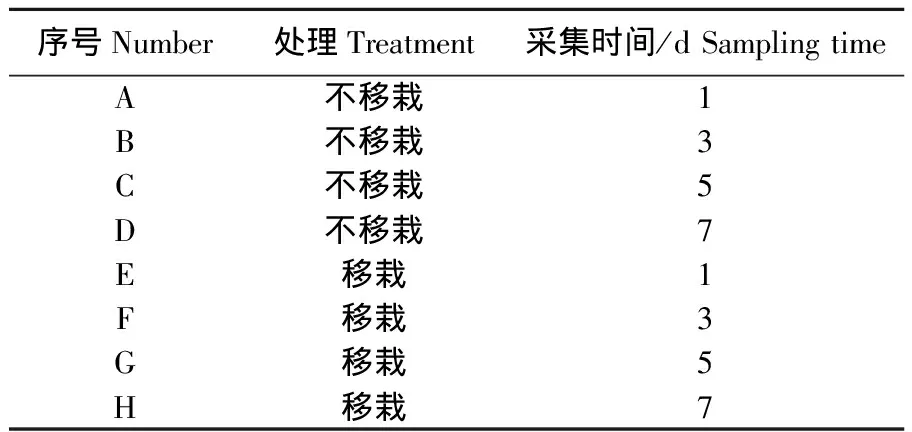
表1 黄瓜叶片取样方法
1.4 仪器所用色谱、质谱条件
1.4.1 色谱条件 色谱柱:BEH C18柱,100 mm×2.1 mm,粒度1.7 μm;流动相A,V(甲酸)∶V(去离子水)=1∶1 000;流动相B,V(甲酸)∶V(乙腈)=1∶1 000;所有试剂均为UPLC级。梯度洗脱,0~1.0 min,2%~5%流动相B,1.0~5.0 min,5%~30%流动相B,5.0~12.0 min,30%~90%流动相B,12.0~13.0 min,90%~100%流动相B,13.0~14.0 min,100%流动相B,14.0~17.0 min,2%流动相B。流速为0.400 mL/min(表2)。柱温40 ℃。进样量为5 μL。
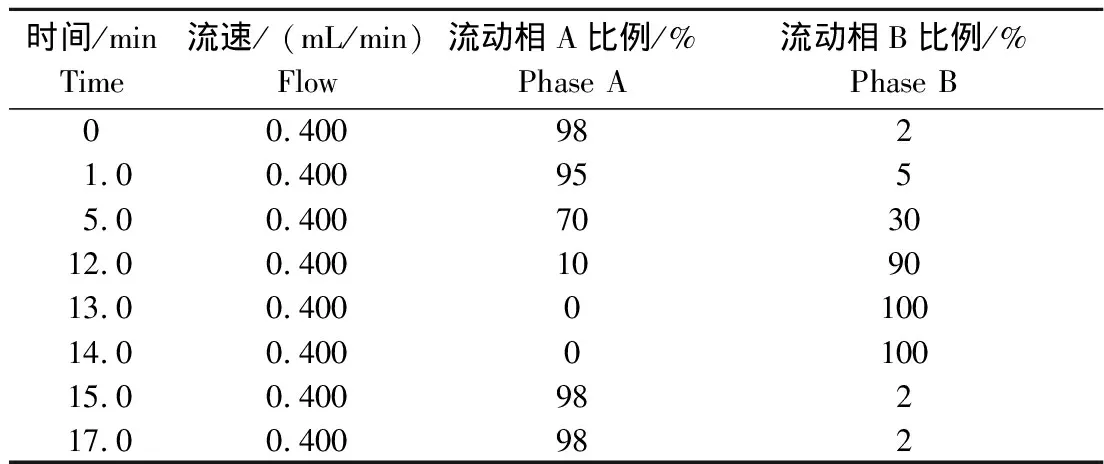
表2 流动相洗脱梯度
1.4.2 质谱条件 离子源:电喷雾(ESI);离子模式:负离子;毛细管电压2.5 kv;锥孔电压17 v;电喷雾电压1.6 kv;扫描时间0.1 s;扫描间隔0.02 s;离子源温度110 ℃;离子进料毛细管温度450 ℃;脱溶剂流速800 L/h;锥孔气流50 L/h;雾化气、吹脱气、辅助加热气、碰撞气均为高纯氮气;离子监测质荷比(m/z)100~1 200。以质荷比为554.261 5的亮氨酸-脑啡肽(LE)[M-H]离子为质量锁定,通过LockSpray系统保证质量的准确性和重现性。
1.5 数据分析
因为质谱数据采集的格式为应用于UNIFY软件分析的continuum格式,需要首先应用Waters Masslynx4.1 software(Waters,USA) 软件对获得的原始数据格式转换成centroid格式(cen.raw)。转换成功后用Masslynx4.1 software(Waters,USA)进行数据处理,包括峰识别、峰过滤、峰对齐等处理工作,优化参数,分析的结果最终包括保留时间(Retention Time)和质荷比(m/z)及峰面积的二维数据矩阵。然后应用EZinfo软件对处理过的数据进行多元统计分析,主要包括无监督的分析方法——主成分分析(PCA)以及有监督的分析方法——经过正交去噪后的偏最小二乘法(OPLS-DA),通过设定过滤条件,模型中变量重要性投影(VIP)>1,P<0.05,找到差异化合物,然后利用UNIFY数据库以及在线数据库进行差异化合物的初步鉴定。数据分析所需软件及应用网站如下:Waters Masslynx4.1 software (Waters,USA);UNIFY software(Waters,USA);ChemSpider(www.ChemSpider.com);KEGG(http://www.genome.jp/keg/);MassBank (http://www.massbank.jp/);METLIN(http://metlin.scripps.edu/);MMCD(http://mmcd.nmrfam.wisc.edu/);PubChem(http://pubchem.ncbi.nlm.nih.gov)。
2 结果与分析
2.1 不移栽与移栽处理黄瓜叶片代谢指纹谱的数据获取
通过UPLC-QTOF-MS系统获取了不移栽(图1a)和移栽(图1b)2种处理7 d后的黄瓜叶片代谢物总离子流图。从图1可以得知,不移栽与移栽处理的黄瓜叶片代谢图谱中的峰和保留时间是相似的,只是在部分保留时间处存在峰高和峰面积上的差别,基于此情况,需对这些峰进行匹配,形成一个二维数据矩阵以供数据分析。
2.2 不移栽与移栽处理黄瓜叶片代谢产物的主成分分析
从图2可以看出,A与E、B与F、C与G处理聚集在一起,没有出现明显分离,但是D与H处理出现了明显分离,这说明不移栽与移栽处理相比,在7 d出现了差异,也就是说在移栽后7 d出现了缓苗期。对不移栽与移栽处理的1、3、5 d的样品研究缓苗期形成的关键物质意义不大,所以确定以移栽后7 d的样品为研究对象,进行缓苗期形成的差异化代谢物的挖掘。
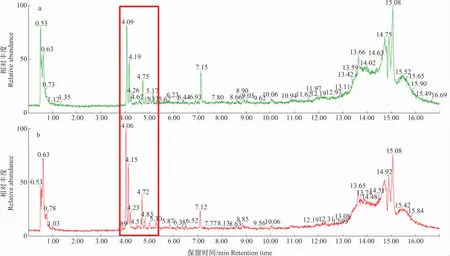
a.不移栽;b.移栽 a.No-transplanting;b.Transplanting

a、b.不同移载处理的得分图和载荷图;A—H同表1a,b.Score plot and loading plot of cucumber leaves under different treatments;A—H as same as Tab.1图2 不移栽与移栽处理黄瓜叶片PCA分析结果Fig.2 PCA of cucumber leaves under no-transplantation and transplantation
2.3 不移栽与移栽处理黄瓜叶片代谢产物的OPLS-DA分析
为进一步深入研究移栽处理对黄瓜叶片代谢的影响,对样品数据进行了二元比较分析。在OPLS-DA数据模型中,以离子相对强度作为X轴上的变量,黄瓜叶片各种化合物含量作为Y轴上的变量。为了防止OPLS-DA模型的过度拟合,对数据进行了置换检验(Permutation test)。经过正交去噪后的OPLS-DA能更加清晰地区分不移栽与移栽2个处理的样品代谢物质差异(图3a)。首先,采用OPLS-DA模型中的S-plot选择差异变量,在S-plot图中离原点越远的点表示对2种处理下样本分类的贡献越大,即越靠近左下角和右上角的化合物表示对样本的分类贡献越大(图3b),与PCA中的载荷图相吻合;其次,根据模型中变量重要性投影(VIP),VIP值越大,变量对模型越重要。如果VIP值大于1,则认为变量可以很好地对Y进行解释。因此,本研究选取模型中VIP>1的差异变量。最后结合t检验的P值对所筛选的差异变量进行验证,其中P<0.05差异变量被认为是移栽前后关键的差异性次级代谢物。根据以上2个筛选条件VIP>1和P<0.05,共找出6种差异标志代谢物。

a、b分别为不同移栽处理的得分图和S-plot图
2.4 不移栽与移栽处理黄瓜叶片差异代谢物质鉴定
通过对黄瓜叶片样品进行一级质谱测定,可以得到各个峰的一级质谱信息,进而推测出各物质的准分子离子峰(负离子)(图4a、b)。在此基础上,分别以准分子离子为母离子在相应的模式下进行二级质谱碎片的测定。基于差异代谢物的质荷比、二级质谱结果、UNIFY数据库进行初步鉴定,鉴定出的每种化合物包含以下信息:化合物名称、分子式、精准分子质量、保留时间、响应强度、质量偏差、理论匹配二级碎片数量以及加合离子。匹配度较好的化合物可以直接定性,一些不能确定的化合物则需要通过进一步的手动工具进行鉴定,比如元素组成中的i-Fit值、理论碎片匹配值以及相关文献和网络数据库[KEGG(http://www.genome.jp/keg/)、METLIN(http://metlin.scripps.edu/)、MMCD(http://mmcd.nmrfam.wisc.edu/)、PubChem(http://pubchem.ncbi.nlm.nih.gov)]的信息。结果显示,被鉴定出的物质有4种,COM1鉴定为戊糖,COM2鉴定为7-O-α-L-鼠李吡喃糖基-山柰酚-3-O-β-D-葡萄吡喃糖基,COM3 鉴定为(1-6)-β-D-葡萄糖苷山柰酚-3-O-(2G-α-L-鼠李糖基)-芸香糖苷,COM4鉴定为商陆苷元,COM5和COM6为未知物质(表3)。其中,COM1属于糖类物质,COM2和COM3属于黄酮类物质,COM4为萜类物质。
在不移栽处理和移栽处理中,6种差异化代谢物质的相对含量变化如图5所示,其中,移栽处理与不移栽处理相比,COM1、COM2、COM3的相对含量有所升高,COM4、COM5、COM6的相对含量有所降低。也就是说糖类物质、黄酮类物质有所升高,萜类物质有所降低。
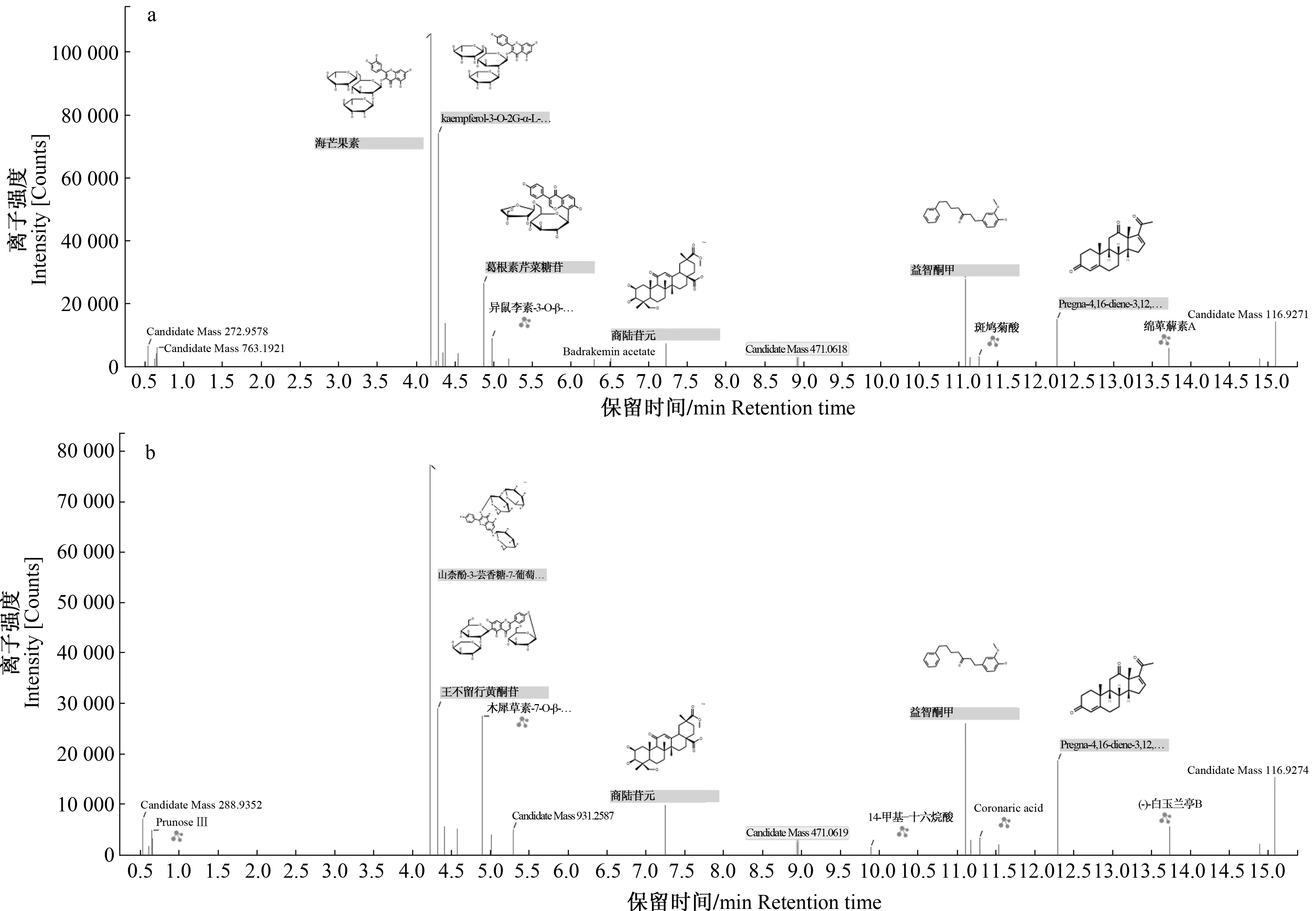
a.不移栽;b.移载 a.No-transplanting; b.Transplanting图4 不移栽和移栽处理黄瓜叶片代谢物质与UNIFY数据库的比对鉴定Fig.4 Identification of the metabolites between no-transplantation and transplantation of cucumber leaves using UNIFY database
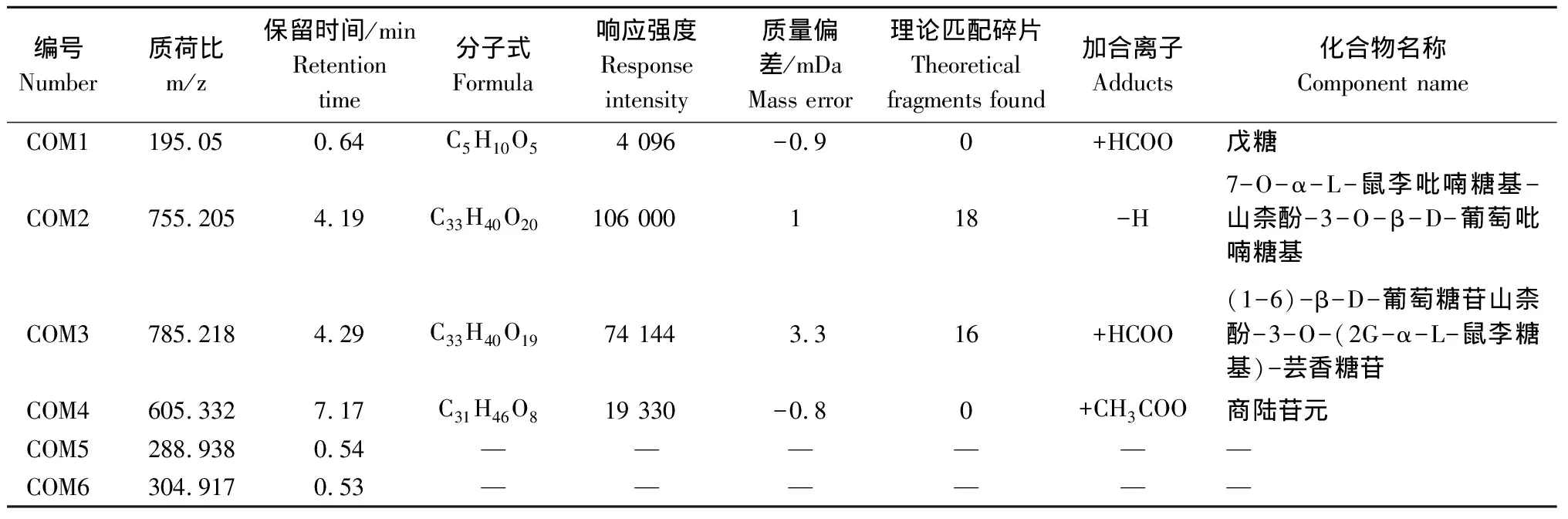
Number m/z/minRetention timeFormulaResponseintensity/mDaMass errorTheoretical fragments foundAdductsComponent nameCOM1195.050.64C5H10O54 096-0.90+HCOOCOM2755.2054.19C33H40O20106 000118-H7-O-α-L---3-O-β-D-COM3785.2184.29C33H40O1974 1443.316+HCOO(1-6)-β-D--3-O-(2G-α-L-)-COM4605.3327.17C31H46O819 330-0.80+CH3COOCOM5288.9380.54——————COM6304.9170.53——————
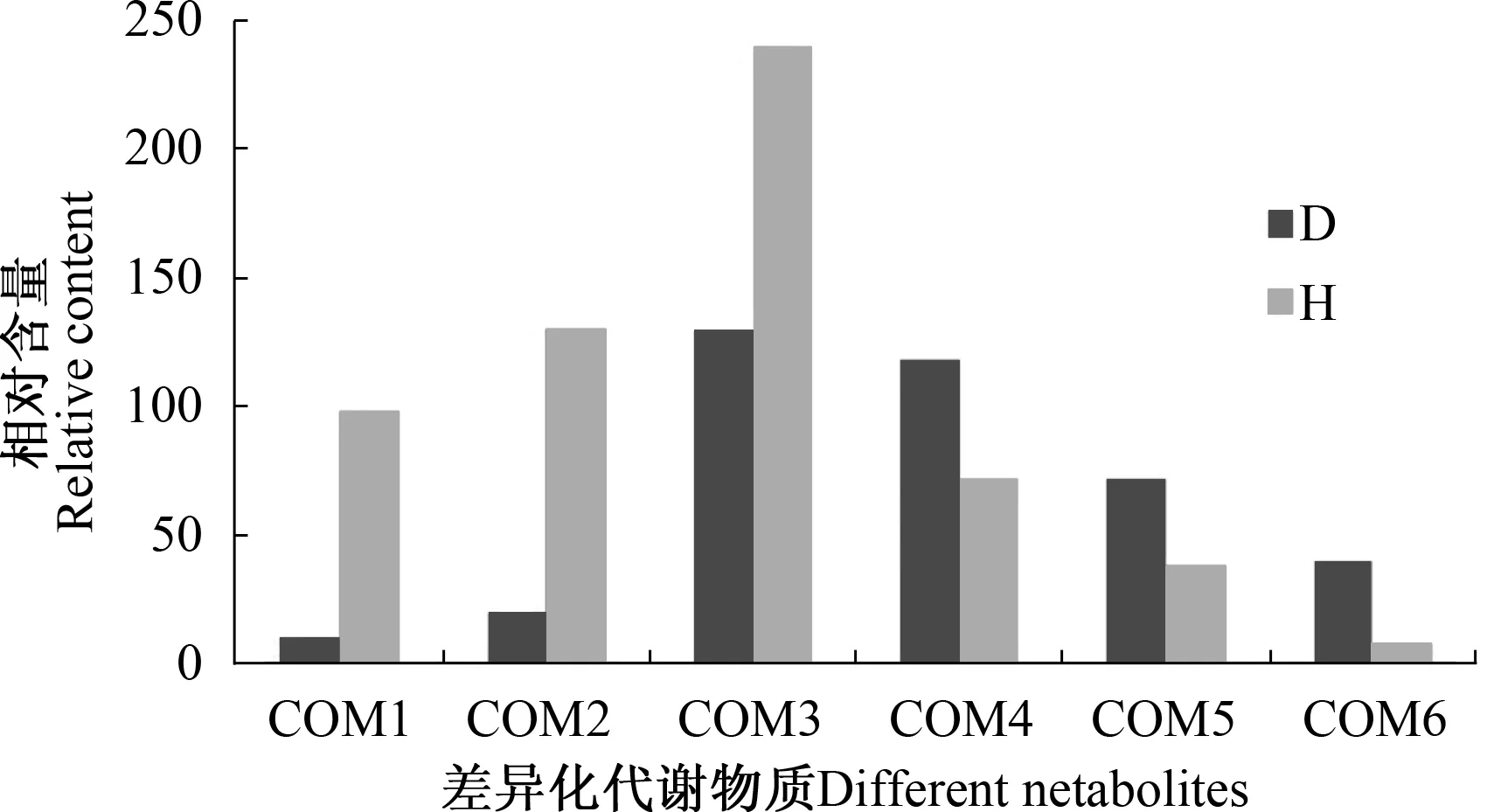
图5 不移栽(D)和移栽(H)处理黄瓜叶片差异化代谢物的相对含量Fig.5 The relative contents of the different metabolites between no-transplantation(D) and transplantation(H) of cucumber leaves
3 结论与讨论
黄瓜作为重要的蔬菜品种,如果缓苗期过长,就会严重影响早发,降低产量。本试验研究了移栽对黄瓜秧苗次生代谢物的影响,结果发现,不移栽处理与移栽处理相比,1、3、5 d的样品都聚集在一起,并没有明显的分离,而7 d的样品出现了显著的分离,这说明移栽后7 d黄瓜幼苗出现了缓苗期,这与生产上缓苗期的出现时间大致接近[2]。进一步通过OPLS-DA二元统计分析,找到了6种不移栽处理与移栽处理相比的差异性标记物,这些差异性标记物在缓苗期形成过程中起到关键作用。然后,通过UNIFY数据库以及在线数据库进行差异化代谢物质鉴定,得到其中4种生物标记物,分别为戊糖、7-O-α-L-鼠李吡喃糖基-山柰酚-3-O-β-D-葡萄吡喃糖基、(1-6)-β-D-葡萄糖苷山柰酚-3-O-(2G-α-L-鼠李糖基)-芸香糖苷、商陆苷元,种类属于糖类、黄酮类以及萜类,其余2种尚未得到鉴定。
可溶性糖作为植物体内一种重要的渗透调节物质,在植物遭遇非生物胁迫时,通过调节其含量的变化来适应新的环境。黄酮类化合物的种类有9 000多种[13],在植物抗性方面有着重要作用,可以增强植物抗病性、抗虫性,抵御紫外辐射甚至调控植物体内激素的水平[14-16]。在女贞科[17]、黄芩[18]以及玉米[19]中研究发现,黄酮类代谢途径与非生物胁迫有直接联系[20]。萜类化合物可以调节植物的生长发育,调节植物的耐热性,抵御光氧化胁迫,直接或间接地参与植物防御等[21]。在本研究中,移栽处理和不移栽处理相比,糖类物质、黄酮类物质含量有所升高,萜类物质含量有所降低,初步确定这些差异化代谢物与移栽后缓苗期的形成密切相关。
ROUPHAEL等[22]通过液相色谱-质谱联用技术发现,油麦菜根系中积累的多胺及其偶合物在锌胁迫响应中起关键作用。在纳米铜胁迫下,黄瓜叶片和根系中氨基酸、抗坏血酸、酚类化合物水平显著上升,柠檬酸水平下降[23]。WANG等[24]研究发现,镉、铅处理的萝卜体内糖类、氨基酸和有机酸水平显著改变。在铅胁迫下,玉米根和茎中分别有20种和37种代谢物水平显著升高,包括多种氨基酸、有机酸和辅酶[25]。TIESSEN等[26]用高效液相色谱法对马铃薯块茎进行了代谢组学分析,检测了淀粉合成途径中的一系列底物、中间物、酶及产物量的变化,再通过对野生株和含有腺苷二磷酸葡萄糖焦磷酸化酶(AGPase)基因的马铃薯进行对比,提出了淀粉合成途径中一种新的调节机制。代谢组学是进行代谢网络分析及调控的有效手段。
育苗移栽这种生产方式造成的缓苗期对于作物来说也属于一种非生物胁迫。本试验结果显示,移栽处理与不移栽处理相比,黄瓜叶片中的差异物大部分属于黄酮类物质,这也是黄瓜在受到移栽胁迫时从分子代谢水平上的一种自我调节,以此来适应移栽后的环境。应用代谢组学开展更多逆境胁迫下农作物应答相关研究,将提高对农作物耐受环境胁迫的分子机制的认识,能促进对农作物胁迫应答代谢规律的了解,有利于从整体水平上把握农作物胁迫应答机制,从而进行作物抗逆性的改良,提高农产品产量和质量,对农作物的遗传多样性、抗胁迫生理研究有重要的理论研究意义和实际应用价值。
