淫羊藿女贞子配伍协同激素对哮喘大鼠肺组织细胞凋亡的影响*
2019-06-28马紫童唐秀凤高莹莹李晓曦陈宇恒刘仁慧
马紫童 唐秀凤 高莹莹 李晓曦 陈宇恒 于 萍 刘仁慧
(首都医科大学,中医络病研究北京市重点实验室,北京100069)
支气管哮喘是全球范围内最常见的慢性呼吸道疾病,是一种以嗜酸性粒细胞、肥大细胞、淋巴细胞浸润为主的慢性气道变态反应性疾病,可伴有气流受限、气道高反应性、气道黏液腺肥大和气道重塑等[1-2]。近年来,哮喘的发病率和死亡率均呈现上升趋势,如何干预哮喘发生发展已经成为广大学者的研究重点[3-4]。基于气道炎症及气道重塑是哮喘的重要病理改变的认识,抗炎及改善气道重塑是防治哮喘的重要治疗策略[5]。因具有强大的抗炎作用,糖皮质激素(GC)是目前治疗哮喘的首选药物,但对气道重塑的改变并不理想。大量研究表明,在哮喘气道炎症及气道重塑的发生发展过程中,细胞凋亡发挥着重要的作用[6]。前期研究发现,淫羊藿女贞子煎剂或其有效组分可以协同GC改善哮喘大鼠气道炎症及气道重塑的病理改变[7-8],并能提高气道淋巴细胞的凋亡率,上调哮喘大鼠肺组织P53蛋白量,下调Bcl-2蛋白量。本研究以哮喘支气管肺组织的凋亡水平,及凋亡相关因子Caspase-9、Fas、Hras、NF-κB、Xiap mRNA表达为主要观察指标,进一步观察淫羊藿女贞子配伍协同糖皮质激素对哮喘气道细胞凋亡的影响作用并探讨其作用机制。现报告如下。
1 材料与方法
1.1 实验动物 SPF级健康雄性SD大鼠40只,体质量(120±10)g,由北京维通利华实验动物技术有限公司提供,合格证号:SCXK(京)2012-0001。
1.2 试药与仪器 卵蛋白(OVA,美国Sigma公司,货号A5253-100 g);氢氧化铝凝胶(美国Sigma公司,货号A8222-250 mL);淫羊藿、女贞子水提物(西安康威生物有限公司);淫羊藿有效成分提取物(有效成分总黄酮类,含总黄酮以淫羊藿苷计为80%,提取率2.5%,上海一林生物科技有限公司);女贞子有效成分提取物(总环烯醚萜+总黄酮类,含量分别以齐墩果酸和芦丁计,总含量>80%,提取率5%,上海一林生物科技有限公司);吸入用布地奈德混悬液(Bun,每支1 mg/2 mL,AstraZeneca Pty Ltd,货号 17311);一步法 TUNEL 细胞凋亡检测试剂盒(绿色荧光,碧云天生物技术研究所,货号C1088);免疫染色洗涤液(碧云天生物技术研究所,货号 P0106);蛋白酶 K(Proteinase K,碧云天生物技术研究所,货号 ST533);6×Loading Buffer(北京索莱宝科技有限公司);RNase-free H2O[天根生化科技(北京)有限公司];FastQuant RT Super Mix[天根生化科技(北京)有限公司];SuperReal荧光定量预混试剂彩色版[SYBR Green,天根生化科技(北京)有限公司]。402A超声雾化器(江苏鱼跃医疗设备有限公司);雾化箱 (规格40 cm×30 cm×20 cm,以有机玻璃为材料自制);分光光度计(北京博奥,型号NanoQTM);荧光定量 PCR 仪(ABI,型号 7900HT);尼康(Nikon)ECLIPSE 80i生物显微镜及NIS-Elements BR 3.2图像分析软件(北京锐驰恒业仪器科技有限公司)。
1.3 分组与造模 取雄性SPF级SD大鼠,体质量(120±10) g,42 只,随机分为 7 组,每组 6 只,即正常对照组(对照组)、哮喘模型组(模型组)、布地奈德组、淫羊藿女贞子煎剂组(煎剂组)、布地奈德合煎剂组(合煎剂组)、淫羊藿女贞子提取物组(提取物组)、布地奈德合提取物组(合提取物组)。卵蛋白致敏及激发复制大鼠哮喘模型。
1.4 给药方法 造模成功后,实验第36天开始给药,共计4周。具体给药方法见表1。

表1 给药方法
1.5 标本采集与检测 实验第65天,腹腔麻醉,迅速开胸,取出肺组织连同气管,冰浴。结扎左主支气管,剪下左肺,适当剪取部分左肺,经4%多聚甲醛固定,常规石蜡包埋切片。左肺其余部分-80℃冰箱保存。1)肺组织细胞凋亡水平。采用TUNEL法检测肺组织细胞凋亡水平,按照试剂盒说明书进行操作:首先将肺组织石蜡切片脱蜡,滴加 50 μL 蛋白酶 K(20 μg/mL),30 ℃作用25 min,PBS洗涤3次。滴加50 μL的TUNEL检测液,37℃避光孵育60 min,PBS洗涤3次。用抗荧光淬灭封片液封片后荧光显微镜下观察。2)肺组织Caspase-9、Fas、Hras、NF-κB、Xiap mRNA 表达。 Trizol法抽提肺组织总RNA,用分光光度计检测RNA的浓度,应用引物和M-MLVRT反转录酶在42℃15 min,95℃ 3 min进行逆转录反应。用SuperReal荧光定量预混试剂彩色版(SYBR Green)进行扩增,设立18S为内对照。取2 μL逆转录产物加入20 μL的PCR反应体系中, 反应条件为95℃ 15 min,95℃ 10 s,60℃30 s,40个循环。目的基因的相对表达量采用2-ΔΔCT相对定量法加以分析,以Nc组作为对照样本。引物序列见表2。
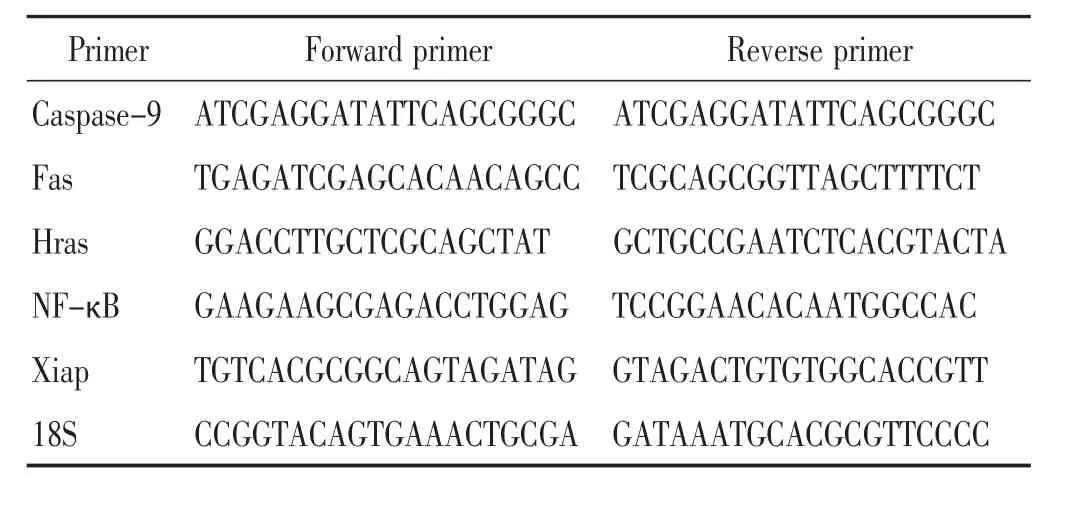
表2 引物序列
1.6 统计学处理 应用SPSS 21.0 for Windows统计软件。计量资料以(±s)表示,组间比较采用方差齐性检验及单因素方差分析,根据方差齐性检验结果选择LSD(方差齐)或 Tamhane′s T2(方差不齐)。P<0.05 为差异有统计学意义。
2 结 果
2.1 各组大鼠肺组织细胞凋亡水平比较 见表3和图1。与对照组比较,模型组细胞凋亡水平的阳性面积和积分光密度值均显著下调(P<0.05或P<0.01)。与模型组比较,煎剂组、合煎剂组、提取物组、合提取物组可上调细胞凋亡水平(P<0.05或P<0.01)。合煎剂组大鼠细胞凋亡水平较布地奈德组、煎剂组显著上调(P<0.05或P<0.01);合提取物组大鼠肺组织的细胞凋亡水平较布地奈德组、提取物组亦显著上调 (P<0.05或P<0.01)。提示激素给药的同时合用淫羊藿女贞子煎剂或提取物,均可协同上调大鼠肺组织细胞凋亡水平。
表3 各组大鼠肺组织细胞凋亡水平比较(±s)

表3 各组大鼠肺组织细胞凋亡水平比较(±s)
与对照组比较,**P<0.01;与模型组比较,△P<0.05,△△P<0.01;与布地奈德组比较, ■P<0.05, ■■P<0.01; 与煎剂组比较,○P<0.05,○○P<0.01;与提取物组比较,▲▲P<0.01。 下同
组 别 n 阳性面积 积分光密度对照组 6 107.79±9.04 422.67±55.85模型组 6 46.26±1.87** 180.96±11.98**布地奈德组 6 59.32±7.92 203.61±39.87煎剂组 6 69.08±3.24△△ 286.96±36.24△△■■合煎剂组 6 91.42±10.14△△■■○ 367.46±37.53△△■■○○▲▲提取物组 6 70.08±9.51△ 277.45±54.44△△■■合提取物组 6 92.42±11.27△△■■ 373.23±59.39△△■■○○▲▲

图1 各组大鼠细胞凋亡荧光图(200倍)
2.2 各组大鼠肺组织Caspase-9和Xiap mRNA表达的比较 见表4。与对照组相比,模型组大鼠肺组织Caspase-9 mRNA表达显著降低 (P<0.01),但Xiap mRNA显著升高(均P<0.01)。与模型组比较,除布地奈德组外其余4个给药组对Xiap mRMA有统计学差异(均P<0.05或P<0.01);煎剂组、合煎剂组、合提取物组Caspase-9表达差异有统计学意义(P<0.05或P<0.01)。与布地奈德组比较,合煎剂组、合提取物组Caspase-9 mRNA表达差异有统计学意义 (P<0.05或P<0.01)。
表4 各组肺组织Caspase-9、Xiap mRNA表达比较(±s)
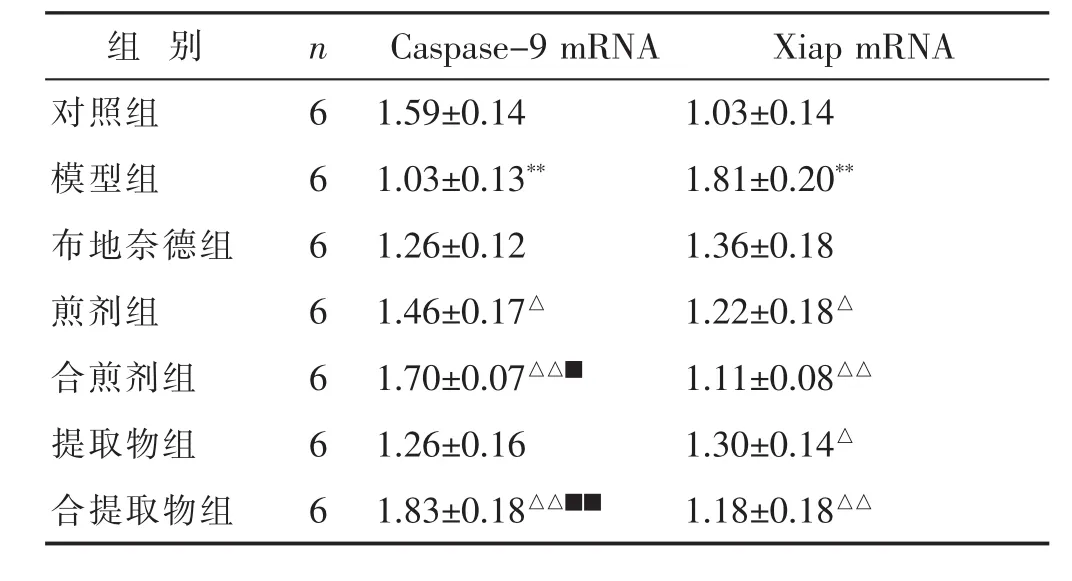
表4 各组肺组织Caspase-9、Xiap mRNA表达比较(±s)
组 别 n Caspase-9 mRNA Xiap mRNA对照组 6 1.59±0.14 1.03±0.14模型组 6 1.03±0.13** 1.81±0.20**布地奈德组 6 1.26±0.12 1.36±0.18煎剂组 6 1.46±0.17△ 1.22±0.18△合煎剂组 6 1.70±0.07△△■ 1.11±0.08△△提取物组 6 1.26±0.16 1.30±0.14△合提取物组 6 1.83±0.18△△■■ 1.18±0.18△△
2.3 各组大鼠肺组织Fas、Hras、NF-κB mRNA表达的比较 见表5。与对照组比较,模型组大鼠肺组织NF-κB mRNA 显著升高 (P<0.01),Fas及 Hras mRNA 无统计学意义 (P>0.01)。与模型组比较,5个给药组对NF-κB mRNA 差异有统计学意义(均P<0.01);煎剂组、合煎剂组、合提取物组Fas mRNA表达差异有统计学意义(P<0.05或P<0.01);各给药组对 Hras mRNA均无显著影响。与布地奈德组比较,合煎剂组Fas、Hras mRNA表达差异有统计学意义(P<0.05),合提取物组Hras mRNA差异有统计学意义(P<0.01)。
表5 各组大鼠肺组织 Fas、Hras、NF-κB mRNA 表达比较(±s)

表5 各组大鼠肺组织 Fas、Hras、NF-κB mRNA 表达比较(±s)
组 别 n Fas mRNA对照组 6 1.24±0.27模型组 6 1.40±0.24布地奈德组 6 1.93±0.18煎剂组 6 2.40±0.34△合煎剂组 6 2.88±0.39△△■提取物组 6 2.18±0.28合提取物组 6 2.61±0.30△△Hras mRNA NF-κB mRNA 0.56±0.25 1.36±0.11 2.27±0.32 3.58±0.29**1.55±0.26 1.52±0.15△△0.97±0.29■■ 2.28±0.40△△2.55±0.30■ 1.88±0.39△△2.92±0.26■■ 1.80±0.20△△2.70±0.26■■ 1.42±0.27△△
3 讨 论
哮喘的标志性病理特征是气道炎症和气道重塑[9],主要表现为气道嗜酸性粒细胞炎症,上皮下网状基底膜厚度增加,气道平滑肌质量增加,血管生成和杯状细胞增生等。故抗炎,改善或逆转气道重塑是治疗哮喘的重要方法。细胞凋亡(apoptosis),又称程序性细胞死亡,是在一定的生理或病理条件下,为维持内环境稳定,由基因调控的细胞自主性、有序性的死亡过程[10]。研究表明[11],细胞凋亡的异常是哮喘重要的发病机制之一。哮喘模型中炎性细胞如嗜酸性粒细胞、淋巴细胞、巨噬细胞等,及血管、支气管平滑肌细胞凋亡出现凋亡水平异常降低,而上皮细胞凋亡水平异常升高。这导致气道狭窄、炎性因子和趋化因子分泌增多,进一步加重气道高反应性、炎性细胞浸润、黏液过多分泌、气道的病理性损伤等[12]。
目前细胞凋亡信号转导通路主要包括外源性途径、内源性途径(又称线粒体凋亡途径)及内质网途径,3条通路相互密切关联,在多种凋亡因子参与下,形成一个复杂的网络,对凋亡进行精细地调控[13]。内源性途径的凋亡通路是由线粒体介导的细胞色素C的释放和Caspases激活的生物化学通路。已有研究表明,在哮喘等呼吸系统疾病的发生发展中,线粒体的功能及其结构被破坏,影响大量细胞功能,如离子调节(特别是 Ca2+)、增殖和凋亡等[14]。 Caspase-9 是凋亡信号的启动者,可与上游死亡信号转导通路中的分子结合,形成二聚体,通过自身催化而激活,进而诱导凋亡。Caspases酶的抑制因子IAPs(inhibitors of apoptosis proteins)蛋白家族是一类具有抗凋亡活性的蛋白质,可通过抑制Caspase家族成员介导的蛋白酶级联反应过程中相关蛋白酶的活性而发挥抑制细胞凋亡的作用。Xiap是IAPs蛋白家族中的一员,可抑制Caspases,参与NF-κB调节等发挥凋亡抑制作用。NF-κB是参与哮喘气道炎症及重塑的重要因子,NF-κB可通过调控参与免疫反应早期和炎症反应各阶段的许多因子,包括:肿瘤坏死因子-α(TNF-α)、白细胞介素-2(IL-2)、白细胞介素-6(IL-6)、趋化因子、黏附分子等,调控细胞凋亡因子如肿瘤坏死因子受体相关因子-1(TRAF-1),抗细胞凋亡的蛋白-1 和-2(IAP1/IAP2)等,从而发挥抑制细胞凋亡的作用[15-16]。综上,Caspase-9和Xiap是调控内源性途径细胞凋亡的重要基因,且主要与蛋白酶级联反应相关。外源性途径的凋亡通路是由死亡受体介导,通过各种信号转到系统传递凋亡信号,诱导细胞凋亡。Fas-FasL途径属于外源性途径。Fas是一种跨膜蛋白,通过与FasL结合可以启动凋亡信号的传导从而促进细胞凋亡。HRas为Harvery鼠肉瘤病毒ras基因的人类同源基因,编码产物为相对分子质量2.1万的蛋白质,称为p21蛋白,与细胞生长有关。HRas可通过Ras-Raf-MEK-ERK途径抑制细胞凋亡。
本研究结果显示,淫羊藿女贞子合用激素布地奈德可协同上调哮喘大鼠肺组织的细胞凋亡水平。qPCR结果显示,与正常组比较,模型组大鼠凋亡促进基因Caspase-9 mRNA表达下调,凋亡抑制基因Xiap、NF-κB mRNA表达上调,Fas及Hras mRNA表达无显著性差异。结果提示哮喘大鼠肺组织细胞凋亡水平下调主要受内源性途径的凋亡通路调控。与模型组比较,中药单用或合用激素可上调Caspase-9、Xiap、Fas mRNA表达,下调NF-κB mRNA表达。与激素组比较,合用组Caspase-9 mRNA表达有显著差异。结果提示淫羊藿女贞子配伍合用激素上调哮喘大鼠肺组织细胞凋亡水平可能与调控 Caspase-9 、Xiap、Fas、NF-κB mRNA 表达有关。其中中药与激素合用上调Caspase-9 mRNA表达的作用强于激素单用。上述研究结果提示调节Caspase-9、Xiap、Fas、NF-κB mRNA 的表达是淫羊藿女贞子合用激素治疗哮喘的作用机制之一,且主要通过调节内源性途径的细胞凋亡,上调肺组织的凋亡水平,从而改善哮喘的气道炎症及气道重塑的病理改变。
