低浓度纳米银促进脐带间充质干细胞成骨分化的研究
2019-06-27毕懿康黄默冉周路吴琪时潇耿彩云李红艳王海妹张艺
毕懿康 黄默冉 周路 吴琪 时潇 耿彩云 李红艳 王海妹 张艺
亓建洪 秦晖
骨缺损是骨科常见的较难处理疾患之一,近年来,随着组织工程技术的发展,采用特定细胞结合组织支架修复骨缺损成为可能。干细胞具有良好的增殖能力和多向分化能力,可作为种子细胞应用于组织工程中[1]。相比于骨髓间充质干细胞,人脐带来源的间充质干细胞(hUCMSC)具有资源丰富,采集时无损伤,免疫原性低等优点,已成为新型种子细胞而广泛用于组织工程领域的研究和应用中[1-3]。
植入组织工程支架不可避免地存在感染风险,将抗生素装载于支架是常用的预防感染方法。但是,特定抗生素的抗菌范围有限且存在耐药可能,限制了其使用[4]。银是强效广谱抗菌剂,可以杀灭革兰氏阳性和阴性细菌、真菌、某些病毒及一些耐药细菌,且病原微生物不会对银产生抵抗[5-8]。纳米银通过改变银的比表面积,可进一步扩大其抗菌能力。目前,纳米银已是医学领域应用最广泛的纳米材料。有研究将纳米银作为抗菌剂加载于组织工程支架预防感染,结果显示,纳米银可预防感染并具有良好的生物相容性[9]。已有一些研究将纳米银作为抗菌材料加载于多种组织工程支架[4, 10-11],但有关纳米银对hUCMSC的作用,如毒性反应、对成骨分化的影响及其机制等,尚缺乏较为详尽的研究。
本研究拟通过探究纳米银对hUCMSC的作用及其相关机制,为采用加载纳米银及hUCMSC的组织工程支架修复骨缺损提供依据。
1 材料与方法
1.1 实验材料
主要试剂:纳米银水溶液(纳米银直径约20 nm,质量浓度2 g/L)购自沪正纳米科技有限公司,硝酸银购于美国Sigma Aldrich公司;α-基础培养基(α-MEM)、胎牛血清(FBS)、1% 青霉素-链霉素双抗、0.25% 胰蛋白酶/EDTA及成骨诱导培养液均购自美国Gibco公司;CCK-8试剂盒购自日本Dojindo公司;抗CD44、抗CD90小鼠单克隆抗体及羊抗鼠抗体均购自英国Abcam公司;BCIP/NBT碱性磷酸酯酶显色试剂盒购自上海碧云天生物公司;琼脂糖微珠购自美国Billerica公司;BCA蛋白测定试剂盒购自美国Rockford公司;茜素红染液和罗丹明-鬼笔环肽染液购自美国Sigma公司;DAPI染液、TRIzol试剂购自美国Invitrogen公司; PrimeScriptTMRT试剂盒、SYBR Premix Ex TaqⅡ试剂盒均购自日本Takara公司
主要设备:透射电镜(日本Tokyo公司)、酶标仪(BIO-TEK ELX- 800,美国宝特公司)、倒置显微镜(DFC420C,德国莱卡公司)。
本研究经泰山医学院伦理委员会批准(批件编号:201758),人脐带由泰山医学院附属中心医院妇产科提供。
1.2 纳米银的准备和观察
根据Liu等[12]报道的方法提纯纳米银,简述如下:购买的纳米银溶液以21 000×g离心15 min,去除上清液后加入3 mL钝化剂(1% 1,2,3—苯并三唑),再以9 500×g离心20 min;所得纳米银用丙酮、100%酒精清洗,于真空干燥箱中45 ℃干燥24 h。干燥后的纳米银用无菌去离子水在超声条件下配制成质量浓度2 g/L的储存液,4 ℃避光保存。硝酸银溶液以同样方法配制。
取1滴配制好的纳米银溶液(质量浓度2 g/L)滴于铜网表面,干燥后以透射电镜观察纳米银的形态和大小。
1.3 hUCMSC的分离及鉴定
取人脐带于无菌条件下剔除血管及被膜,分离得到沃顿胶,清洗后剪碎,置于15 mL离心管中,加入Ⅱ型胶原酶消化,37 ℃水浴锅加热2 h,震荡、离心后加入α-MEM培养基中,混匀后转移至10 cm培养皿内,放入37 ℃含5% 二氧化碳(CO2)的培养箱中,待细胞生长到70% 左右进行传代,取第3~5代细胞用于实验。
采用免疫荧光双染方法鉴定hUCMSC的表型。取第3代培育细胞,以0.25% 胰酶消化,制备细胞悬液,滴加于6孔板的爬片上,置入37 ℃含5% CO2的培养箱中约6 h。然后以4%多聚甲醛固定,PBS清洗,1% 牛血清白蛋白孵育1 h。加入一抗(1∶1 000抗CD44和1∶200抗CD90),平放于湿盒内,4 ℃孵育过夜。然后以PBS清洗,加二抗孵育50 min,再予PBS清洗后滴加DAPI染液,避光下室温孵育5 min后封片,荧光倒置显微镜下观察并采集图像。
1.4 细胞毒性实验
采用CCK-8试剂盒分析纳米银及银离子(硝酸银提供)对hUCMSC的毒性作用。将hUCMSC以细胞密度5×103个/孔接种于96孔板,过夜培养;更换含有不同质量浓度(0、0.05、0.1、0.5、1、2、4、8、16、32、64 μg/mL)的纳米银生长培养液和不同质量浓度(0、0.05、0.1、0.5、1、2、4、8、16、32、64 μg/mL)的硝酸银生长培养液,均培养24 h,其中0 μg/mL作为对照;去除含纳米银、硝酸银的培养液,每孔加入100 μL含10% CCK-8溶液的生长培养基,孵育4 h;用酶标仪在波长450 nm处读取每孔溶液的吸光度(OD450)。通过以上实验得出纳米银及硝酸银的最大安全质量浓度,以此质量浓度进行后续实验。
1.5 纳米银和银离子对hUCMSC成骨分化的影响
采用碱性磷酸酶(ALP)活力、茜素红染色和定量逆转录聚合酶链反应(qRT-PCR)检测纳米银及银离子在最大安全质量浓度(硝酸银2 μg/mL、纳米银4 μg/mL)时对hUCMSC成骨分化的影响。后续实验分3组进行,采用不同的培养基培养hUCMSC:空白组采用 α-MEM完全培养基(含10% FBS,1% 青霉素-链霉素双抗),硝酸银组采用含2 μg/mL硝酸银的α-MEM完全培养基,纳米银组采用含4 μg/mL纳米银的 α-MEM完全培养基。
ALP检测:hUCMSC以细胞密度2×104个/孔接种于24孔板中,当细胞生长接近80% 融合时,分别以含硝酸银 2 μg/mL和纳米银 4 μg/mL的α-MEM完全培养基培养24 h,然后去除含银培养液,用pH 7.4的PBS冲洗3次,更换为成骨诱导培养液培养。于第3、7、14 d 采用 BCIP/NBT 碱性磷酸酯酶显色试剂盒进行染色,在倒置显微镜下观察拍照。采用ALP试剂盒,根据说明书步骤测试ALP活力。于波长405 nm处测试其吸光度(OD405),对ALP活力水平进行定量分析。
茜素红染色:hUCMSC的成骨诱导方法与ALP检测时相同[13]。诱导14 d后,细胞用PBS冲洗3次,4%中性多聚甲醛固定30 min,茜素红染液染色15 min[14]。冲洗去除未结合的茜素红染液,显微镜观察、拍照。为了定量细胞外的基质矿化,用氯化十六烷基吡啶溶解结合的茜素红,在波长562 nm处测试其吸光度(OD562),并用总蛋白标准化。
qRT-PCR测试:hUCMSC以细胞密度1×105个/孔接种于6孔板,按照上述方法进行成骨诱导。在第3、7、14 d,用TRIzol试剂提取各组细胞的总RNA,用PrimeScriptTMRT试剂盒将总RNA逆转录为互补DNA,用SYBR Premix Ex TaqⅡ在Bio-Rad C1000 PCR仪上进行qRT-PCR分析,目的基因为Runt相关转录因子(Runx)2、骨桥蛋白(OPN)、骨钙蛋白(OCN)、骨形态发生蛋白(BMP)-2、Ⅰ型胶原蛋白α1链(COL1A1),其引物序列见表1。目的基因表达水平用甘油醛-3-磷酸脱氢酶(GAPDH)标准化。

表1 qRT-PCR所用引物序列
1.6 肌动蛋白细胞骨架染色
将200 μL细胞悬液(每mL含2×104个细胞)滴于盖玻片上,放于6孔板内,等待4 h,待细胞贴片后加入2 mL生长培养液;过夜培养后,硝酸银组和纳米银组分别加入含2 μg/mL硝酸银和含4 μg/mL纳米银的α-MEM完全培养液,空白组加入α-MEM完全培养液,各组均孵育24 h。用PBS冲洗后,各组细胞用4% 中性多聚甲醛固定,0.5% 曲通 X-100打孔,然后分别用罗丹明-鬼笔环肽染色30 min和DAPI染色5 min,用荧光显微镜观察细胞骨架及细胞核的变化。
1.7 RhoA蛋白活力检测
将hUCMSC以细胞密度1×105个/瓶接种于T-25细胞培养瓶中,当细胞生长接近80% 融合时,分别加入含2 μg/mL硝酸银和4 μg/mL纳米银的 α-MEM完全培养液,作用24 h后用PBS冲洗。使用文献报道的方法裂解细胞[15],在4 ℃条件下,以3 000×g离心3 min,提取上清液。在上清液中加入Rho靶蛋白共轭的琼脂糖微珠,在4 ℃条件下孵育45 min,以3 000×g离心3 min,用冲洗缓冲液清洗,最后重悬于十二烷基硫酸钠-聚丙烯酰胺凝胶电泳缓冲液中。使用蛋白免疫印迹法测定,β-actin蛋白作为标准量化蛋白。
1.8 统计学方法
实验均重复3次。使用SPSS软件进行统计分析,计量资料使用平均值±标准差表示,两样本比较采用独立样本t检验,多个样本比较采用单因素方差分析,进一步两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 纳米银的形态及大小
透射电镜显示,纳米银为圆形或类圆形的散在颗粒,大小较均一,见图1。纳米银颗粒直径为(18.8±4.2)nm,其中直径约20 nm颗粒占比最高,达44.5%,见图2。

图1 透射电镜下纳米银形态
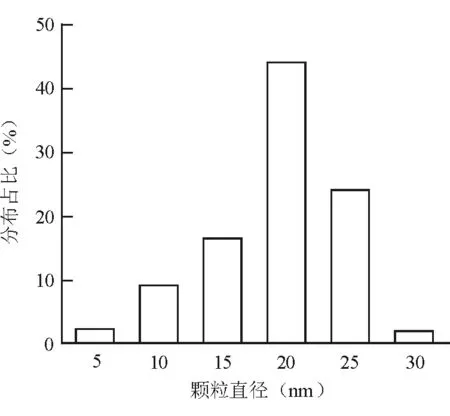
图2 纳米银颗粒直径分布
2.2 hUCMSC的分离及鉴定
hUCMSC在原代培养约7 d可看到细胞贴壁,镜下见细胞呈多边形、梭型、纺锤形,增殖活力较强。免疫荧光双染显示hUCMSC同时表达CD 44和CD 90,表明分离培养所得细胞是hUCMSC。见图3。
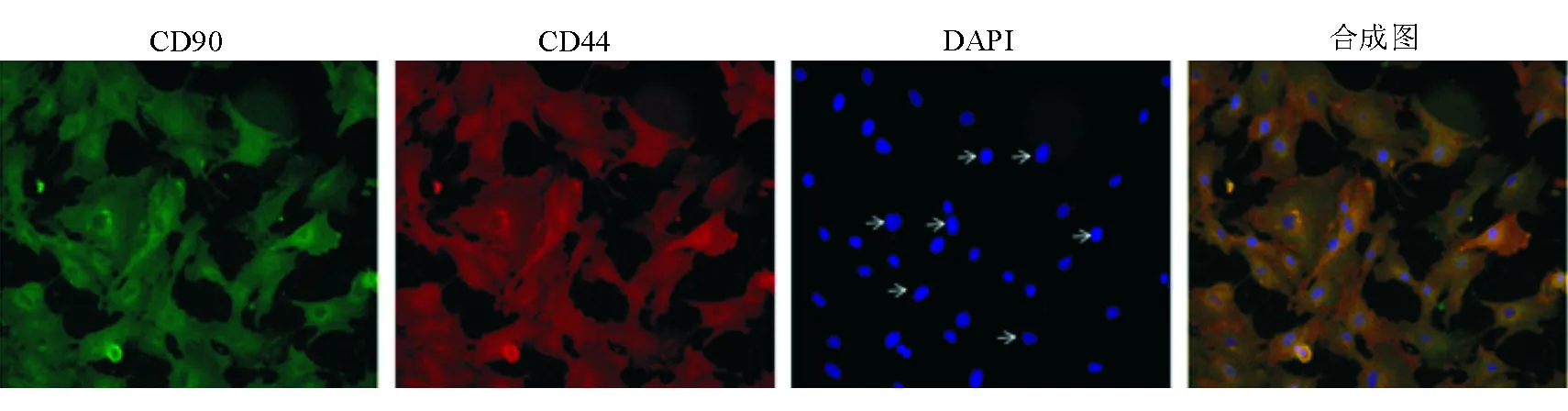
图3倒置显微镜下hUCMSC免疫荧光双染图像(×200) a. CD 90显示绿色荧光 b. CD 44显示红色荧光 c. DAPI染色示细胞核为蓝色(箭头所示) d. a、b和c的合成图。
2.3 细胞毒性实验
CCK-8实验显示,与0 μg/mL组比较,硝酸银质量浓度达到4 μg/mL时OD450值明显下降[(1.96±0.14)对(1.00±0.11),P=0.002],纳米银质量浓度达到8 μg/mL时OD450值明显下降[(1.91±0.08)对(0.98±0.16),P<0.01]。也就是说,直到纳米银质量浓度达到4 μg/mL,或硝酸银质量浓度达到2 μg/mL时,对细胞无明显毒性作用。见下页图4。在后续实验中,选用最大安全质量浓度纳米银4 μg/mL、硝酸银2 μg/mL进行。

图4 不同质量浓度纳米银及硝酸银的细胞毒性实验结果
2.4 对成骨分化的影响
2.4.1 ALP检测
对hUCMSC进行成骨分化诱导第3、7、14 d后ALP显色检测显示,与空白组和硝酸银组相比纳米银组细胞着色更深,表明细胞内ALP 含量更高,见图5。ALP 定量检测显示,诱导3 d后,空白组、硝酸银组和纳米银组的OD405值分别为(0.44±0.14)、(0.46±0.04)和(0.52±0.12),各组之间无差异(P均>0.05);诱导7 d后,空白组、硝酸银组和纳米银组的OD405值分别为(1.14±0.14)、(1.07±0.25)和(1.42±0.16),空白组与硝酸银组比较无差异(P=0.59),空白组和硝酸银组均明显低于纳米银组(P=0.002和P=0.001)。诱导14 d后,空白组、硝酸银组和纳米银组的OD405值分别为(1.85±0.20)、(1.81±0.22)和(2.31±0.39),空白组与硝酸银组比较无差异(P=0.83),空白组和硝酸银组均低于纳米银组(P=0.02 和P=0.017)。
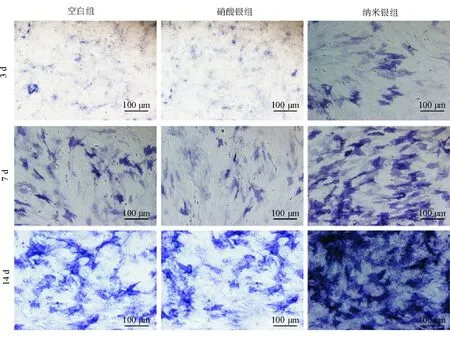
图5 hUCMSC成骨分化诱导后ALP 染色情况
2.4.2 茜素红染色
hUCMSC成骨诱导后茜素红染色显示,与空白组及硝酸银组相比,纳米银组有更多的矿化结节,见图6。定量测试OD562值分别为空白组(0.60±0.08)、硝酸银组(0.51±0.16)和纳米银组(1.06±0.18),空白组与硝酸银组比较无差异(P=0.33),空白组和硝酸银组均明显低于纳米银组(P=0.002和P=0.001)。
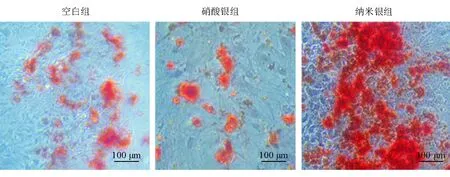
图6 茜素红染色检测细胞外基质矿化钙结节的显微图片(×100)
2.4.3 qRT-PCR检测结果
与空白组相比,硝酸银组在培养3、7、14 d后,成骨分化相关基因的表达水平无明显差异(P均>0.05)。与空白组相比,纳米银组培养3 d后Runx2、OCN、OPN、COL1A1的表达水平显著上调(P均<0.05),培养7 d后Runx2、OCN、BMP-2、OPN、COL1A1的表达水平显著上调(P均<0.05),培养14 d后Runx2、OCN、BMP-2、OPN的表达水平显著上调(P均<0.05)。见表1。
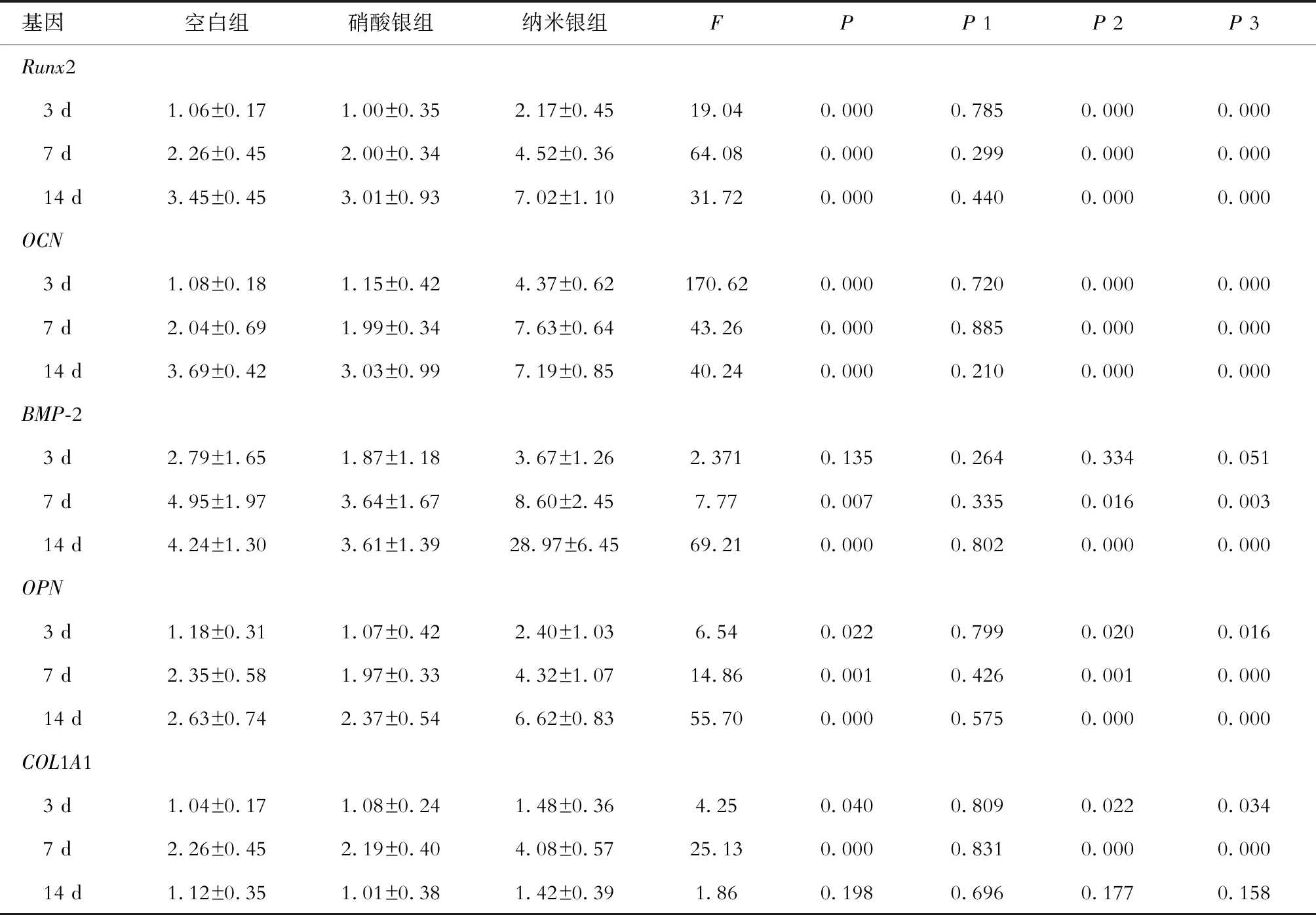
表1 纳米银和硝酸银对hUCMSC成骨分化相关基因表达的影响
注:F、P为3组单因素方差分析,P1为硝酸银组与空白组比较,P2为纳米银组与空白组比较,P3为硝酸银组与纳米银组比较
2.4.4 肌动蛋白细胞骨架的聚合
肌动蛋白细胞骨架染色结果显示,空白组hUCMSC为正常的肌动蛋白应力纤维染色,纳米银组的丝状肌动蛋白染色强于硝酸银组及空白组。该结果表明,纳米银促进了肌动蛋白聚合,而硝酸银无此作用。见图8。
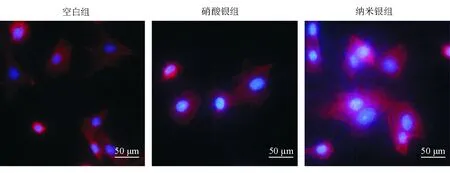
图8 肌动蛋白细胞骨架染色图像 罗丹明-鬼笔环肽染色后丝状肌动蛋白显示红色,DAPI染色后细胞核显示蓝色
2.4.5 RhoA蛋白活力
空白组、硝酸银组和纳米银组的总RhoA蛋白水平相似。GTP-RhoA/Total-RhoA比值分别为空白组(0.56±0.036)、硝酸银组(0.51±0.07)和纳米银组(0.87±0.04),空白组与硝酸银组无差异(P=0.54), 纳米银组高于空白组(P=0.003),也高于硝酸银组(P=0.026),说明纳米银提高了活化Rho蛋白水平,而硝酸银无此作用。见图9。

图9 蛋白质印迹法检测活化RhoA蛋白水平 a. 蛋白表达显影条带 b. 灰度值定量分析蛋白表达*P<0.05
3 讨论
本实验成功分离出hUCMSC。
我们发现纳米银及硝酸银对hUCMSC的细胞毒性作用与其质量浓度呈正相关,当纳米银质量浓度超过4 μg/mL、硝酸银质量浓度超过2 μg/mL时产生明显的细胞毒性作用。故我们采用最大安全质量浓度纳米银4 μg/mL、硝酸银2 μg/mL进行实验,该质量浓度远高于文献报道的纳米银最低抑菌浓度(对酵母菌为0.7 ng/mL,对大肠杆菌为0.35 ng/mL,对金黄色葡萄球菌为3.5 ng/mL)[16]。
我们的实验结果显示,纳米银可促进hUCMSC的成骨分化水平,而硝酸银则对成骨分化没有影响。Mahmood等[17]报道,一些纳米材料(含纳米银)可提高MC3T3-E1成骨细胞的矿化水平,这与我们的研究结果相似。他们认为,该作用是通过纳米银刺激成骨相关基因表达的上调产生的。通过qRT-PCR,我们检测了hUCMSC成骨相关基因的表达。硝酸银作用3 d后,hUCMSC的成骨相关基因表达无明显变化。然而,纳米银作用后,成骨相关基因表达水平显著提高。结合纳米银促进ALP活力及提高细胞外基质矿化水平的作用,我们可以推断出纳米银是通过上调成骨相关基因表达,来提高hUCMSC的成骨分化能力。
然而,纳米银通过什么途径提高干细胞的成骨分化呢?Huang等[18]报道,介孔氧化硅纳米颗粒可以活化RhoA蛋白,引起细胞肌动蛋白聚合,进而激活hUCMSC的成骨分化通路,促进成骨分化。已有很多文献报道,高水平的活化状态RhoA蛋白和高张力的细胞骨架可以诱导干细胞成骨分化[15, 19-21]。McBeath等[15]认为,干细胞的活化RhoA可使干细胞向成骨细胞分化,而非活化的RhoA则使干细胞向成脂细胞分化,并证明该作用是通过激活Rho蛋白激酶,从而增加细胞骨架张力引起。Arnsdorf等[20]报道,RhoA蛋白激活可以提高细胞骨架张力,这是干细胞成骨分化的必要条件。因此我们猜测,纳米银也是通过上调活化RhoA蛋白水平,增加细胞骨架张力,来促进hUCMSC成骨分化。我们采用鬼笔环肽染色细胞的肌动蛋白张力纤维。实验显示,hUCMSC经纳米银作用后,肌动蛋白纤维增粗,显影清晰,聚合水平增高;而经硝酸银作用后,与空白组相比无显著变化。活化RhoA蛋白定量检测显示,纳米银提高了活化RhoA蛋白水平,而硝酸银则无此改变。以上实验结果表明,纳米银通过上调活化RhoA蛋白水平,促进干细胞肌动蛋白聚合,提高hUCMSC的成骨分化能力。
纳米银是如何上调活化RhoA蛋白水平的呢? Khatiwala等[19]报道,细胞培养基底材料的变化可通过结合在胞浆膜上整合素的变化激活下游蛋白络氨酸激酶,进一步催化RhoA蛋白。当纳米银作用于hUCMSC后,可粘附于细胞表面,这在一定程度上可看作培养基底改变。纳米银通过与某些特定整合素结合,引起RhoA蛋白活化,而其具体机制尚需要进一步研究。
本研究显示,纳米银在4 μg/mL时无毒性作用的。在此浓度,纳米银可以活化RhoA蛋白,诱导肌动蛋白聚合,增加细胞骨架张力,最终促进hUCMSC的成骨分化。因为硝酸银(提供银离子)无此作用,我们认为,纳米银是通过其本身而非释放的银离子产生上述作用的。纳米银可以和hUCMSC共存并用于组织工程支架,为临床骨缺损的修复提供可能。
本研究是为以后在组织工程支架上同时加载纳米银及hUCMSC修复骨缺损所做的前期研究。纳米银可以因大小[12]、形状[22]及表面包被材料[23]不同而具有不同性能,因此,不同种类纳米银对干细胞的作用还需要更多的试验进行证实。
