大矩阵IMR重建技术对肺结节图像质量的影响
2019-06-27姜文龙石明国李剑王帅陈寒郑敏文印弘石磊
姜文龙,石明国,李剑,王帅 ,陈寒,郑敏文,印弘,石磊
空军军医大学西京医院 a. 放射科;b. 骨科,陕西 西安 710032
引言
肺癌作为最常见的恶性肿瘤之一,2018年全球肿瘤新发病例为1810万例,其中肺癌新发病例为210万例,占全部肿瘤新发病例的11.6%[1]。肺癌的分期与预后密切相关,早期肺癌患者术后5年生存率高达70%,而中晚期肺癌患者术后5年生存率仅约为20%[2]。影像学已成为临床癌症筛查和诊断不可或缺的方法,且随着相关技术的不断发展,对图像质量的要求也越来越高[3]。近年来随着大矩阵CT扫描技术的发展以及多层螺旋CT的广泛应用,CT越来越成为肺部疾病的诊断最佳方式,低剂量CT逐渐成为高危人群肺结节筛查的重要手段[4]。但是常规CT扫描分辨率较低,遇到较复杂肺结节病灶情况时需要进行手术探查或活体穿刺等方式深入了解肺结节病灶情况,对患者造成极大的痛苦[5]。传统的滤波反投影算法(Filtered Back Projection,FBP)重建速度快,应用较为广泛,但是FBP算法所重建的图像噪声较大,特别是在薄层图像时图像质量欠佳,影响诊断。全模型迭代重建技术(Iterative Model Reconstruction,IMR)是最新一代的迭代重建技术,相比混合迭代重建在抑制噪声、提高图像质量方面的能力更强。一些研究表明,全迭代重组IMR技术与传统FBP相比,能够在降低一定辐射剂量的前提下,改善图像质量[6-8]。笔者在最近一年的工作中通过对355例肺结节患者的图像进行回顾性分析,来研究大矩阵IMR技术对肺部图像质量的提升,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2018年1月至7月来我院行胸部CT检查的355例患者肺结节CT图像,男性253例,女性102例,平均年龄(60.56±11.43)岁,平均体重(58.13±7.65)kg。355例患者均符合肺结节纳入标准[9]:① 经手术病理证实或活体穿刺确诊;② 肺结节为首次发现,既往健康;③CT检查前未进行抗肿瘤治疗;④ 患者及其家属知情同意;⑤ 本研究已获医学伦理委员会批准。排除标准:① 妊娠期及哺乳期妇女;② 患有严重先天性心脏病或急性心肌炎等;③ BMI>23的患者。355例患者均进行FBP和IMR重建,分为A、B两组,A组采用512矩阵滤波反投影重建(Filtered Back Projection,FBP)和B组采用1024大矩阵全迭代(Iterative Model Reconstruction,IMR)重建。
1.2 扫描方法
每位患者均采用飞利浦128排iCT进行扫描,扫描范围从肺尖至肺底,深吸气后屏气扫描,扫描条件为管电压100 kV,参考管电流80 mAs,螺距1.0,球管旋转时间0.8 s,层厚5 mm,层间隔5 mm。
1.3 图像后处理
在飞利浦EBW4.5.1工作站上分别进行A组512×512矩阵FBP重建和B组1024×1024大矩阵IMR重建。
1.4 图像分析
把患者薄层图像原始数据传至飞利浦工作站,对图像的质量进行主观和客观评价。
(1)客观评价:测量上中下双肺外侧带噪声值以及主动脉弓、气管分叉处降主动脉、肺底层面降主动脉的噪声值(表1)。
(2)主观评价:由两位高年资医生对重建图像进行双盲测评,采用4分法[10]对图像主观指标进行评价(表2),评价过程中可对窗宽、窗位进行适当调节,如遇到意见不同时则另外邀请一名医生参加讨论,以便得到统一意见来比较两组图像的质量,并对两组图像质量主观评分的一致性采用Kappa检验。

表2 主观评分标准
1.5 统计学分析
采用SPSS 19.0软件对A、B两组的平均噪声值进行统计学分析,计量资料以均数±标准差(±s)表示,比较采用t检验,以P<0.05为有统计学差异性。主观评价采用Kappa检验,其中K值≤0.4为一致性差,0.4<K值≤0.6为一致性中等,0.6<K值≤1.0为一致性好。对于符合正态分布的用表示;反之则用中位数来表示。
2 结果
2.1 图像质量客观评价
A组双肺平均噪声值为42.57±4.83,主动脉平均噪声值为17.34±3.62,B组双肺平均噪声值为33.25±4.36,主动脉平均噪声值为5.65±1.12,A、B两组差异(双肺噪声P<0.05,主动脉噪声P<0.01),有统计学差异(表3)。图1为A、B两组纵膈窗噪声值对比,图2为肺窗噪声值对比。
表3 图像质量客观比较(s)
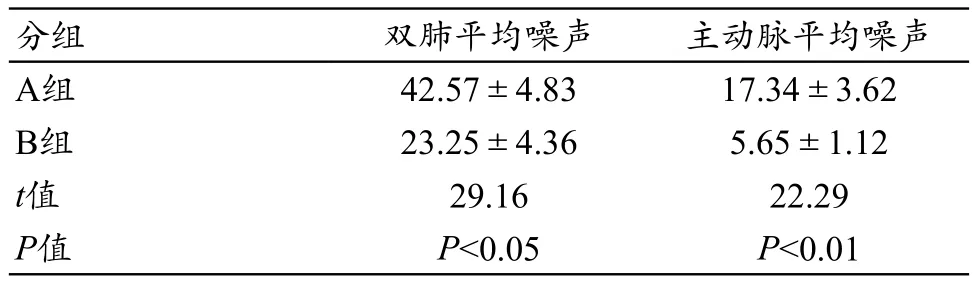
表3 图像质量客观比较(s)
images/BZ_24_1284_2097_2241_2150.pngA组 42.57±4.83 17.34±3.62 B组 23.25±4.36 5.65±1.12 t值 29.16 22.29 P值 P<0.05 P<0.01
2.2 图像质量主观评价
两名医生间的一致性均较好(K=0.675~0.864,P<0.05),两名医医生对两组图像进行低对比分辨率(Low Contrast Detectability,LCD)、图像失真(Image Distortion,ID)和诊断信心(Diagnosis Confidence,DC)评分,LCD评分的K值分别为0.681、0.675;ID评分的K值分别为0.675、0.675;DC评分的K值分别为0.864、0.771(表4)。LCD、ID和DC评分A、B两组之间具有统计学差异性(P<0.001,表5),A组LCD、ID及DC评分中位数分别为3、4、4分,B组LCD及ID评分中位数分别为4、3、4分(表5)。图3为A、B两组肺结节显示对比,B组对肺结节显示要优于A组。
表1 图像噪声值统计(

表1 图像噪声值统计(
images/BZ_24_236_2855_2241_2909.pngA组 36.05±5.37 48.95±6.58 47.05±5.15 15.15±3.75 17.56±4.92 22.3±3.16 B组 20.95±4.22 27.85±5.71 25.85±5.36 4.48±1.21 5.14±1.15 6.87±1.08 P值 P<0.05 P<0.05 P<0.05 P<0.01 P<0.01 P<0.01
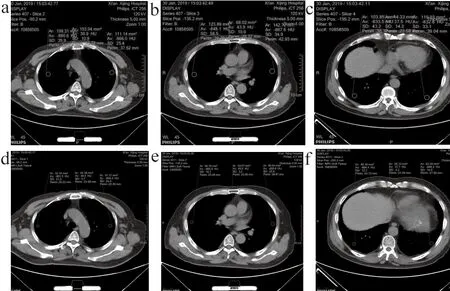
图1 A、B两组纵膈窗噪声值对比
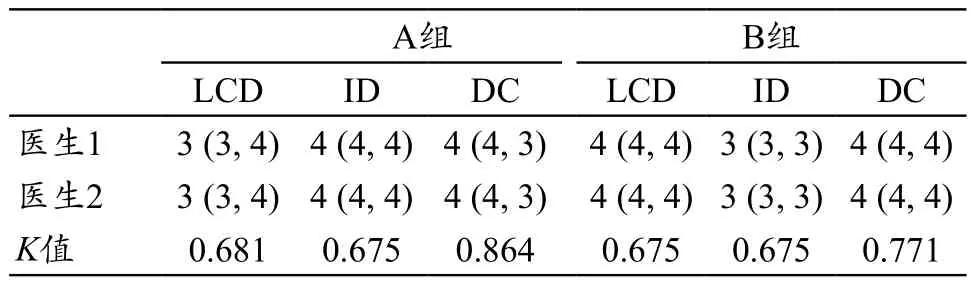
表4 主观评价一致性检验(中位数与四分位数)
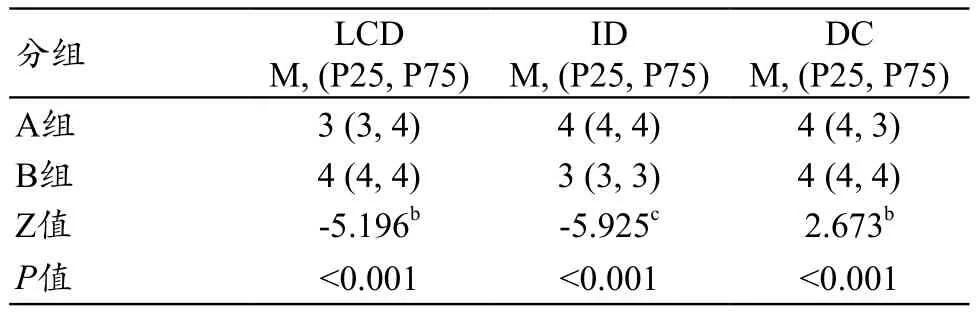
表5 主观比较(中位数与四分位数)
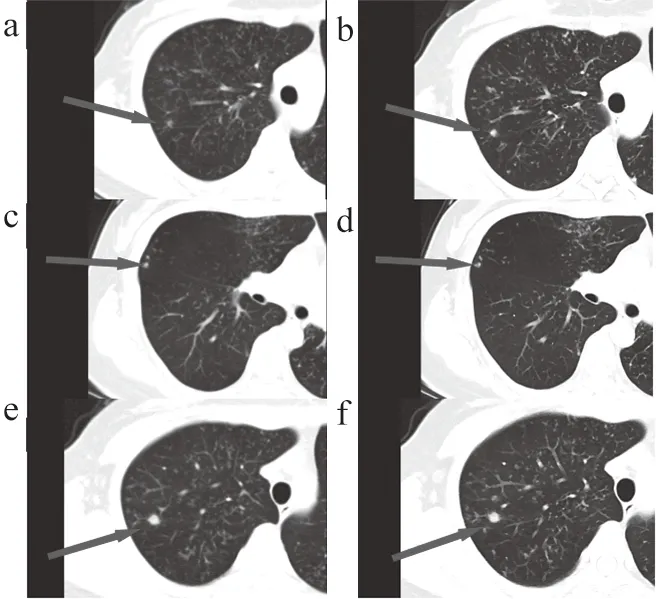
图3 A、B两组肺结节显示对比
3 讨论
3.1 大矩阵技术
在同等的FOV条件下,1024分辨率矩阵能够使单位面积内的有效像素提高到常规CT的4倍左右[11-12],较常规512矩阵可以更好地显示图像细节,对于肺结节,特别是对微小结节的形态、大小、结构特征的显示更具有优势,对于鉴定肺结节的良恶性可以提供更多的形态学依据(图3)。B组CT图像质量评分明显高于A组,可能原因与高分辨率CT通过采用小显示视野及大矩阵而形成的容积效应有关[13]。
3.2 IMR有关技术
很多胸部病变需要采用薄层图像观察,但是层厚越薄,噪声就越大,密度分辨率就会降低[14]。目前应用最广泛的迭代技术为部分迭代,虽然同时基于图像域和原始数据域,但其通常混有 FBP成分,优点在于重建速度快、可适性较强,但在大幅度降低剂量等严苛条件下,图像质量难以达到诊断要求[15]。IMR是经过FDA认证的新型全迭代重建技术,经过更加复杂的迭代运算和更多的迭代次数,采用更为全面、完整的系统模型进行对比校正,最终获得高分辨率、低噪声的CT图像[16]。与以往部分迭代重组(如SAFIRE、ASIR、Idose、ADMIRE等)相比,能够消除FBP的影响,更大程度保证低剂量条件下的图像质量;改良后的技术同时能够明显缩短重建时间,提高工作效率。IMR降低辐射剂量的能力在胸部CT及冠状动脉CTA检查中能够在低剂量下保证图像质量,不影响诊断[17-19]。
3.3 IMR技术应用于胸部CT的优势
在本研究中,从图像评价可以看出,B组较A组噪声值降低,应用IMR算法,能够明显降低图像噪声,提高图像的低对比分辨率,从而改善图像质量。
Yuki等[18]报道IMR算法在大幅降低图像噪声的同时,CT图像会出现一部分失真感,继而医生对图像的观察。本研究显示,B组ID评分较A组低,表明IMR算法会引起图像的轻度失真。但是,根据笔者先前研究发现,把IMR算法的参数设置更改为Soft Level1,所发生的轻度失真状况对图像的诊断并没有太大的影响。Singh等[20]认为CT图像诊断自信是评价图像质量的综合标准,用于整体衡量图像质量,不仅取决于病灶低密度对比度以及图像固有噪声,还会受到图像失真、病灶边缘等因素的影响。窦欣等[21]表示IMR能够显著提高图像信噪比和图像质量,能够获得较为理想的图像。本研究中的IMR算法DC评分中位数和四分位数均达到了4分,与FBP算法的DC评分具有统计学差异性,充分表现了IMR算法是可以提高图像的诊断信心。综合来看,IMR算法较FBP算法的图像质量是有所提高的。
本文研究发现,IMR技术对于提高图像质量、降低图像噪声有非常显著的效果,本研究的局限性在于患者的体重指数BMI<23,由于图像质量的好坏与患者体重有关,对于BMI>23的患者并未纳入研究范围内,在以后的研究中应纳入扩充样本量。
综上,大矩阵IMR重建技术对肺结节图像质量可以进行优化,在同一扫描条件下可以得到更高的图像质量。
