O-MAR技术在减少高浓度造影剂硬化伪影中的应用价值
2019-06-27吴志斌李剑郑敏文印弘石明国王栋王帅刘从伟刘豹姜文龙石磊
吴志斌,李剑,郑敏文,印弘,石明国,王栋,王帅,刘从伟,刘豹,姜文龙,石磊
空军军医大学西京医院 a. 放射科;b. 骨科,陕西 西安 710032
引言
随着CTA成像技术应用的日益广泛,上肢血管以及锁骨下动脉血管成像技术能给临床上所提供的诊断意义也越来越大[1]。造影剂注射通常是由静脉血管注入,高浓度造影剂流经静脉会存在部分残留所产生的硬化线束伪影会对周围组织图像质量产生一定影响[2]。以往上肢血管成像为了避免伪影的产生会选择下肢静脉血管注入造影剂,然而下肢静脉注射造影剂也存在一些问题,比如循环时间长,峰值时间不好把握,需要的造影剂量大[3];部分病人下肢静脉栓塞,下肢静脉注射造影剂增加了栓子脱落的风险从而增加了栓塞的风险[4]。所以上肢静脉穿刺也可成为上肢动脉血管成像的较好选择。飞利浦O-MAR技术是一项线性内插法,可去除硬化线束伪影的算法。本研究使用O-MAR技术对行双上肢CTA的患者的图像进行重建,与常规重建算法对比,探讨该技术在去除造影剂硬化线束伪影方面的价值。
1 资料与方法
1.1 一般资料
连续收集2018年2月至2018年8月期间24例来我院就诊疑似上肢血管或锁骨下动脉病变的患者,将所有数据分别运用常规FBP重建和O-MAR重建并分为A、B两组,其中锁骨下CTA检查患者8例,上肢CTA患者16例,平均体重指数BMI为(21±2.1)kg/m2,平均年龄36.3岁,其中女性18例,男性6例。所有CTA检查禁忌症患者被排除在外,所有患者均签署知情同意书。
1.2 扫描方法及图像后处理
采用Philips 256层iCT进行检查,管电压120 kV,管电流最大300 mAs(开启 Z-DOM模式),层厚5.0 mm,层间距5.0 mm,探测器64×0.625,螺距0.9,球管转速0.75 s,扫描矩阵512×512,重建模式选standard B。由于右侧上肢静脉注射造影剂更有利于图像的显影[5],常规选择右侧静脉穿刺,如右侧为患肢则选左侧静脉穿刺。用造影剂跟踪法,在降主动脉内选择感兴趣区监测CT值,当感兴趣区CT值达到150 HU时自动触发扫描,扫描方向为头-足,造影剂采用非离子对比剂碘普罗胺(370 mgI/mL),注射量为1.0 mL/kg,注射流率为4.0 mL/s,对比剂注射完毕立即注射50 mL盐水,流率5.0 mL/s。所有图像均采用两种方法进行薄层重建,层厚1.0 mm,层间距1.0 mm,A组使用FBP(Filer Back Projection)重建技术,B组使用O-MAR迭代重建技术。A、B两组都使用iDose4进行重建,将两组图像都传送至工作站进行MPR、CPR和VR重建,在每组病例中选取一幅伪影最重的轴位图像O-MAR与普通重建伪影 示意图,见图1。
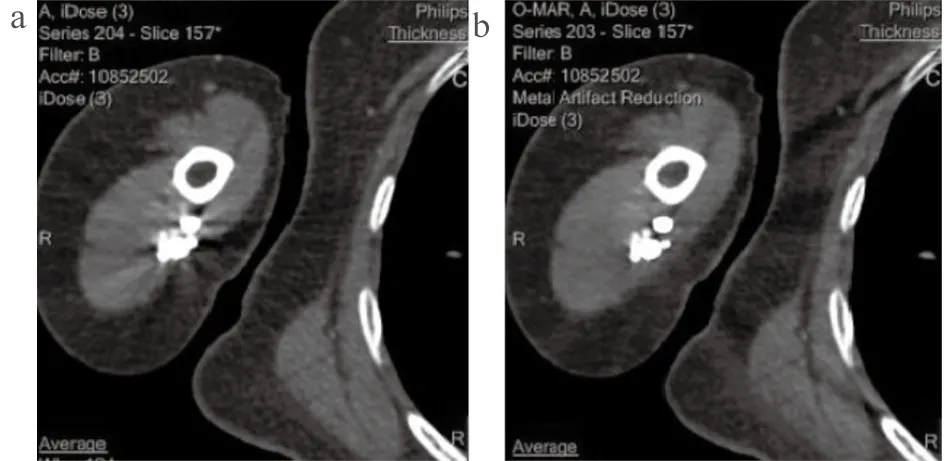
图1 O-MAR与普通重建的伪影示意图
1.3 图像评价
主观评价:由两名放射科主治医师对A、B两组数据的CPR、VR、MPR、重建图像分别进行评分,评价标准为:伪影重,影响周围结构组织分析为0分;伪影较重,周围结构组织欠清晰为1分;伪影不明显,植入物周围结构组织尚清晰为2分;无伪影,周围结构组织可清晰分辨为3分。评分不一致时通过共同协商达成最终评分。
客观评价:选取A组中伪影较重的层面测量其伪影长度;选取该层面伪影最显著1 cm处测量邻近组织噪声值;选取B组中相同层面测量该组图像伪影长度和噪声值,两次测量噪声值位置及测量面积须保持一致,测量面积为(25±0.6)mm2。伪影长度和SD值测量示意图,见图2。
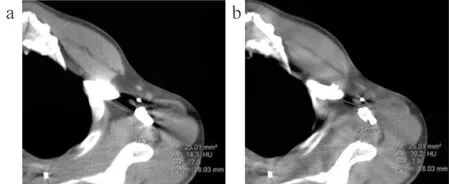
图2 伪影长度和SD值测量示意图
1.4 统计学分析
应用SPSS 19.0软件进行统计学分析。主观评分采用卡方检验,客观评分伪影长度和SD值采用配对t检验,P<0.05为两组间差异存在统计学意义。
2 结果
2.1 主观评价结果
A组图像质量评分平均为1.35,B组质量评分平均为2.25,A、B两组评分具有显著差异χ2=12.6,P<0.05,O-MAR组图像质量显高于FBP组,见表1。
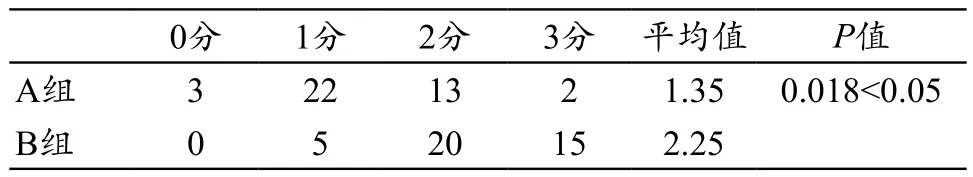
表1 两组数据主观评分结果(例)
2.2 客观评分结果
两组数据客观评分,见表2。客观数据经K-S检验,符合正态分。结果表明,B组图像伪影长度显著短于A组;伪影邻近组织噪声值B组显著低于A组,以上结果的差异均有统计学意义(P<0.05)。邻近组织CT值更接近于正常。
表2 两组数据客观评分(

表2 两组数据客观评分(
images/BZ_17_1284_2052_2244_2105.pngA组B组24 24 36.7±6.8 12.16±5.05 17.23±6.17 12.16±5.05 t值 P值7.03<0.01 5.08<0.01
3 讨论
高原子序数的物质在CT下产生伪影的主要来源是X线的硬化导致相应投影数据缺失而产生伪影[6]。伪影的产生严重影响了该部位图像的清晰度, 给对周围结构的判断也带来了很大的困难[7]。
随着CT血管成像技术应用的日益广泛,上肢动脉和锁骨下动脉血管成像能给临床上提供的诊断意义也越来越大[8]。造影剂从静脉注射到进入心肺循环之前部分会在流经的静脉内有部分残留,这部分残留造影剂因为浓度过高而产生硬化线束伪影。以往为了避免静脉内残留的造影剂产生伪影对循环路径组织的干扰往往会选择健侧穿刺注射造影剂,但是对于双侧上肢病变或者病变尚不明确的患者则无法避免伪影的干扰;下肢静脉注射由于循环路径长需要的造影剂量大,无形中也增加了病人的肝肾负担和造影剂外渗的风险[9],少数病人下肢静脉有栓子,造影剂流经下肢静脉容易造成栓子的脱落造成危险。对此部分病人只能选择上肢静脉注射造影剂。
近年来各种技术逐渐运用于体内植入物的伪影去除方面[10-13],有运用双能量CT单能谱成像技术去除伪影[14]和宝石能谱CT单能量成像去金属伪影的研究已有很多报道[15]。高浓度造影剂在CT图像上伪影主要来源于X线的硬化效应,提高管电压能提高X线的穿透力,可在一定程度上减少伪影[16],但是作用有限,而且将导致患者接受的辐射剂量增加。
本文所探讨的O-MAR是以线性内插为基础,综合了各种技术的去金属伪影的迭代算法。其基本原理是:首先应用标准加权的滤波反投影法进行阈值分割,从而建立一种只有金属的图像;再根据只有金属的图像投影确定因穿过金属而被损坏的投影;最后舍弃沿金属轨迹的投影,用未穿过金属的相邻投影的内插数据替换,从而达到减少金属伪影的效果[17-18]。高浓度造影剂产生伪影的机制与金属类似。在不增加辐射剂量的前提下这种通过反复迭代对比计算,将高原子序数物质造成的伪影数据剔除,直到得到满意的无较大簇高密度像素的图像O-MAR技术可以同时减轻条索状伪影和硬化伪影[19]。O-MAR重建对图像的迭代重建只针对图像中的金属像素而不会影响非金属像素[20]。以往认为,这种CT伪影去除方法主要针对体内金属植入物的病人。本研究表明,O-MAR技术同样适用于去除高浓度造影剂所产生的伪影。本组24例上肢血管CTA应用O-MAR技术后均达到了显著的减轻硬化线束伪影的效果,条状伪影明显减少,周围组织的密度显示更接近于正常值,从而更好地显示周围组织及血管,实现更加优秀的去除金属伪影效果,为图像的诊断提供更大的帮助。
O-MAR去伪影技术同样适用于静脉血管内残留造影剂伪影的去除,纠正了高浓度造影剂周围组织的CT值,使静脉周围的组织能更清楚的显示,为影像诊断提供了更大的帮助。
